Autores
Soares Lasmar, M.C. (UFPA) ; Pinheiro Almeida dos Santos, T. (UFPA) ; Pantoja Gomes, C.D. (UFPA) ; Tavares Teixeira, W.J. (UFPA) ; da Silva Carneiro, A. (UFPA) ; Siqueira Pantoja, S. (UFPA) ; Melo de Oliveira, A. (SEDUCPA) ; Carvalho de Souza, E. (UFRA) ; dos Santos Silva, A. (UFPA)
Resumo
Os indicadores ácido-base são essenciais na análise química, e o uso de objetos do cotidiano dos alunos é uma estratégia adequada para o ensino de química. Neste estudo, o extrato do fruto da Solanum nigrum foi utilizado como indicador natural. Foram realizados experimentos para avaliar sua capacidade de atuar como indicador ácido-base em diferentes faixas de pH. Os resultados mostraram que o extrato acetônico apresentou melhor desempenho na extração das antocianinas presentes nas amostras, exibindo mudanças de cor distintas em meio ácido e alcalino. Esses resultados indicam que o extrato acetônico é um promissor indicador ácido-base natural. Sua utilização pode contribuir para práticas educacionais mais eficazes no ensino de química.
Palavras chaves
Aprendizagem significativ; Experimentação; Recursos naturais
Introdução
Os indicadores ácido-base são compostos fundamentais na análise química e laboratorial, pois permitem identificar a natureza ácida ou básica de uma substância através de mudanças visuais de cor. O uso de objetos existentes no cotidiano dos alunos é considerado uma estratégia adequada para transmitir e abordar os conceitos químicos, e essas estratégias são priorizadas no texto da Lei das Diretrizes e Bases da Educação (BRASIL, 1996), e tem como objetivo fornecer uma nova alternativa simples e de baixo custo para o ensino de química, utilizando corantes contidos em frutas vegetais comumente encontradas no Brasil. Para este trabalho, a espécie utilizada foi frutos da maria preta (Solanum nigrum L.), que são frutos escuros, cujo extrato é de cor vermelha, evidencia a presença de antocianinas (TIMBERLAKE, 1975). O corante usado é adequado para discussão, desde conceitos básicos de equilíbrio químico para alunos do ensino médio, até indicadores ácido-base para cursos universitários de química geral. O caso é de natureza interdisciplinar, desde o processo de extração até a explicação das mudanças de cor, passando pelas diferentes velocidades de reação, aliada à classificação botânica das espécies envolvidas, proporcionando riqueza de detalhes e informações para alunos de diferentes níveis de estudo. Além disso, o baixo custo do experimento facilita o uso em qualquer sala de aula ou laboratório. Os objetivos deste estudo foram avaliar a capacidade do extrato do fruto de erva moura em atuar como indicador ácido-base em diferentes faixas de pH, em solução com acetona comercial e outra com álcool etílico 70%, e analisar em que solução ocorre a melhor extração e melhor indicador obtido.
Material e métodos
As dos frutos de maria moura foram coletadas em um único ponto, do município de Belém, em um jardim comum. Para produzir o indicador a partir do fruto, primeiramente foi pesado 2 g do fruto de maria preta em balança analítica, com o auxílio de uma placa de Petri. Em seguida, a amostra foi macerada através de um grau e um pistilo para reduzir o tamanho das partículas e facilitar a extração. O conteúdo obtido foi adicionado em duas soluções diferentes: uma contendo 100 mL de acetona comercial e a outra com 100 mL de álcool etílico à 70%. Ambas as soluções foram deixadas em repouso por 30 minutos, permitindo a extração adequada das antocianinas presentes no fruto. Passado esse tempo, as soluções foram filtradas utilizando papel de filtro qualitativo para que se pudesse eliminar quaisquer resíduos sólidos e assim obter um extrato líquido. Essas amostras, depois de submetidas a todo esse procedimento, foram armazenadas na geladeira, a fim de garantir a sua estabilidade. Com a perspectiva de testar o indicador, prepararam-se soluções com diferentes concentrações de ácido clorídrico (HCl) e hidróxido de sódio (NaOH), as quais abrangeram um pH que variava de 1 a 13. Para o pH 7 se utilizou água destilada. Uma pequena quantidade de cada solução foi colocada em treze tubos de ensaio e, em seguida, 30 gotas do extrato do fruto da maria preta foi adicionada a cada uma delas. Observou-se as mudanças de cor que ocorreram nas soluções após a adição do extrato. Registrou-se as alterações observadas, via fotografias (Figuras 1 e 2), relacionando-as ao pH de cada solução testada.
Resultado e discussão
A partir dos resultados obtidos através da extração por meio da acetona e álcool
etílico à 70%, foi feita uma escala de pH podendo ser obtida através do pH mais
ácido 1 até o a faixa 13 de alcalinidade. Percebe-se que o extrato cetônico teve
um melhor desempenho para a extração das antocianinas presente nas amostras
(Figura 1), em comparação com o extrato alcoólico (Figura 2). Sendo que, quando
a solução entra em contato com o meio mais extremo da faixa de acidez, observou
uma mudança de coloração para o rosa, já quando adicionada em meio alcalino, a
coloração verde é evidenciada, e esta mudança é mais bem observada na solução
com acetona. Os resultados apresentados foram semelhantes aos encontrados por
Guimarães et al. (2012) que utilizou flores de petúnia como indicador, que da
mesma forma detectou tais cores para ambas as faixas de pH. No estudo realizado
por Ramos et al. (2000) a maria preta variou para as cores vermelho e rosa no
meio ácido, para o azul, verde e amarelo no meio básico. No entanto, as análises
realizadas mostraram que o extrato acetônico foi mais adequado para uso como
indicador ácido-base para os frutos de maria preta. Possui maior capacidade de
extração de antocianinas, que mudam de cor conforme o pH, permitindo melhor
detecção e diferenciação de soluções ácidas e alcalinas. Portanto, o extrato
acetônico é mais promissor como indicador ácido-base e tem boas perspectivas de
aplicação em cursos de química e experimentos práticos.
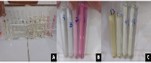
(A) na faixa de pH (1-13); (B) Amostras em pH ácido; \r\n(C) Amostras em pH alcalino.

(A) na faixa de pH(1-13); (B) Amostras em pH básico \r\n(C); Amostras em pH ácido.
Conclusões
O extrato acetônico do fruto de maria moura (Solanum nigrum) demonstrou desempenho superior na extração das antocianinas, em comparação com o extrato alcoólico. A escala de pH permitiu observar mudanças de cor (rosa em meio ácido; verde em meio alcalino), o que é mais evidente no extrato acetônico. Esses resultados indicam que o extrato acetônico é um promissor indicador ácido-base natural e sua utilização contribui para práticas sustentáveis e oferece uma alternativa viável aos indicadores sintéticos convencionais, com boas perspectivas de aplicação em cursos de química experimental.
Agradecimentos
A Universidade Federal do Pará (UFPA) e ao Laboratório de Física Aplicada à Farmácia (LAFFA).
Referências
BRASIL. Lei de Diretrizes e Bases da Educação Nacional, LDB. 9394/1996. BRASIL.
TIMBERLAKE, C. F., BRIDLE, P. The Flavonoids, Harborne. J. B., Marbry, T. J.: Mabry, H. C. F., Eds., Chapman and Hall, London, 1975.
GUIMARÃES W, ALVES MIR, ANTONIOSI FILHO NR. Anthocyanins in natural extracts: application in acid-base titration and identification by liquid chromatography/mass spectrometry.Quím. Nov. 2012.
RAMOS, L, A, LUPETTI ,K, O, CAVALHEIRO, É, T, G, Fatibello-Filho, O. Utilização extratobruto de frutos de Solanum nigrum L. no ensino de química. Eclética Quím. 2000.

