Autores
Furtado, N.J.S. (SEDUC-MA) ; Paz, C.C. (UFPI)
Resumo
Apresentamos o sal de perileno (PTK) como indicador ácido-base para o ensino e aprendizagem de conceitos de ácido, base e pH. Nesse sentido, a pesquisa consistiu na síntese e caracterização do PTK e seu emprego como indicador ácido-base em uma turma de 1ª série do ensino médio. A partir da análise dos resultados, o experimento utilizando o PTK trouxe resultados de aprendizagem positivos para os estudantes. As propriedades ácido-base do PTK contribuíram para a identificação da acidez e basicidade dos produtos usados no cotidiano. Portanto, o PTK mostrou ser um indicador ácido-base viável para utilização em aulas de química na 1ª série do ensino médio. Além disso, apresenta potencial para aplicações futuras em outros conteúdos de química do ensino médio e ensino superior.
Palavras chaves
Sal de perileno; Indicador ácido-base; Experimentação no ensino
Introdução
A experimentação é considerada uma metodologia relevante no ensino de química por pesquisadores da área, pois facilita a compreensão de conceitos, tornando-os concretos na ótica dos estudantes. Os experimentos oportunizam aulas mais atrativas e significativas para os discentes, desde que, sejam empregados de maneira adequada, contribuindo para melhorar o processo de ensino e aprendizagem (LÔBO; MORADILLO, 2003; CRUZ et al, 2016). Um experimento que desperta a atenção e interesse de estudantes são os que contêm mudança de coloração, àqueles que empregam indicadores ácido-base naturais e sintéticos (TERCI; ROSSI, 2002; OLIVEIRA et al, 2021). Nesse sentido, os indicadores ácido-base são alternativas viáveis para utilização no ensino de química, visando facilitar a aprendizagem de conceitos de ácido, base e pH. Todavia, poucas pesquisas apresentam indicadores ácido-base sintéticos diferentes dos convencionais da literatura, sendo uma característica atrativa a presença de fluorescência quando dissolvidas em meios ácidos ou básicos. O sal de perileno (PTK, do inglês 3,4,9,10-perylene tetracarboxylate tetrapotassium), uma substância fluorescente que quando dissolvida em solução aquosa muda de cor com a alteração do pH do meio (NAVEENRAJ; RAJ; ANANDAN, 2012), possibilitando seu emprego como indicador ácido-base alternativo em aulas experimentais para o ensino e aprendizagem de conceitos de ácido, base e pH. Essa aplicação do PTK, segundo nossa revisão, ainda não foi relatada na literatura, tornando-se necessário uma investigação que mostre sua viabilidade como ferramenta pedagógica. Portando, o objetivo desse trabalho foi apresentar o uso do PTK como indicador ácido-base para o ensino e aprendizagem de conceitos relacionados a acidez e basicidade de substâncias químicas.
Material e métodos
A pesquisa é de natureza empírica, a qual foi desenvolvida com o intuito de investigar a aplicabilidade do PTK como indicador ácido-base alternativo para o ensino e aprendizagem de conceitos relacionados aos ácidos e bases, em uma turma de 1ª série do ensino médio do Centro de Ensino Vereador Neide Costa, localizada no povoado Cana Brava, Água Doce do Maranhão. Desse modo, as etapas da pesquisa envolveram a síntese e caracterização do PTK e posteriormente a sua utilização em uma atividade experimental na 1ª série do ensino que contava com 30 alunos matriculados. A síntese e caracterização do PTK foi realizada no departamento de química da Universidade Federal do Piauí (UFPI), em Teresina-PI. O sal foi obtido da reação de seu percursor dianidrido de perileno (PTCDA) com hidróxido de potássio (KOH) (NAVEENRAJ; RAJ; ANANDAN, 2012). O experimento utilizando o PTK como indicador ácido-base foi realizado após uma aula expositiva e dialogada envolvendo os conceitos de ácido, base e pH. A atividade experimental consistiu na verificação de acidez e basicidade de produtos ácidos (suco de limão, ácido muriático e vinagre) e básicos (bicarbonato de sódio, soda cáustica e leite de magnésio) usados no cotidiano, por meio da adição de solução de PTK. Além disso, o pH da água do bebedouro da escola e das casas dos estudantes (trazida por eles em suas garrafas), foi avaliado qualitativamente com a adição do PTK.
Resultado e discussão
A investigação da solução aquosa de PTK (pH > 6,0) mostrou que quando o pH < 4,0
ocorre a formação do derivado ácido de perileno (PTCA) (HARIHARAN et al, 2017)
(Figura 1a). Uma escala de coloração com os valores de pH para o indicador
ácido-base PTK foi desenvolvida neste trabalho, corroborando os valores de pH
relatados no estudo eletroquímico de Wang et al (2013). Assim, o indicador
ácido-base PTK apresentou uma faixa de pH com as colorações incolor, vermelho e
verde-fluorescente (Figura 1b).
De acordo com os resultados obtidos com a aplicação do experimento em aula,
podemos inferir que a atividade experimental possibilitou maior compreensão de
conceitos de ácidos, bases e pH. Isso vai ao encontro dos resultados alcançados
por Oliveira e colaboradores (2021), os quais ratificam a contribuição do
experimento para a assimilação de conceitos por estudantes.
A partir do experimento, os discentes classificaram os produtos analisados em
ácidos ou bases por meio da adição da solução de PTK. As soluções aquosas de
NaOH, Mg(OH)2 e NaHCO3 apresentaram coloração verde fluorescente intensa,
evidenciando valores de pH > 6,0 em contato com o PTK. Enquanto, as soluções
aquosas de ácido muriático (HCl), suco de limão e vinagre (H3CCOOH) a coloração
vermelha. A solução de HCl, após alguns segundos, precipitou, resultando em
solução incolor, com pH inferior a 3,5.
O pH das amostras de água do bebedouro da escola e da casa de alguns estudantes
apresentaram coloração verde fluorescente, assim, os educandos concluíram que as
amostras possuíam pH > 6,0. Logo, os resultados apontam para a relevância do PTK
como indicador ácido-base para facilitar o ensino e aprendizagem de conceitos
relacionados a acidez e basicidade de substâncias químicas.
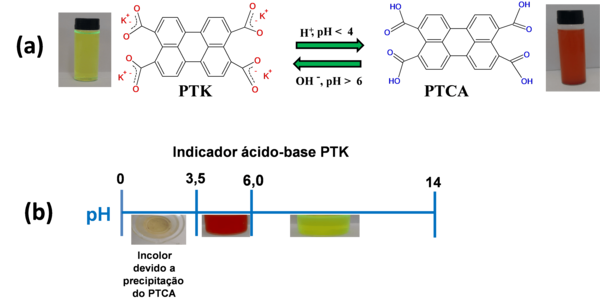
(a) Reação química mostrando a mudança de coloração \r\ndo PTK com alteração do pH (b) Escala de pH do \r\nindicador ácido-base PTK
Conclusões
O emprego do PTK como indicador ácido-base, despertou o interesse dos estudantes e facilitou a compreensão de conceitos de ácido, base e pH. A realização do experimento propiciou aos discentes a diferenciação de produtos ácidos e básicos, bem como, a avaliação qualitativa do pH da água. Além disso, é válido destacar que o experimento abre um leque de possibilidade para aplicação no ensino e aprendizagem de conceitos relacionados ao deslocamento de equilíbrio químico, sais de ácidos carboxílicos e para o estudo das técnicas espectroscópicas (ensino superior).
Agradecimentos
Referências
CRUZ, A. A. C.; et al.. A Ciência Forense no Ensino de Química por Meio da Experimentação Investigativa e Lúdica. Química Nova Escola, vol. 38, n. 2, p. 167-172, 2016.
HARIHARAN, P. S.; et al. A halochromic stimuli-responsive reversible fluorescence switching 3,4,9,10-perylene tetracarboxylic acid dye for fabricating rewritable platform. Optical Materials, vol. 64, p. 53-57, 2017.
LÔBO, S. F.; MORADILL, E. F. Epistemologia e a formação docente em química. Química Nova na Escola, n.17, p.39-41, 2003.
NAVEENRAJ, S.; RAJ, M. R.; ANANDAN, S. Binding interaction between serum albumins and perylene-3,4,9,10-tetracarboxylate - A spectroscopic investigation. Dyes and Pigments, vol. 94, p. 330-337, 2012.
OLIVEIRA, D. E. T. B. et al. Curcumina como indicador natural de pH: uma abordagem teórica-experimental para o ensino de química. Química Nova, vol. 44, n. 2, p. 217-223, 2021.
TERCI, D. B. L.; ROSSI, A. V. Indicadores naturais de pH: usar papel ou solução? Química Nova, vol. 25, n. 4, p. 684-688, 2002.
WANG, M.; et al. Electric field driven protonation/deprotonation of 3,4,9,10-perylenetetracarboxylic acid immobilized on graphene sheets via π–π stacking. Journal of Electroanalytical Chemistry, vol. 688, p. 304-30, 2013.

