Autores
Cabreira, M.N. (IFPR) ; Domingos, E. (IFPR)
Resumo
Esta obra estuda a eficiência de três eletrodos de trabalho com substratos metálicos diferentes: Aço inox AISI 310, alumínio e cobre. E a utilização de três proporções de peróxido de hidrogênio 30% v/v com solução de ácido sulfúrico em diferentes proporções (9:1; 8:2 e 7:3 H2SO4/H2O2), para recuperação de cobalto. Para a proporção 9:1 não foi possível determinar o potencial de redução, para 8:2 a eletrodeposição foi de cobalto metálico e para 7:3 foi óxido de cobalto. As reduções nos três eletrodos ocorreram em potenciais próximos a -1,25V o material depositado precisa ser caracterizado quimicamente. No teste de cronoamperometria o eletrodo de alumínio na proporção 7:3 apresentou a melhor eficiência no depósito de materiais por área.
Palavras chaves
Bateria de íons lítio; Eletrodeposição; Recuperação de cobalto
Introdução
O aumento de dispositivos eletrônicos como notebooks, celulares, tablets e outros, vem crescendo exponencialmente nos últimos anos, isso acarreta no crescimento constante na produção, uso e descarte de pilhas e baterias (ROCHA, OLIVEIRA e CRUZ, 2005, p.1). Os materiais presentes nas baterias podem agredir o meio ambiente com a contaminação do solo e de rios por metais pesados, e ainda o descarte incorreto de baterias de celulares provoca um desperdício de matéria-prima como Li, Co, Ni, Cu e Al. Por muitos motivos já estudados, a necessidade de um descarte correto para a reciclagem e recuperação destes materiais se torna fundamental e imprescindível, visando a diminuição do desperdício de recursos não renováveis e de matérias primas (ROCHA, 2009, p.12). Mesmo com implemento da resolução 401/2008 do CONAMA, limitando a quantidade máxima de metais em pilhas e baterias (BRASIL, 2008, p.1) , há ainda, carência de alternativas e barateamento do processo uma vez que o valor é exorbitante. A falta de informação da população também faz com que ainda ocorra esse descarte inapropriado de baterias (ROCHA, 2009, p.12). Um meio para a recuperação de metais é a dissociação eletroquímica, que por sua vez é realizada com a transferência de cargas elétricas, havendo portanto a oxidação e a redução (KLEIN; BRAIBANTE, 2017, p.35). O cobalto, muito utilizado na eletroquímica por ser encontrado em baterias de íons lítio, apresenta uma vasta gama de aplicações. (MEDEIROS, 2013, p. 22).
Material e métodos
Primeiramente foi realizado o desmantelamento das baterias, fazendo-se a separação de cátodo, ânodo, separadores e invólucro de aço. Foi utilizado somente o cátodo, e o resto da bateria foi guardada. Com o cátodo em mãos, foi pesado 30g (3 partes iguais de 10g) de catodo que foi colocado em estufa a 120 ºC por 24 horas. Após esse período, esses cátodos foram lavados em água destilada à 40 ºC, deixando-os de molho até não liberar resíduos amarelados na água. Após a lavagem os catodos foram secos em estufa por 24 horas a 60 ºC. Após este período, cada uma das três partes do cátodo foi posto em béqueres distintos, e por fim adicionados de H2SO4 0,5 M e H2O2 30% v/v com três proporções diferentes (9:1; 8:2 e 7:3). Após, esses três béqueres foram submetidos à uma temperatura de 80 ºC por duas horas para que o material do cátodo fosse desprendido do alumínio. Após as duas horas, a solução catódica foi filtrada. Após o preparo das soluções, foram realizados testes de voltametria cíclica em triplicata com cada um dos três eletrodos, utilizando as três soluções, totalizando em 27 análises potenciométricas. Os parâmetros utilizados foram: Potencial inicial: 0,8; Menor potencial: -1,6; Maior potencial: 0,8; Potencial de parada: 0,8; Taxa de varredura: 0,01 e 0,001 e Velocidade: 0,05 e 0,1. Com o equipamento Autolab PGSTAT101. Em seguida foi realizado a cronoamperometria, onde a massa eletrodepositada nos eletrodos foi pesada e foi realizado o cálculo de eficiência de carga de cada análise.
Resultado e discussão
Referente a proporção de 9:1, os voltamogramas apresentam baixa resolução e sem
o aparecimento dos potenciais de redução dos compostos de cobalto na
eletrodeposição nos três eletrodos. Portanto, não foi possível observar as
oxidações e nem as reduções de forma adequada neste eletrodo. Entretanto, para
os eletrodos de cobre e alumínio houve uma eletrodeposição de coloração escura,
característica da oxidação do cobalto metálico para óxido de cobalto. Os
voltamogramas da proporção 8:2 de H2SO4/H2O2 pôde ser observado os potenciais
de redução -1,35 V para o eletrodo de cobre, -1,25 V para o de aço inox e -1,37
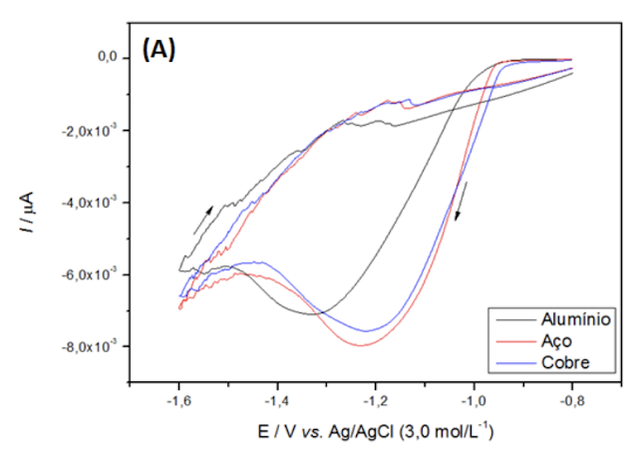
V para o de alumínio. Na figura 1(A), referente à proporção 7:3,, os potenciais
de redução foram -1,22 V para o eletrodo de cobre, -1,23 V para o de aço inox e
-1,35 V para o de alumínio. O material depositado em cada eletrodo será
posteriormente analisado, porém pelas características metálicas do depósito de
cobalto no eletrodo de alumínio, e as características de hidróxido ou óxido dos
outros eletrodos, é uma forte evidência da ocorrência de diferentes reações em
cada superfície. Com a cronoamperometria foi possível realizar o cálculo de
eficiência pelas cargas teórica e experimental, a dificuldade deste experimento
está na medida das massas que precisam ser realizadas com uma balança de alta
precisão, sendo assim em comparação das eficiências entre os eletrodos
trabalhados em diferentes proporções de H2SO4/H2O2, as maiores eficiências
foram obtidas na proporção de 7:3 em todos os eletrodos, e o eletrodo de
alumínio se destaca com a massa e eficiência apresentada.

Conclusões
Com a recuperação de cobalto por meio hidrometalúrgico em diferentes proporções de H2SO4/H2O2, seguida pela eletrodeposição em três diferentes eletrodos, foi possível verificar a eficiência de recuperação. No eletrodo de alumínio foram encontrados os melhores resultados em massa recuperada na proporção de 7:3 de H2SO4/H2O2, porém há a necessidade de mais estudos, principalmente na caracterização química dos depósitos.
Agradecimentos
Ao IFPR, CAPES e CNPQ.
Referências
ROCHA, Adriano Ferreira da. “Cádmio, Chumbo, Mercúrio – A problemática destes metais pesados na Saúde Pública?” 2009. Disponível em: https://repositorio-aberto.up.pt/bitstream/10216/54676/4/127311_0925TCD25.pdf Acesso em: 27 jun. 2019.
BRASIL. RESOLUÇÃO CONAMA n° 401, de 4 de novembro de 2008 Publicada no DOU nº 215, de 5 de novembro de 2008, Seção 1, página 108-109.
KLEIN, S.G.; BRAIBANTE, M.E.F. Reações de oxi-redução e suas diferentes abordagens. Quím. nova esc. – São Paulo-SP, BR. Vol. 39, N° 1, p. 35-45, FEVEREIRO 2017. Disponível em: http://qnesc.sbq.org.br/online/qnesc39_1/07-CCD-112-15.pdf Acesso em: 27 jun. 2019.
MEDEIROS, Miguel de Araújo. QUÍMICA NOVA NA ESCOLA Cobalto 221 Vol. 35, N° 3, p. 220-221, AGOSTO 2013. Disponível em: http://qnesc.sbq.org.br/online/qnesc35_3/11-EQ-100-10.pdf Acesso em: 27 jun. 2019.
ROCHA, R. R. O. OLIVEIRA, R. M. CRUZ, T. G. S. O descarte de pilhas e baterias no brasil e o seu impacto no meio ambiente. In: XIII CONGRESSO INTERNO DE INICIAÇÃO CIENTÍFICA DA UNICAMP, 28 e 29 setembro. 2005. Centro Superior de Educação Tecnológica - CESET. São Paulo: UNICAMP, 2005. Disponível em: https://www.prp.unicamp.br/pibic/congressos/xiiicongresso/cdrom/pdfN/549.pdf. Acesso em: 27 de jun. 2019.

