Autores
Silveira, M.M.S. (UNIVERSIDADE FEDERAL DO TRIÂNGULO MINEIRO) ; Silva, P.F. (UNIVERSIDADE FEDERAL DO TRIÂNGULO MINEIRO) ; Silva, L.A. (UNIVERSIDADE FEDERAL DO TRIÂNGULO MINEIRO) ; Alves, V.A. (UNIVERSIDADE FEDERAL DO TRIÂNGULO MINEIRO)
Resumo
Utilizou-se uma célula eletrolítica confeccionada com materiais de fácil acesso e baixo custo, visando-se determinar as massas de produtos formados no cátodo e no ânodo, a partir da quantidade de eletricidade que circulou na célula, bem como determinar a constante de Avogadro. A reação redox envolveu a oxidação do iodeto a iodo, e a redução da água, gerando gás hidrogênio e íons hidróxido. O potencial da célula foi mantido constante em 3,0 V, e registrou-se a corrente durante 20 min. A partir dos dados coletados, foi possível determinar os parâmetros citados. Essa célula foi utilizada por dois professores da rede básica de ensino, no laboratório da UFTM, os quais avaliaram a atividade realizada. Os valores experimentais obtidos foram concordantes com os do referencial utilizado.
Palavras chaves
Eletroquímica; Eletrólise; Formação continuada
Introdução
No artigo publicado na revista Química Nova na Escola (SARTORI et al, p. 107, 2013) “é descrita a construção de uma célula eletrolítica a partir de materiais de baixo custo para um experimento de eletrólise com uma solução de KI 0,1 mol L-1. Íons iodeto foram oxidados a iodo no ânodo, visualizado pela cor castanho-amarelada formada, e a água foi reduzida no cátodo, produzindo íons hidroxilas que causaram a mudança de cor de uma solução de extrato de repolho roxo. Ademais, determinou-se o valor da constante de Avogadro a partir da carga envolvida na eletrólise”. Considerou-se relevante reproduzir a célula proposta pelos autores, com algumas adaptações nossas, para utilização por professores da educação básica, cursistas de um programa de mestrado profissional em química, por ocasião de uma disciplina que inclui o tema eletroquímica. É importante que esses professores sintam-se motivados e preparados para inovar nas suas aulas de química, e a experimentação pode se constituir numa poderosa ferramenta (SARTORI et al, p. 108, 2013). O processo de ensino-aprendizagem do tema eletroquímica apresenta alguns desafios, pois é considerado difícil, não somente pelos alunos, mas também pelos professores. O ensino desse tema de forma puramente teórica pode dificultar a aprendizagem do aluno, criando um obstáculo que pode distanciar o aluno da química, caso ele não compreenda o assunto, tampouco perceba como a eletroquímica está presente no seu cotidiano, e a sua importância (SANTOS et al, p. 258, 2018). A partir das células eletrolíticas produzidas e utilizadas, determinou-se a quantidade de eletricidade que circulou na célula, as massas de produtos formados no cátodo e no ânodo, bem como a constante de Avogadro. Os professores avaliaram a atividade.
Material e métodos
Montou-se o circuito divisor de potencial da seguinte maneira (SARTORI et al, p. 108, 2013): conectou-se uma das extremidades de um potenciômetro ao pólo (+) de uma bateria de 9 V e a outra, ao pólo (-). O terminal central do potenciômetro foi conectado ao pólo (+) do multímetro (cabo vermelho). O terminal (-) do potenciômetro foi conectado ao pólo (-) do multímetro (cabo preto). O potenciômetro atua dividindo o potencial fornecido pela bateria, o qual foi ajustado para 3 V, utilizando-se um multímetro com escala em leitura de potencial. Em seguida, montou-se a célula eletrolítica: mediu-se 15 mL de solução de KI 1,0 mol L-1, transferiu-se para um tubo de vidro em forma de U, fixado num suporte universal. Encaixou-se os eletrodos de grafite em cada lado do tubo. Conectou-se o terminal central do potenciômetro ao eletrodo que funcionou como ânodo. Conectou-se o outro eletrodo (cátodo) ao terminal (+) do multímetro, com este configurado para leitura de corrente contínua. Conectou-se o terminal (+) do potenciômetro ao pólo (+) da bateria. O terminal (-) do multímetro foi conectado ao pólo (-) da bateria, o qual também foi conectado a uma das extremidades do potenciômetro (terminal (-)), fechando assim o circuito elétrico. O multímetro encontra-se em configuração em série para a leitura de corrente que flui pela célula eletrolítica. Adicionou-se 2 gotas de fenolftaleína no cátodo. Após tudo pronto conectou-se o terminal (+) do multímetro ao cátodo, aplicando-se 3 V. Simultaneamente, disparou-se o cronômetro. Anotou-se a corrente indicada no multímetro em t = 0 e a cada 1 min, até completar 20 min de eletrólise. Os professores trataram os dados obtidos e, no final, responderam um questionário com oito afirmativas, na escala Likert de 5 pontos.
Resultado e discussão
Construiu-se uma curva de I (A) em função do t (s) e obteve-se a integral
(área sob a curva), correspondente à quantidade de eletricidade que circulou
pela célula eletrolítica, Q (C), Figuras 1 e 2. Calculou-se a quantidade de
mol de elétrons requerida por essa carga, ne-=Q/F (1,08 C/96485 C (mol e-) =
1,12x10-5 mol e-). A partir das semi-reações (Figura 3) e das razões molares
(2 mol e-≅1 mol I2 e 2 mol e-≅2 mol OH-), as massas de I2 e de OH-
produzidos foram de 1,42 mg e 0,190 mg. Determinou-se o valor da constante
de Avogadro (Na) assim: obteve-se a quantidade de elétrons (Ne) pela razão
entre Q e a carga do elétron (1,08 C/1,60x10-19 C = 6,75x1018 e-); Na =
Ne/ne- (6,75x1018 e-/1,12x10-5 mol e-), onde Na = 6,027x1023 mol-1, coerente
com o esperado (6,022x1023 mol-1). Os resultados foram concordantes com os
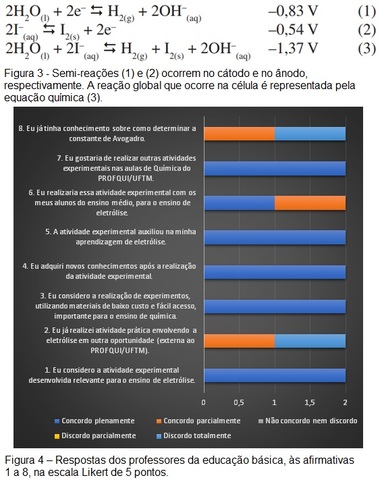
da literatura (SARTORI et al, p. 110, 2013). A Figura 4 apresenta os
resultados da avaliação. Os professores concordaram plenamente com as
afirmativas 1, 3, 4, 5 e 7, indicando que a atividade experimental
desenvolvida é relevante para o ensino de eletrólise, que eles adquiriram
novos conhecimentos por meio da sua realização, e que a mesma também
auxiliou na sua aprendizagem sobre eletrólise. Também consideram importante
a realização de experimentos alternativos, para o ensino de química, e
gostariam de realizar mais atividades experimentais no curso. Quanto à
afirmativa 2, pôde-se constatar que os professores não tinham tido acesso a
experimentos como esse, em outra instituição. Com relação à afirmativa 6, é
muito provável que eles realizariam essa atividade com seus alunos do ensino
médio. As respostas à afirmativa 8 corroboram a da afirmativa 4, onde eles
declararam que adquiriram novos conhecimentos, no tocante à determinação da
Na.

Conclusões
A célula eletrolítica, montada a partir de materiais de fácil acesso e baixo custo, permitiu explorar os aspectos quantitativos da eletrólise do iodeto. As massas de produtos gerados no cátodo e no ânodo foram obtidas, bem como a constante de Avogadro. O valor obtido mostrou-se concordante com o esperado. A atividade experimental foi bem avaliada pelos professores da educação básica, que a consideraram relevante para o ensino de eletrólise e, possivelmente, a utilizariam com seus alunos do ensino médio. Eles adquiriram novos conhecimentos, sobre como determinar essa constante.
Agradecimentos
O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - Código de Financiamento 001.
Referências
SANTOS, T. N. P.; BATISTA, C. H.; OLIVEIRA, A. P. C.; CRUZ, M. C. P. Aprendizagem ativo-colaborativo-interativa: inter-relações e experimentação investigativa no ensino de eletroquímica. Química Nova na Escola. v. 40, n. 4, 258-266, 2018.
SARTORI, E. R.; SANTOS, V. B.; TRENCH, A. B.; FATIBELLO-FILHO, O. Construção de Uma Célula Eletrolítica para o Ensino de Eletrólise a Partir de Materiais de Baixo Custo. Química Nova na Escola, v. 35, n. 2, 107-111, 2013.

