Autores
Banzatto, J. (IFPR) ; Bolzan, J.A. (IFPR) ; Gomes, S.I.A.A. (IFPR) ; Sandri, M.C.M. (IFPR)
Resumo
Muitas atividades experimentais realizadas em cursos superiores de Química e Farmácia, especialmente em disciplinas de química orgânica, tem trazido grandes preocupações devido ao uso de diversos solventes orgânicos de alta toxicidade, catalisadores, geração de subprodutos e resíduos com elevados riscos a saúde humana e ao meio ambiente. Uma alternativa viável para redução destes riscos é a introdução da Química Verde no desenvolvimento de práticas experimentais que busquem tecnologias e materiais com menores riscos. Neste cenário, o presente artigo traz uma proposta para otimização da síntese e purificação do salicilato de metila por meio da Estrela Verde (EV), tornando a prática experimental mais verde e viável de ser realizada em uma aula de 50 minutos.
Palavras chaves
Química Verde; Salicilato de metila; Ensino de Química
Introdução
A Química sempre cumpriu um importante papel com a introdução de inúmeros produtos essenciais à humanidade. Entretanto, a produção química também tem gerado muitos problemas, como a formação de produtos e subprodutos tóxicos que levam a contaminação do ambiente, incluindo os seres humanos (PRADO, 2003). Neste sentido, faz-se necessário, um novo comportamento químico, em que não se restringe apenas à adoção de práticas que visem à minimização, ou então o tratamento dos resíduos. Mas a conscientização humana, compromisso ativo com a gestão dos resíduos químicos (MARINHO, BOZELLI & ESTEVES, 2011; MOREIRA, 2017). A Química Sustentável ou Química Verde pode ser definida como “a criação, o desenvolvimento e à aplicação de produtos e processos químicos para reduzir ou eliminar o uso e a geração de substâncias nocivas à saúde humana e ao ambiente” (CORRÊA et al, 2016). A origem da Química Verde, conforme explicam Lenardão et al., (2003), se deu em 1991, quando a agência ambiental norte-americana EPA (Environmental Protection Agency) lançou um programa para custeios financeiros de projetos de pesquisa que incluíssem a prevenção de poluição em suas rotas sintéticas, denominado “Rotas Sintéticas Alternativas para Prevenção de Poluição”. Dois anos mais tarde, o programa foi expandido ganhando a denominação Química Verde (ANASTAS e KIRCHHOFF, 2002). Com o passar dos anos, surgiram outros programas e entidades incentivadoras de práticas verdes, destaca-se a área de síntese, catálise e processos mais seguros. Entre elas, o “Green Chemistry Institute” (GCI) em 2001, que atua em parceria com a Sociedade Americana de Química (American Chemical Society, ACS) (LENARDÃO et al., 2003). Para Prado (2003), as iniciativas da Química Verde procuram englobar todas as áreas da ciência, visando os princípios da sustentabilidade. O seu desenvolvimento implica no: a) uso de reagentes alternativos e renováveis, com o objetivo de diminuir os reagentes tóxicos e não biodegradáveis no ambiente; b) uso de reagentes inócuos nos processos sintéticos, evitando perdas indesejáveis e aumentando o rendimento final da produção; c) na substituição de solventes tóxicos por solventes alternativos; d) aprimoramento de processos naturais, tais como biossíntese e biocatálise; e) desenvolvimento de compostos seguros, ou seja, com baixa toxicidade; f) desenvolvimento de melhores condições reacionais, na tentativa de se obter maior rendimento e menor geração de subprodutos e, finalmente, g) na minimização do consumo de energia. Estas iniciativas estão de acordo com Machado (2014) que atualmente defende doze princípios que norteiam a Química Verde e que devem ser seguidos ao implantar esta filosofia na indústria ou na universidade. Nesse sentido, considera-se importante a inserção dos princípios da Química Verde no ensino de Química, para o desenvolvimento de atividades experimentais desde as mais simples até as mais complexas que envolvem reações de síntese com o uso de reagentes com elevados riscos e formação de resíduos, que na maioria das vezes não são coletados ou tratados adequadamente para seu destino final. Acredita-se que a efetivação de práticas de ensino mais sustentáveis e com menores riscos físicos, a saúde e ao ambiente, venha a promover reflexões sobre a Química Verde e suas aplicações, contribuindo com uma formação baseada na ética e na responsabilidade socioambiental. De acordo com Pinto (2004), as sínteses laboratoriais envolvem a formação de produtos e subprodutos tóxicos que levam a contaminação do ambiente, incluindo os seres humanos. Neste artigo apresentamos como exemplo, um estudo da Verdura Química da obtenção do salicilato de metila, que é realizada a partir da esterificação entre o ácido salicílico e o metanol na presença de ácido sulfúrico concentrado, usado para catalisar a reação (PAIVA, 2009). Esta síntese é comumente empregada em aulas experimentais de Química no Ensino superior, pelo fato de possibilitar a abordagem de diversos conteúdos da Química Orgânica, tais como reações de substituição nucleofílica acílica, reações de hidrólise e técnicas laboratoriais utilizadas no processo de síntese e purificação. Contudo, este tipo de reação geralmente necessita de reagentes em excesso e elevado tempo de aquecimento – Paiva (2009); Vogel (1971) e Gonçalves (1988) indicam 1h, 5h, 48 hs de aquecimento respectivamente – aspectos que tornam a síntese marrom. Além disso, normalmente o número de horas-aula das disciplinas experimentais, variam entre 2 a 4 horas/aula semanais, não sendo possível sintetizar, purificar e caracterizar o salicilato de metila no horário de aula. Neste contexto, este artigo apresenta a avaliação da verdura química, a partir da Estrela Verde (EV) da técnica de obtenção do salicilato de metila proposta por Paiva, 2009, com vistas a apresentar alternativas para uma reação mais verde e aplicável no ensino de Química.
Material e métodos
Protocolo Experimental para a Síntese do Salicilato de Metila Avaliou-se o método da síntese do salicilato de metila proposto por Pavia (2009), que indica o uso de 9,7 g de ácido salicílico, 25 mL de metanol e 10 mL de ácido sulfúrico concentrado e aquecimento leve sob refluxo por 1 hora. Purificação: transferir a mistura da reação para um funil de separação, lavar com 25 mL de diclorometano (DCM) e deixar em repouso para separação das fases. A seguir, extrair o produto bruto com 25 mL de DCM e 25 mL de água. A camada orgânica deve ser extraída com 25 mL de solução de bicarbonato de sódio 5%. Repetir a operação. Para secagem, adicionar cerca de 2,0 g de sulfato de sódio anidro em grãos, tampar a mistura, agitar e deixar em repouso por 10 à 15 minutos. Para a destilação, usar uma manta de aquecimento, sob pressão reduzida em temperaturas iguais ou superiores a 100 °C (PAVIA, 2009). Avaliação da Verdura Química da Síntese do Salicilato de Metila Para proceder a avaliação da verdura da síntese do salicilato de metila foi necessário analisar previamente o protocolo experimental, proposto por Pavia (2009), relativamente às condições de pressão e temperatura, uso dos reagentes estequiométricos e o excesso de reagentes, identificar as informações de todas as substâncias envolvidas, riscos para a saúde e o ambiente, inflamabilidade e reatividade e, ainda se constituiam ou se são obtidas de matérias-primas, renováveis, e se são degradáveis a produtos de degradação inócuos, através da pesquisa das Fichas de Informações de Segurança de Produto Químico (FISPQ), (MACHADO, 2014). Estrela Verde (EV) e Cálculos de massa Conforme Ribeiro, Costa e Machado (2010, p. 759), “a métrica EV é constituída de tantas pontas quantos os Princípios da QV, e em que o comprimento de cada ponta é tanto maior quanto melhor for o cumprimento do respectivo princípio”. É empregada quando se quer uma visão semi-quantitativa da verdura química a ser obtida, esta métrica baseia-se na apreciação visual, simples e imediata através da area da estrela (DOMINIQUE, RIBEIRO & MACHADO, 2009). A Eficiência Atômica (EA) e o fator E são métricas de massa que consideram a quantidade de resíduos gerados para cada kilograma de produto obtido ao final de cada reação. Considera-se resíduos tudo o que é produzido além do desejável, como nos explica Lenardão (2003). A EA indica o percentual de rendimento atômico, calculada a priori considerando situações ideais de rendimento (100%), com base na estequiometria da reação (EA = massa dos produtos/massa total dos reagentes). O fator E, indica o número de resíduos gerados pela estequiometria da reação (Fe = massa total dos reagentes – massa do produto). Para a construção da EV e cálculos da EA e do Fator E, utilizou-se a plataforma disponível em www.educa.fc.up.pt, que permite uma análise automática, a partir do preenchimento das informações acerca do experimento (MACHADO, 2014).
Resultado e discussão
Avaliação da EV da síntese do salicilato de metila
As informações levantadas no inventário sobre as condições experimentais da
síntese do salicilato de metila, os riscos dos reagentes, produtos e resíduos,
foram utilizadas para construção da EV visando uma proposta experimental mais
sustentável e viável de ser desenvolvida no ensino de química.
O Índice de Preenchimento da Estrela (IPE) mostra o cumprimento de apenas 25%
da área da estrela (Figura 1).
Nota-se que o princípio P8, relacionado a não formação de derivados é
totalmente atendido pelo experimento. São parcialmente atendidos, o princípio
P2, que trata da economia atômica relacionado a reação com excesso de reagente
> 10% e a não formação de coprodutos; o P6, que trata da eficiência energética
e o P7 uso de substâncias renováveis, devido ao cumprimento de parte dos
princípios (economia atômica elevada, 89,413%, utilização de ao menos uma
substância renovável (Metanol), não considerando a água, no entanto, o
experimento emprega aquecimento prolongado sob refluxo por 1 hora, implicando
em gasto energético, mesmo que a temperatura do aquecimento se mantém entre 0°
à 100°C , que implica arrefecimento e aquecimento e; e os P1, P3, P5, P9 e
P12, que tratam respectivamente da prevenção (emprego de resíduos que envolvem
riscos elevados para a saúde ou ao ambiente); síntese de produtos menos
perigosos (a síntese apresenta um perigo elevado à saúde e ao ambiente); uso
de solventes e outras substâncias auxiliares (usos de solventes ou auxiliares
que envolvem perigo elevado à saúde e ao ambiente); catálise (catalisadores
que envolvem riscos à saúde e ao ambiente); e Química intrinsecamente segura
(as substâncias apresentam perigo elevado de acidente químico), todos não
pontuaram na EV. Ou seja, faz-se uso de metanol, com riscos H225 (inflamável),
H301 (toxicidade aguda oral), H331 (inalação), H311(dérmica) e H370 (sistêmica
ocular) e de ácido sulfúrico concentrado H290 (corrosivo para os metais), H314
(corrosivo para a pele) e ácido salicílico H318 (lesões oculares graves), H302
(toxicidade aguda), riscos descritos na FISPQ (Ficha de Informações de
Segurança de Produtos Químicos). Além disso, emprega 88,73 % de excesso de
metanol e gasto elevado de água no processo de refluxo, condições que não são
ideais para práticas de ensino economicamente viáveis e sustentáveis.
Quanto aos cálculos de massa, altos índices de Eficiência Atômica (Ea) são
visados pelo princípio P2 da Química Verde que trata de economia de átomos,
este princípio baseia-se em uma reação química ideal, na qual toda a massa dos
reagentes é convertida nos produtos, diminuindo proporcionalmente, a geração
de resíduos (SILVA 2005). A Ea estequiométrica da síntese do salicilato de
metila proposta por Paiva (2009), de 89,413% é considerado um valor
significativo, por tratar de uma reação de substituição nucleofílica, reações
que normalmente possuem baixo índice de verdura (MACHADO, 2014). De acordo com
Lenardão (2003), sínteses com boa Ea, como as reações de adição, de rearranjos
ou que envolvam catálise e biocatálise, são denominadas de Sínteses Verdes e
uma reação com baixa Ea, como as reações de substituição e eliminação, são
denominados Sínteses Marrons. O valor do fator E de uma síntese considerada
verde deve ser o menor possível, pois é uma métrica inversa a Eficiência
Atômica, e indica a produção de resíduos (MACHADO, 2014). O fator E da síntese
do salicilato de metila 0,124, indica que para cada 1kg de salicilato de
metila são produzidos 0,124 kg de resíduos.
Como a obtenção do salicilato de metila proposta neste trabalho, trata de um
experimento exclusivamente para fins didáticos no Ensino de Química,
apresenta-se as duas possibilidades de melhorias: 1) Síntese em microescala
sem redução de excesso de metanol – redução dos reagentes para 0,4635g de
ácido salicílico, 1,25 mL metanol e 0,5 mL H2SO4 e redução do aquecimento
de 1 hora sob refluxo para 15 minutos em banho-Maria, melhorando o princípio
P5 (não haverá consumo de água com facilidade) e o princípio P6 (melhorias na
eficiência energética). O produto final desta síntese se apresenta como um
líquido viscoso (oleoso) e translúcido com odor característico de salicilato
de metila; 2) Adaptação do método de Paiva (2009), pela utilização de
reagentes em proporções estequiométricas com pesquisas voltadas para a redução
do excesso de metanol e do catalisador e reutilização da água do refluxo.
Também se sugere como alternativa, utilizar aquecimento por micro-ondas
(ZAMBONAI, 2013) visando o P6 da Química Verde.
Com o objetivo de propor melhorias para o método de purificação do salicilato
de metila, procedeu-se com a avaliação da verdura química separadamente da
síntese, para a qual se avaliou-se apenas os princípios P1, P5, P6, P7, P10 e
P12 recomendados por Machado (2014). A Figura 2 mostra a EV da purificação do
salicilato de metila.
A EV com índice de preenchimento de apenas 25% , mostra que a purificação do
salicilato de metila atende integralmente o princípio P5, pela ausência de
água no processo de purificação; parcialmente o princípio 6, pela realização
em temperatura e pressão diferentes do ambiente (entre 0° e 100°C); e não
atende os princípios P1, P7, P10 e P12, pois o experimento faz uso de cloreto
de metileno que apresenta riscos à saúde a ao ambiente, H314 (queimaduras na
pele e lesões oculares graves), H351 (suspeito de provocar cancro) e H411
(tóxico para os organismos aquáticos com efeitos duradouros), gera resíduos
nocivos, os reagentes utilizados não são renováveis, nem degradáveis a
produtos inócuos, o experimento envolve riscos de acidente devido a toxicidade
do cloreto de metileno.
A análise prévia da EV trás como possibilidades de melhorias para a
purificação do salicilato de metila: a) a reutilização do cloreto de metileno
em outros experimentos ou a redução do seu volume no processo de purificação;
b) a substituição do cloreto de metileno por solvente não organoclorado, por
exemplo o hexano; c) destilação do produto final (mistura de salicilato de
metila, etanol em excesso, água formado como coprodutos da reação e ácido
sulfúrico) para eliminar o excesso de metanol e a reutilização deste em outras
atividades experimentais; d) na sequência, para remover traços de metanol e
ácido sulfúrico lavar o produto (salicilato de metila) com 120 de água (3
lavagens de 60 mL), e separar a fase oleosa (salicilato de metila), com
auxilio de um funil de decantação. Caso não ocorra a separação de fases,
devido à pequena diferença de densidade entre o éster e a água, Vogel (1989),
recomenda adicionar 5-10 mL de clorofórmio (volumes pequenos) e agitar
vigorosamente a mistura. Após a separação das fases, recolher a camada
inferior contento o éster (e eventualmente o clorofórmio), armazenar a camada
superior em um recipiente apropriado de resíduos. Retorne a mistura do éster e
o solvente orgânico para o funil de separação; e) em seguida proceder com
lavagens utilizando solução saturada de bicarbonato de sódio até que a reação
se torne alcalina, lavar novamente com água e secar com sulfato de magnésio e
filtrar, f) Destile sob pressão reduzida (p.f. 115oC/20 mmHg) coletando uma
fração com uma variação de 2oC. para posterior determinação de rendimento e
cálculos de experimentais para a eficiência atômica e fator E.
Este trabalho mostrou que é possível tornar a Química mais verde e sustentável
ao se adotar uma prática de avaliação dos experimentos antes de realiza-los,
com objetivo de redução, prevenção, reutilização ou eliminação dos resíduos de
processo. Ou seja, uma síntese orgânica ideal não deve apenas possuir um bom
rendimento e pureza do produto, sendo necessário levar em conta outros
fatores, sendo que modernamente a questão ambiental e de reaproveitamento de
rejeitos influencia tremendamente na eficiência do processo (SANSEVERINO,
1999).
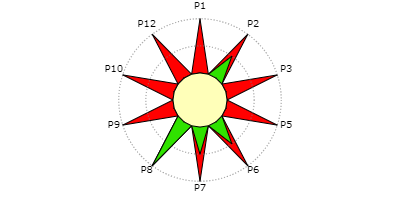
A figura 1 mostra a Estrela Verde do protocolo de síntese do salicilato de Metila.

A figura 2 mostra a Estrela Verde do protocolo de purificação do salicilato de Metila.
Conclusões
Apesar das iniciativas da Química Verde procurarem englobar todas as áreas da ciência, visando os princípios da sustentabilidade, as métricas verdes se mostram como uma importante ferramenta para o professor inserir a QV em suas aulas, esse método garante que os alunos compreendam a problemática de atividades experimentais antes mesmo de realiza-las e reflitam sobre meios de diminuir os impactos que podem ser causados. Vale ressaltar que a Química Verde traz como um de seus principais objetivos, obter uma síntese orgânica considerada de menor toxicidade, com menor tempo de reação, sem uso de solventes auxiliares e que seja desenvolvida no menor número de etapas possíveis. Neste sentido, a proposta realizada neste estudo reforça a realização de práticas mais sustentáveis e com menores riscos físicos e a saúde que venha a promover reflexões sobre os princípios da Química Verde e suas aplicações, mais especificamente em aulas experimentais, contribuindo com uma formação baseada na ética e na responsabilidade socioambiental. A avaliação da EV e das métricas de massa do método de obtenção e purificação do salicilato de metila proposto por Paiva, 2009, trouxe uma série de possibilidades para melhorar a verdura experimental e que podem ser aplicáveis em aulas de Química Orgânica em um processo investigativo, estimulando o estudante a participar ativamente das aulas trazendo uma formação mais consciente e sustentável. Além disso, foi possível apresentar uma alternativa de reação de obtenção do salicilato de metila em microescala, rápida de ser realizada, possibilitando o estudo deste tipo de reação, utilizando quantidades pequenas de reagentes e certamente com um gasto reduzido de energia.
Agradecimentos
Instituto Federal do Paraná, Campus Palmas Assistência Estudantil do IFPR PBIS/FA (Programa de Bolsa de inclusão Social/Fundação Araucária)
Referências
ANASTAS, P. T.; KIRCHHOFF, M. M. Origins, current status, and future challenges of green chemistry, 2002.
AZAMBUJA, M. R. A criança, o adolescente: aspectos históricos. Diponivel em https://www.passeidireto.com/arquivo/35858433/relatorio-sintese-do-salicilato-demetila acessado 08 de Dezembro de 2017.
CORRÊA, A.G. Química Verde: Fundamentos e Aplicações. Ed. Edufscar. 2012.
Holística da Verdura de Reações Laboratoriais – “Estrela Verde”. Química Nova, v. 33, p. 759-764, 2010.
DOMINIQUE A. C, RIBEIRO, M.G.T. C & MACHADO, A. A. S. C. Análise da Verdura das atividades laboratoriais do 10º ano do ensino secundário. QUÍMICA, v.115, out/dez, 2009. Disponível em: http://educa.fc.up.pt/ARTIGOS/BSPQ_115_041_09.pdf . Acesso em 09 mar. 2018.
LENARDÃO, E. J.; et al. “GREEN CHEMISTRY” – Os 12 Princípios da Química Verde e sua Inserção nas Atividades de Ensino e pesquisa. Química Nova, v.26, n.1, p123 -129, 2003.
MACHADO, A. A. S. C. A Complexidade da Segurança no Laboratório Químico. Química Nova, v. 11, 2006. ?????
MACHADO, A. A. S. C.; Introdução às Métricas da Química Verde: uma visão sistêmica, Ed. UFSC: Florianópolis, 2014.
MACHADO, A.A.S.C. Introdução às Métricas da Química Verde: uma visão Sistêmica. 1 ed. Florianópolis: UFSC, 2014.
MOREIRA, A. M.; AIRES, J. A.; LORENZETTI, L. Abordagem CTS e o conceito química verde: possíveis contribuições para o ensino de química. Actio. v.2, n,2, 2017. Disponível em https://periodicos.utfpr.edu.br/actio/article/view/6825. Acesso em 09 jan. 2018.
PAVIA, D. L.; et al. Química Orgânica Experimental, Porto Alegre. Brookmam. 2ºed., 2009.
PINTO, P. Síntese do Ácido Acetilsalicílico. Escola Secundária do Padre António Martins Oliveira de Lagoa/Técnicas Laboratoriais de Química. 2004. Disponível em:<http://pedropinto.com/files/secondary/tlq/tlqII_relatorio5.pdf>.Acesso 08 de Dezembro de 2017.
PRADO, A. G. S. Química Verde, os desafios da Química no novo milênio; Química Nova, v.26, n.5, p. 738-144, 2003.
RIBEIRO, G. T. C.; MACHADO, A. A. S. C. Uma Métrica Gráfica para Avaliação Holística de Verduura de Reações Laboratoriais – Estrela Verde. Quimica Nova, V. 33, N. 3, p. 759-764, 2010. Disponivel em: http://www.scielo.br/pdf/qn/v33n3/50.pdf. Acesso em 10 jan. 2018.
SANDRI, M. C. M; SANTIN FILHO. Análise da Verdura Química de Experimentos Propostos para o Ensino Médio. Actio: Docência em Ciências. V. 2, n. 2, p. 97-118, Curitiba – Jul/Set. 2017.
SANSEVERINO, A. M. Síntese Orgânica. Química Nova na Escola. Rio de Janeiro, 1999.
SILVA, F.M.; LACERDA, P. S. B.; JUNIOR, J. J. Desenvolvimento Sustentável e Química Verde. Química Nova, v.28, n.1. São Paulo Jan./Fev. 2005.
VOGUEL, A. I. Practical Organic Chemistry, 5a. ed. Longman, 1989.
ZAMBONAI, D. P. A inserção da Química Verde no curso de Licenciatura de Química do ED-UFSCAR um estudo de caso. Universidade Federal São Carlos. São Carlos. São Paulo, 2013. Disponível em file:///C:/Users/julia/Desktop/ARTIGO%20SALICILATO%20DE%20METILA/salicilato%20de%20metila.pdf. Acesso em 03 mar. 2018.
_______________Química Verde: possíveis contribuições para o ensino de Química. V. 2, n. 2, p. 193210, Curitiba – Jul/Set. 2017.
_______________[http://educa.fc.up.pt/pedagogiadaquimicaverde/]

