Autores
Alves, K.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Pinheiro, S.O. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Paz, I.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Pontes, A.H.B. (UNIVERSIDADE ESTADUAL DO CEARÁ)
Resumo
Visando um melhor aprendizado para alunos da disciplina de Química Inorgânica III da Universidade Estadual do Ceará (UECE), propôs-se um experimento de complexação do íon Niquel II e análise das soluções por espectroscopia eletrônica na região do ultravioleta e visível (UV-Vis). Os complexos foram formados por reações de substituição das moléculas de água por etilenodiamina como ligante. Foram obtidas as soluções hexaaquoniquel(II), tetra-aquoetilenodiaminoniquel(II), diaquobis(etilenodiamino)níquel(II) e tris(etilenodiamino)níquel(II). O experimento tem como objetivos expandir a abordagem tradicional da análise de parâmetros do campo cristalino e oferecer oportunidade de aprofundar conhecimentos em Química Inorgânica, observando na prática o significado de termos teóricos vistos em sala.
Palavras chaves
complexos inorgânicos; níquel; educação
Introdução
Na disciplina de Química Inorgânica III os alunos recebem aulas teóricas sobre diversas técnicas de caracterização presentes na estrutura da disciplina, como espectroscopia eletrônica na região do UV-Vis, espectroscopia na região do infravermelho, etc., direcionados a compostos inorgânicos. Porém, para um melhor aprendizado, é importante relacionar a teoria com a prática. Assim, as sínteses de uma série de complexos de níquel(II) octaédricos foram propostas aos estudantes. O íon Ni(II) em solução aquosa encontra-se coordenado a moléculas de água em uma geometria octaédrica, formando o íon complexo [Ni(H2O)6]2+, solução verde. Em muitos casos, a formação de outros complexos ocorre através de reações de substituição das moléculas de água por outros ligantes (AYALA; BELLIS, 2003). O estudo dos complexos [Ni(H2O)6]2+ (hexaaquoniquel (II)), [Ni(en)(H2O)4]2+ (tetra-aquoetilenodiaminoniquel (II)), [Ni(en)2(H2O)2]2+ (diaquobis(etilenodiamino)níquel (II)) e [Ni(en)3]2+ (tris(etilenodiamino)níquel (II)), a partir da reação da molécula de etilenodiamina (H2NCH2CH2NH2) com cloreto de níquel hexahidratado (NiCl2.6H2O) em água mostra-se bastante interessante, uma vez que, estes complexos apresentam bandas características de cada composto, podendo portanto explorar alguns assuntos teóricos como por exemplo, estudo de energias e transições eletrônicas. Essa abordagem favorece aos alunos da disciplina uma melhor visualização da parte teórica, podendo então relacionar com a técnica em estudo, analisando todas as correlações que as reações de substituição fornecem. Este trabalho tem como objetivo fundamentalmente expandir a abordagem tradicional da análise de parâmetros do campo cristalino e a utilização de técnicas como a espectroscopia na região do UV-Vis em solução.
Material e métodos
A metodologia utilizada é simples e direta, permitindo que os alunos avaliem seus conhecimentos no decorrer do experimento e tirem conclusões em cada passo. Solução de etilenodiamina, cloreto de níquel sólido e água foram utilizados neste experimento. Em um béquer de 50mL preparou-se a solução de [Ni(H2O)6]2+ (hexaaquoniquel (II)) por dissolução de 3,591g de NiCl2.6H2O (cloreto de níquel hexahidratado) em 50mL de água. Em seguida, em um balão volumétrico de 50mL, foi diluído 1mL de etilenodiamina em 50mL de água. A quatro béqueres de 50 mL foram adicionados 25, 20, 15 e 10mL de água e, em seguida, esses béqueres foram rotulados com os números 1, 2, 3 e 4, respectivamente. A cada um dos quatro béqueres rotulados foi adicionado 5mL de [Ni(H2O)6]2+. Posteriormente, nos béqueres 2, 3 e 4 foram adicionados 5, 10 e 15 mL da solução de etilenodiamina, respectivamente e obtidos os espectros eletrônicos na região do UV-Vis das soluções de 1 a 4. Os espectros eletrônicos em solução (água) foram medidos com o equipamento Shimadzu, UV 1800. O experimento escolhido permite que os licenciados tenham contato com o laboratório, lhes dá maior segurança ao repassar o conhecimento obtido e, além disso, consente aos licenciados repassar o experimento, já que é simples, direto e não requer muito tempo.
Resultado e discussão
Baseado em Oliveira et al (2010), os complexos com Ni2+ podem ser obtidos
pela substituição das moléculas de água pelas moléculas de etilenodiamina.
Na Figura 1 pode-se observar a diferença da tonalidade das soluções nos
béqueres 2 a 4 de acordo com o aumento de adição de etilenodiamina. No
primeiro béquer foi obtido [Ni(H2O)6]2+ por dissolução de NiCl2.6H2O em água
(solução verde). Nos béqueres 2, 3 e 4 foram obtidos os complexos [Ni(en)
(H2O)4]2+ (solução azul), [Ni(en)2(H2O)2]2+ (solução anil) e [Ni(en)3]2+
(solução violeta) por reação de [Ni(H2O)6]2+ com 5, 10 e 15 mL de
etilenodiamina, respectivamente.
Quando complexos são reativos e trocam ligantes rapidamente são chamados
complexos lábeis. A labilidade dos complexos é resultado dos efeitos
cinéticos e termodinâmicos que podem orientar os produtos finais de uma
reação. Um efeito importante é o efeito quelato, que diz respeito à maior
estabilidade de complexos formados com ligantes que possuam dois ou mais
sítios de coordenação disponíveis. (AYALA; BELLIS, 2003). A etilenodiamina é
um ligante bidentado, a água um ligante monodentado, com isso o complexo
[Ni(en)3]2+ é considerado mais estável que [Ni(H2O)6]2+.
Oliveira et al (2010), afirma que no espectro eletrônico de complexos
octaédricos de níquel(II) são esperadas três bandas devido à transições d-d
permitidas por spin. Além disso, o ligante etilenodiamina desdobra mais
fortemente o campo ligante, ou seja, aumenta a energia da transição
eletrônica para os complexos que o têm como ligante (CONSORTI et al, 2011).
Os espectros eletrônicos obtidos de cada solução (Figura 2) estão de acordo
com a literatura, pois mostram que de acordo com o aumento da adição de
etilenodiamina é evidenciado deslocamento das bandas para comprimentos de
onda menores.

Mudança de cores nas soluções após reação de [Ni(H2O)6]2+ com 5, 10 e 15 mL de solução de etilenodiamina (béqueres 2 a 4).
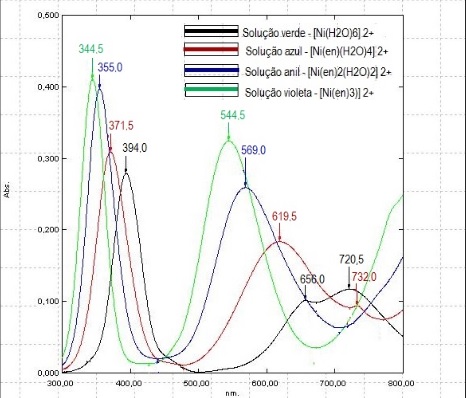
Espectros eletrônicos na região do UV-Vis das soluções rotuladas de 1 a 4.
Conclusões
As cores das soluções e o espectro visualizado estavam de acordo com a literatura, sendo essa alteração das cores, consequente de energias, decorrente de adições diferentes de soluções de etilenodiamina ao complexo hexaaquoniquel II. A partir disso entende-se como a concentração do ligante influencia na esfera de coordenação de um metal. Pôde-se avaliar o comportamento energético dos desdobramentos dos orbitais d do níquel II a partir da substituição do ligante H2O. Assim, com este trabalho os estudantes tem a oportunidade de aprimorar seus conhecimentos em técnicas para síntese de complexos.
Agradecimentos
A PROMAC/UECE pelo auxilio financeiro.
Referências
AYALA J.D., BELLIS V.M. Química Inorgânica Experimental, 2003. Disponível em: http://qui.ufmg.br/~ayala/matdidatico/apostila_inorg_exp.pdf. Acesso em: 01 de junho de 2015 às 15:00h
CONSORTI C.S., LEAL B.C., LUZA L., BAIBICH I.M. Abordagem Teórico-Experimental da Teoria do Campo Cristalino na Disciplina de Síntese Inorgânica, Química Nova, Vol. 34, No 10, 1830-1835, 2011.
OLIVEIRA M.R.L., MAIA J.R.S., BRAATHEN P.C. Práticas de Química Inorgânica, Complexos, 2010. Disponível em: https://www2.cead.ufv.br/sistemas/ojs/index.php/serieconhecimento/article/view/17/16. Acesso em: 01 de junho às 16:00h.

