TÍTULO: VELOCIDADE DE COMBUSTÃO DE UMA VELA: UM EXPERIMENTO ALTERNATIVO PARA O ENSINO DE CINÉTICA QUÍMICA
AUTORES: Nascimento, T.L.A.B. (UFPI) ; Monteiro, E.A.S. (UFPI) ; Leal, R.C. (UFPI) ; Moita Neto, J.M. (UFPI)
RESUMO: O presente trabalho relata um experimento alternativo para o ensino de cinética
química, em especial o cálculo da velocidade de um processo através do método
gráfico. A velocidade média de combustão da vela em ambiente fechado é menor para
ambos os casos analisados (velas de nº 1 e nº 3). Os pontos obtidos se ajustam
adequadamente ao modelo linear utilizado.
PALAVRAS CHAVES: Prática no ensino; Cinética química; Vela
INTRODUÇÃO: Dentro da Físico-Química uma subárea em especial que merece destaque é a
Cinética, responsável pelo estudo da velocidade das reações e dos mecanismos
reacionais quando as mesmas se processam em mais de uma etapa. Várias ideias
surgem a cada dia de como se trabalhar de forma dinâmica os conteúdos abordados
na sala de aula.
LIMA et al. (2000), propõem a contextualização como um mediador entre teoria e
prática no ensino de cinética química. Em seu trabalho mostra como, alternativa
dinâmica, o experimento sobre conservação de alimentos que associados aos
conhecimentos prévios dos alunos, visam estabelecer uma relação entre a prática
e a teoria.
FATARELI et al. (2010), retrata a importância de se trabalhar em grupo,
relatando uma estratégia didática aplicada em uma aula de cinética química, que
foi baseada nos preceitos da aprendizagem cooperativa, em especial no método
Jigsaw, que visa estimular a comunicação oral e escrita dos alunos através do
trabalho em grupo, relacionando também os assuntos estudados com aspectos do seu
cotidiano.
A Experimentação no Ensino de Cinética Química aliada aos conteúdos abordados,
desperta o interesse dos alunos em seus diversos níveis de escolaridade, devido
ao seu caráter motivador (GIORDAN,1999; FERREIRA, HARTWIG e OLIVEIRA, 2010).
Apresentamos uma alternativa no ensino de cinética química como uma
possibilidade de se trabalhar o conceito de velocidade de reações e fatores que
influenciam na velocidade (difusão de reagentes), realizando o experimento de
combustão de uma vela, aliando assim a prática com a teoria conceitual da
cinética química encontrada na literatura.
MATERIAL E MÉTODOS: O relato descreve o experimento de combustão de uma vela buscando determinar a
cinética química do processo. As velas utilizadas para análise são da marca Luz
da Vida de nº 1 (11 g) e nº 3 (17 g). Foi desprezada na análise da cinética a
parte superior da vela (formato cônico), sendo aproveitada apenas o restante da
vela de formato cilíndrico. Após isso, com a ajuda de uma régua plástica escolar
de 20 cm, a altura das velas foram medidas. Em seguida com a ajuda de um
cronômetro a cada 2 minutos de queima, a altura da vela foi monitorada, até o
tempo de uma hora. O processo de combustão da vela foi executado em um ambiente
fechado (a. f.), em um laboratório do departamento de Química da UFPI, e em um
ambiente aberto (a. a.), em um espaço ao ar livre também na UFPI.
Os fatores que influenciam na combustão (difusão de reagentes), podem ser
verificados através da comparação das velocidades de reação obtidas através da
equação da reta (ajuste linear).
RESULTADOS E DISCUSSÃO: Para que as substâncias possam reagir é necessário que haja condições ambientais
favoráveis. Três elementos concorrem para a combustão da vela: ignição (acender
a vela), combustível (própria vela: parafina) e comburente (oxigênio do ar).
Em todo o processo que envolve uma transformação química subjazem dois outros
mecanismos que determinam a sua cinética. A cinética química em si, que
corresponde as reações químicas que se processam e o mecanismo difusivo dos
reagentes que devem se encontrar para que ocorra a reação.
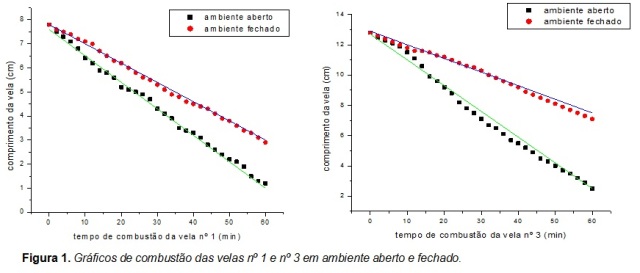
A Figura 1 apresenta o gráfico da combustão da vela nº 1, na qual apresenta o
tempo de consumo em ambiente aberto e fechado, e a regressão linear para ambos
os ambientes. Pode-se observar uma variação na velocidade, pois em ambiente
aberto há uma remoção facilitada dos produtos de reação (CO[sub]2[/sub] e
H[sub]2[/sub]O) da proximidade da vela em uma constante fonte de oxigênio.
A Figura 2 apresenta o gráfico que representa o processo de combustão em
ambiente aberto e fechado, e a regressão linear de ambos os ambientes, para a
vela nº 3. As velocidades confirmam a facilidade maior do oxigênio circular a
vela em ambiente aberto influenciando a velocidade da queima das velas de
diferentes tamanhos. Em ambiente sem circulação de ar a difusão do reagente
oxigênio até a vela retardou a reação, diminuindo a velocidade do processo.
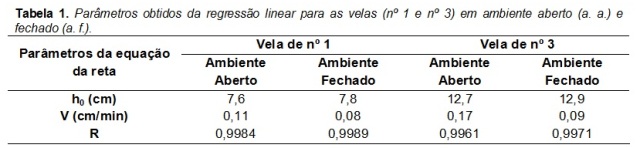
A Tabela 1 mostra os dados obtidos através do ajuste linear em ambiente aberto
(a. a.) e fechado (a. f.). Lembrando que a regressão linear é representada pela
equação da reta (y = a † b.x), sendo substituído no presente trabalho pelas
variáveis (h = h[sub]0[/sub] † v.t), onde h é altura, h[sub]0[/sub] é a altura
inicial, v é a velocidade média da reação e t é o tempo.
CONCLUSÕES: Através do experimento sobre a combustão da vela, pode-se trabalhar conceitos da
cinética química, como velocidade de reação e fatores que influenciam na
velocidade (concentração dos reagentes). Nossos resultados mostram que em ambiente
fechado a velocidade média de combustão é menor para ambos os casos (nº 1 e nº 3),
justificado pela menor concentração do gás comburente (oxigênio) em torno da
chama. Os pontos obtidos se ajustam adequadamente ao modelo linear utilizado.
AGRADECIMENTOS: LEAL, R.C. agradece à CAPES pela bolsa de pesquisa.
REFERÊNCIAS BIBLIOGRÁFICA: FATARELI, E. F.; FERREIRA, L. N. A.; FERREIRA, J.Q.; QUEIROZ, S. L. Método cooperativo de aprendizagem jigsaw no ensino de Cinética Química. Química Nova na Escola, v. 32, n. 3, p. 161 - 168, 2010.
FERREIRA, L. H.; HARTWIG, D. R.; OLIVEIRA, R. C. Ensino experimental de química: uma abordagem investigativa contextualizada. Química Nova na Escola, v. 32, n. 2, p. 101 - 106, 2010.
GIORDAN, M. O papel da experimentação no ensino de ciências. Química Nova na Escola, n. 10 p. 43 - 49, 1999.
LIMA, J. F. L., PINA, M. S. L.; BARBOSA, R. M. N.; JÓFILI, Z. M. S. Contextualização no ensino de Cinética Química. Química Nova na Escola, n. 11, p. 26 - 29, 2000.
