Estudo computacional usando sondas espectroscópicas: detecção de agentes de armas químicas
AUTORES: Braga, L. (UFLA) ; F. Silva, E. (UFLA) ; T. Mancini, D. (UFLA) ; P. da Rocha, E. (IFSUDESTEMG) ; F. F. da Cunha, E. (UFLA) ; C. Ramalho, T. (UFLA)
RESUMO: Os organofosforados (OPs) são compostos orgânicos amplamente empregados na agricultura, bem como em armas químicas. A detecção rápida desta classe de composto é crucial para determinação da exposição ambiental. Nesta perspectiva, a dipiririnona oxima (1) foi empregada para detecção de alguns OPs, que são empregados como agentes nervosos através de fluorescência emissão. Os parâmetros termodinâmicos e cinéticos, bem como as propriedades espectroscópicas dos complexos formados por 1 e OPs foram investigados por meio de cálculos teóricos. Os cálculos oxima-OPs foram realizados nos estados fundamental e excitado usando os níveis de DFT e TDDFT. DFT e TDDFT foram satisfatórios para este estudo, e a família funcional híbrida apresentou o menor erro quando em comparação com outras famílias.
PALAVRAS CHAVES: Acetilcolinesterase; Sondas espectroscópicas; Organofosforados
INTRODUÇÃO: Os organofosforados (OP) são compostos orgânicos que possuem, pelo menos, uma ligação química carbono-fósforo. A alta toxicidade dos compostos OP está associada à alta afinidade pela enzima acetilcolinesterase. Na verdade, é bem conhecido que os compostos OP podem formar uma ligação química estável com o resíduo do aminoácido serina presente no sítio ativo da enzima acetilcolinesterase (AChE). Diante desse cenário, a detecção e quantificação de compostos de OP no ambiente é crucial. Em 2013, Walton et al. sugeriram o uso de técnicas fluorescentes para detectar compostos OP. De fato, quando os compostos OP se ligam a uma sonda fluorescente, como dipiririnona oxima (2-etil-7-[(Z)- (hidroxiimino)metil]-1-metil-3H-dipirrolo[1,2-c:2' ,1'-f]pirimidina-3,5-diona), a cor muda de vermelho para amarelo. Apesar de vários esforços para aplicar sondas fluorescentes para detecção de OP, ainda há uma escassez de compreensão sistemática da termodinâmica de estruturas híbridas responsivas a convidados. Nessa perspectiva, o trabalho teórico pode ser um aliado na racionalização das propriedades termodinâmicas e espectroscópicas desses materiais. , o que poderia otimizar a detecção de compostos OP.
MATERIAL E MÉTODOS: Os cálculos do complexo oxima-organofosforado foram realizados nos estados fundamental e excitado usando os níveis de DFT e TD-DFT, respectivamente. Foram testados seis funcionais diferentes (B3LYP, CAM-B3LYP, B3PW91, MPW1PW91, PBEPBE, ωB97XD). O funcional que melhor se aproximou do resultado teórico da função de onda em relação ao resultado experimental foi selecionado para realizar os cálculos juntamente com o Conjunto de base DGTZVP. Para a superfície de energia potencial, foi empregada a resposta de superfície, que foi desenvolvida selecionando dois ângulos diedros α1 (C26, C28, C29, C31) e α2 (C29, C31, C32, C33). A energia para o solo e estado excitado foi calculado e uma varredura de superfície de energia potencial dos ângulos diedros α1 e α2 de -180 a 180º foi realizada. O efeito do solvente metanol na Resposta de Superfície foi realizado empregando IEFPCM para cada ponto da Superfície.
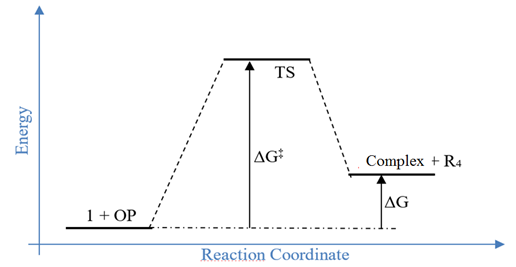
RESULTADOS E DISCUSSÃO: O DFT e o TD-DFT foram satisfatórios para este estudo, sendo que a família funcional híbrida apresentou o menor erro quando comparada às demais famílias. O funcional B3LYP apresentou o erro dentro de sua família (7.1), sendo o funcional selecionado para a etapa de otimização e cálculos das propriedades de absorção e emissão. A análise da Resposta de Superfície mostrou o mínimo de energia quando o ângulo α1 foi de 25º e α2 de 0º. A análise do solvente mostrou menor variação nos valores de absorção. O momento dipolar e a constante dielétrica mostraram influência nas propriedades de absorção. A reação entre os compostos 1 e OP mostrou-se cineticamente favorável para todos os compostos, sendo o Sarin e a Ciclosarina mais reativos. Os OPs com grupo de saída de enxofre demonstraram ser termodinamicamente mais favoráveis (VX, VG e VM). A reação VX mostrou -73 kcal/mol para ΔG e -98 kcal/mol para ΔH. O TDA foi significativo, pois esta metodologia descreve melhor os efeitos do solvente.29–31 Apenas três compostos apresentaram valores de emissão (DCP, VG e GV). A emissão foi influenciada pelas transições HOMO-1 – LUMO, HOMO-LUMO e HOMO-LUMO+1.
A) Resposta de superfície do complexo Oxima/organofosfato mostrando o
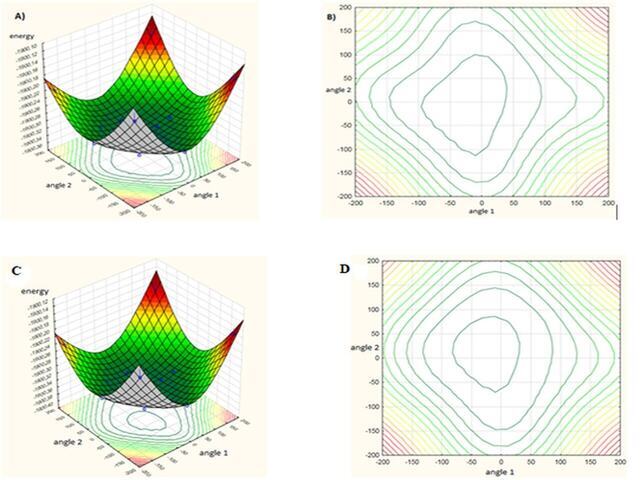
Diagrama de reação entre 1 e organofosforados. O ΔG‡ é a energia livre
CONCLUSÕES: A estrutura conformacional gerada na superfície de resposta foi importante para a deslocalização dos orbitais entre oxima e organofosforados. A compreensão da natureza da emissão e da influência do solvente foi importante para este estudo, pois permite propor novas formas de modificações estruturais de compostos para a construção de sondas fluorescentes mais eficientes.
AGRADECIMENTOS: FAPEMIG, CAPES e CNPq pelo apoio financeiro desta pesquisa e à UFLA pela infraestrutura e incentivo neste trabalho
REFERÊNCIAS BIBLIOGRÁFICA: W. E. A. de Lima; A. F. Pereira; A. A. de Castro; E. F. F. da Cunha; T. C. Ramalho, "Fexibility in the molecular design of acetylcholinesterase reactivators: probing representative conformations by chemometric techniques and docking/QM calculations," Letters in Drug Design & Discovery. vol. 13, no. 5, pp. 360–371, 2016.
[2] H. Zhang; X. Hua; X. Tuo; C. Chen; X. J. Wang, "Polystyrene microsphere-based lanthanide luminescent chemosensor for detection of organophosphate pesticides," Rare Earths, vol. 30, no. 12, pp. 1203–1207, 2012.
[3] H. A. Azab; A. Duerkop; Z. M. Anwar; B. H. M. Hussein; M. A. Rizk, "Luminescence recognition of different organophosphorus pesticides by the luminescent Eu (III)–pyridine-2, 6-dicarboxylic acid probe," Analytica. Chimica Acta, vol. 759, pp. 81–91, 2013.
V. M. R. dos Santos; C. L. Donnici; J. B. N. da Costa; J. M. R. Caixeiro, "Organophosphorus pentavalent compounds: history, synthetic methods of preparation and application as insecticides and antitumor agents," Química Nova, vol. 30, no. 1, pp. 159–170, 2007.
[5] G. Yue; S. Su; N. Li; M. Shuai; X. Lai; D. Astruc; P. Zhao, "Gold nanoparticles as sensors in the colorimetric and fluorescence detection of chemical warfare agents," Coordination Chemistry Reviews, vol. 311, pp. 75–84, 2016.
[6] N. Singh; Y. Karpichev; A. K. Tiwari; K. Kuca; K. K. Ghosh, "Oxime functionality in surfactant self-assembly: an overview on combating toxicity of organophosphates," Journal of Molecular Liquids, vol. 208, pp. 237–252, 2015.
[7] M. Singh; M. Kaur; H. Kukreja; R. Chugh; O. Silakari; D. Singh, "Acetylcholinesterase inhibitors as Alzheimer therapy: from nerve toxins to neuroprotection," European Journal of Medicinal Chemistry, vol. 70, pp. 165–188, 2013.
[8] C. Scheffel; H. Thiermann; F. Worek, "Effect of reversible ligands on oxime-induced reactivation of sarin-and cyclosarin-inhibited human acetylcholinesterase," Toxicology. Letters, vol. 232, no. 3, pp. 557–565, 2015.
[9] Y. Liu; H. Yu; L. Zhao; H. Zhang, "Radiolabeled Zn-DPA as a potential infection imaging agent," Nuclear Medicine and Biology, vol. 40, pp. 126–134, 2012.
[10] M. Winter; T. Wille; K. Musilek; K. Kuca; H. Thiermann; F. Worek, "Investigation of the reactivation kinetics of a large series of bispyridinium oximes with organophosphate-inhibited human acetylcholinesterase," Toxicology Letters, vol. 244, pp. 136–142, 2016.
[11] A. Kulakova; S. Lushchekina; B. Grigorenko; A. Nemukhin, "Modeling reactivation of the phosphorylated human butyrylcholinesterase by QM (DFTB)/MM calculations," Journal Theoretical and Computational Chemistry, vol. 14, no. 7, 1550051, 2015
[12] D. M. Maxwell; K. M. Brecht; R. E. Sweeney, "A common mechanism for resistance to oxime reactivation of acetylcholinesterase inhibited by organophosphorus compounds," Chemico-Biological Interactions, vol. 203, no. 1, pp. 72–76, 2013.
[13] J. Bajgar; K. Kuca; D. Jun; L. Bartosova; J. Fusek, "Cholinesterase reactivators: the fate and effects in the organism poisoned with organophosphates/nerve agents," Current. Drug Metabolism, vol. 8, no. 8, pp. 803–809, 2007.
