Estudo de caso da indometacina para melhorar a biodisponibilidade de medicamentos: construção teórica de relações termodinâmicas para uma transição de fase controlada por solvente
AUTORES: P. S. de Brito, K. (UFLA) ; Braga, L. (UFLA) ; C. Ramalho, T. (UFLA) ; R. Cardoso, T. (UFLA) ; F. F. da Cunha, E. (UFLA)
RESUMO: Os aspectos termodinâmicos da transição de fase polimórfica de α-indometacina para γ-indometacina são a chave fundamental para encontrar a fase mais biodisponível da indometacina. No presente trabalho, variar a permissividade do solvente altera as transições polimórficas. Assim, as propriedades termodinâmicas, como entalpia, energia livre de Gibbs e entropia de ambos os polimorfos de indometacina, são determinadas em termos da permissividade do solvente em T0 = 298,15 K e P0 = 1 atm., que são crucialmente relacionadas à estabilidade, espontaneidade e reversibilidade da transformação polimórfica. Além disso, um arranjo cristalino pode ser transformado em outro pela chamada transição de fase polimórfica. O entendimento sobre como induzir ou suprimir transições de fase polimórficas.
PALAVRAS CHAVES: Indometacina ; Transição de fase polimór; Métodos DFT
INTRODUÇÃO: A indometacina (C19H16CINO4), cuja estrutura molecular é mostrada na Figura 1, é um fármaco relativamente comum e prescrita principalmente por suas características analgésicas, anti-inflamatórias e antipiréticas; no entanto, ele vem em pelo menos sete formas cristalinas distintas. Os polimorfos de α- e γ- indometacina (Figura 2) são os mais estáveis e permitem a descrição cristalográfica [1,2]. Como se sabe, um fármaco pode cristalizar em diferentes polimorfos, que são caracterizados por seu arranjo espacial único com propriedades físico-químicas distintas, em particular, diferentes solubilidades e biodisponibilidades. Os aspectos termodinâmicos da transição de fase polimórfica da α-indometacina para γ-indometacina são a chave fundamental para encontrar a fase mais biodisponível da indometacina. O entendimento sobre como induzir ou suprimir transições de fase polimórficas desempenha um papel valioso na indústria farmacêutica no que diz respeito à biodisponibilidade e patenteabilidade do processo de desenvolvimento de medicamentos [3,4,5]. No presente trabalho, variar a permissividade do solvente altera as transições polimórficas. Aqui, as propriedades termodinâmicas da indometacina são investigadas a fim de encontrar uma transição de fase impulsionada pela permissividade do meio. O objetivo deste trabalho é propor uma estratégia de transição de fase controlada por solvente para aumentar biodisponibilidade da indometacina usando simulações DFT ligadas à estabilidade, espontaneidade, reversibilidade e biodisponibilidade dos polimorfos e sua transformação.
MATERIAL E MÉTODOS: O programa Gaussian 09 foi usado para determinar grandezas termodinâmicas padrão a 1 atm, como entalpia (H), energia livre de Gibbs (G) e entropia (S) para as fases α- e γ- indometacina, que são funções de permissividade de diferentes solventes a uma temperatura fixa de 298,15 K. O cálculo foi realizado usando DFT com o funcional B3LYP e com a base a base 6-321G definida por meio do modelo contínuo polarizável (PCM), usando a variante de formalismo de equação integral (IEFPCM) no cálculo padrão do campo de reação autoconsistente (SCRF).
RESULTADOS E DISCUSSÃO: Parâmetros como temperatura, permissividade do solvente, pressão no cristal orgânico e pH do meio podem alterar significativamente a estabilidade, solubilidade e biodisponibilidade dos fármacos [6,7]. Para melhorar o conhecimento da biodisponibilidade do fármaco, a permissividade do solvente foi escolhida como parâmetro de ordem para a análise termodinâmica. As principais funções termodinâmicas padrão H(D; ε, P0, T0, N), G(D; ε, P0, T0, N) and S(D; ε, P0, T0, N) foram computadas para seis moléculas de indometacina (N=6) em termos de permissividade do solvente ε em T0=298,15 K e P0=1 atm. Os solventes polares empregados no cálculo de energia SCRF=PCM são descritos, e o respectivo valor de permissividade de cada solvente é mostrado entre parênteses: 1-bromooctano (5,02), anilina (6,89), pentanal (10,0), 1-pentanol (15,13) , 1-propanol (20,52), etanol (24,85), 1-benzonitrila (25,59), metanol (32,61), acetonitrila (35,69), 1,2-etanodiol (40,25) e água (78,36).
Figura 1: (A) Molécula de indometacina, (B e C) polimorfos de α- e γ-
Figura 2: (A) Energia livre de entalpia e Gibbs (B) Entropia versus pe
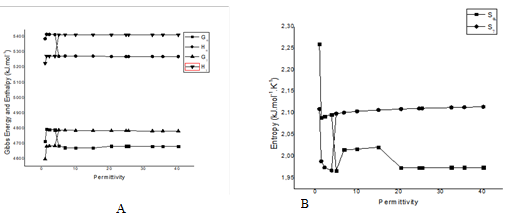
CONCLUSÕES: Em solventes com permissividade entre 1,0 e 5,0, γ- indometacina é a forma mais estável, e em solventes com valores de permissividade acima de 5,0 α -indometacina é mais estável. Nossos achados teóricos estão de acordo com os experimentos, porque no ar, enquanto a permissividade é aproximadamente 1,0, a forma estável da indometacina é gama e a alfa indometacina é precipício em uma solução de etanol e água, cuja permissividade está entre 24,85 e 78,3. Acreditamos que tal pesquisa pode ser útil na investigação do desenho lógico da biodisponibilidade de medicamentos.
AGRADECIMENTOS: CNPq pelo apoio financeiro através do projeto no. 150882/2017-3.T, CAPES e Fapemig.
REFERÊNCIAS BIBLIOGRÁFICA: 1. Surwase, S.A.; Boetker, J.P.; Saville, D.; Boyd, B.J.; Gordon, K.C.; Peltonen, L.; Strachan, C.J. Indomethacin: New Polymorphs of an Old Drug. Mol. Pharm, 2013, 10 (12), 4472–4480.
2. Padmaja, N.; Ramakumar, S.; Viswamitra, M.A. Space-group frequencies of proteins and of organic compounds with more than one formula unit in the asymmetric unit. Acta Crystallogr. Sect. A Found, 1990, 46, 725–730.
3. Raza, K. Polymorphism: The Phenomenon Affecting the Performance of Drugs. SOJ Pharm. Pharm. Sci, 2014, 1 (2), 10.
4. Soares, J.; Guimarães, E. Polymorph drug patents and their public health impact, in: Heal. Innov. Soc. Justice Brazil, 2018, 177–210.
5. Tandon, R.; Tandon, N.; Thapar, R. K. Patenting of polymorphs. Pharm. Pat. Anal. 2018, 7 (2), 59–63. Hanna, Application Data Provisional application, 2009.
6. Castañeda, M. A.; Del Castillo, L.M.; Whitaker, J.R.; Tappel, A.L. Effect of ionic strength on the kinetics of trypsin and alpha chymotrypsin. J. Gen. Physiol, 1961, 44 (6), 1103–1120.
7. D. Pharmacia Lettre, B.A. L, S.S. K, P.S. V, Scholars Research Library Enhancement of Solubility: A Pharmaceutical Overview. International Journal of Medical Research & Health Sciences., 2010, 310-318.
8. Cardew P. T. and Davey R. J. The kinetics of solvent-mediated phase transformations. Proc. R. Soc. London. A, 1985, 398, 415–428.
9. Cornish, A. B. Enthalpy-entropy compensation: A phantom phenomenon. J. Biosci. 2002, 27 (2), 121–126.
10. Yamamoto, H.; Kobayashi, Y.; Harano, Y. Solid Phase Transition of Indomethacin Crystal. J. Japanese Assoc. Cryst. Growth, 1995, 22 (3), 234.
11. Liang, W.; Li, X.; Dalton, L.R.; Robinson, B.H.; Eichinger, B.E. Solvents Level Dipole Moments. J. Phys. Chem. B, 2001, 115 (43), 12566–12570.
12. Shriver, D. Inorganic chemistry, 2nd ed., Oxford University Press, Oxford, 1994.
13. Atef, E.; Chauhan, H.; Prasad, D.; Kumari, D.; Pidgeon, C. Quantifying Solid-State Mixtures of Crystalline Indomethacin by Raman Spectroscopy Comparison with Thermal 4 Analysis, ISRN Chromatogr. 2012, 2012, 1–6.
