Realizado em Tereseina/PI, de 11 a 13 de Setembro de 2019.
ISBN 978-85-85905-26-2
TÍTULO: ESTUDO POR ANCORAMENTO MOLECULAR DA INTERAÇÃO DO FLAVONOIDE (-) epi-catequina COM A ENZIMA 5-LOX.
AUTORES: Carvalho, G.F.S. (UESPI) ; Uchôa, V.T. (UESPI) ; Ramos, R.M. (IFPI) ; Costa Junior, F.L.C. (IFPI) ; Carneiro, R.S. (UESPI) ; Sousa, H.G. (UESPI)
RESUMO: No processo de inflamação pulmonar são metabolizados leucotrienos através da
enzima 5-LOX. A (-)epi-catequina apresenta ação anti-inflamatória
comprovada. A abordagem in silico tem gerado previsões confiáveis no modo de
ação de drogas. O objetivo deste trabalho foi investigar a interação entre a
(-)epi-catequina e enzima 5-LOX como possível alvo farmacológico no processo
de inflamação pulmonar por ancoramento molecular. Foi realizada comparação
para os complexos 5-Lox-AracA e 5-Lox-EpiC em parâmetros como ΔG, Ki,
Ligações de Hidrogênio e interações hidrofóbicas utilizando os softwares
Autodock e Auto Vina. O complexo 5-Lox-EpiC apresentou melhores resultados
para ΔG e Ki. Sugerimos a inibição da enzima 5-LOX pela (-)epi-catequina,
evidenciando sua ação anti-inflamatória.
PALAVRAS CHAVES: Ancoramento Molecular; 5- lipoxigenase; Inflamação Pulmonar
INTRODUÇÃO: A forma como moléculas e proteínas interagem tem papel crucial em processos
fisiopatológicos, sendo importante para o planejamento de medicamentos
(VERLI, 2014). A abordagem in silico tem demonstrado capacidade de gerar
previsões confiáveis sobre o modo de ação das drogas ajudando a reduzir os
custos do desenvolvimento de fármacos (PIÑERO et al., 2018).
No ancoramento molecular, possíveis moléculas bioativas são testadas para um
determinado alvo molecular a fim de estabelecer qual delas apresentam melhor
acomodação ao sítio ativo do alvo. Os resultados obtidos são dados em termos
da energia de ligação necessária para que a provável molécula bioativa se
ligue ao sítio ativo do alvo molecular selecionado (BARROS, 2015).
Existem diversos programas de ancoramento molecular disponíveis. Uns dos
programas mais utilizados são o AutoDock e AutoDock Vina, cuja função de
pontuação é estabelecida na hidrofobicidade, ligações de hidrogênio,
interações estéricas e no número de ligações rotativas ativas (BARBOSA,
2016).
No processo de inflamação aguda, as fosfolipases celulares são ativadas para
decompor os fosfolipídios da membrana em ácido araquidônico, que por sua vez
é metabolizado para prostaglandinas e leucotrienos pelas enzimas
ciclooxigenase (COX) e lipoxigenase (LOX) (MEKA et al., 2018). Existem
vários tipos de LOX (5-, 9-, 12- e 15-LOX), estando a iso-formas 5-LOX
relacionada ao processo de inflamação pulmonar (CZAPSKI et al., 2016).
Este trabalho pretende, através de estudos por ancoramento molecular,
investigar a interação entre a (-)epi-catequina e enzima 5- LOX como
possível alvo farmacológico no processo de inflamação pulmonar.
MATERIAL E MÉTODOS: Os testes computacionais foram realizados no Laboratório de Pesquisa em
Sistemas de Informação (IFPI). Os cálculos de ancoramento molecular foram
aplicados utilizando o software Autodock 4.2 (MORRIS et al., 2008) e
Autodock Vina, versão 1.1.2 (TROTT e OLSON, 2010). Autodock Tools (ADT),
versão 1.5.6, foi usado para preparar proteínas e ligantes para cálculos de
ancoramento. O Autodock foi configurado de acordo com Ramos et al., 2012. O
Autodock Vina e o Autodock usaram caixa de grids do mesmo tamanho. Os
centros dos grids de afinidade foram definidos no resíduo de sítio ativo
Phe177 do 5-Lox. A estrutura 3D da cadeia de Arachidonate 5-lipoxigenase (5-
Lox) foi obtida a partir do Protein Data Bank (PDB ID: 3V92). As estruturas
tridimensionais dos ligantes Ácido Araquidônico (AracA) e Epi-Catequina
(EpiC) foram obtidas do Projeto PubChem (CID 444899 e 72276,
respectivamente).
RESULTADOS E DISCUSSÃO: A Tab. 1 mostra os resultados do ancoramento molecular. Observa-se que o
complexo 5-Lox-EpiC apresentou melhores resultados para energia de ligação e
constante de inibição (-6,83 kcal / mol e 9,87 μM, respectivamente) quando
comparado aos resultados para o complexo 5-Lox-AracA (-6,79 kcal / mol e
10,49 μM, respectivamente), tendo em conta os resultados obtidos com o
software Autodock. O complexo 5-Lox-EpiC formou quatro ligações de
hidrogênio (Ala424, Trp599, Leu420, Tyr181) enquanto o complexo 5-Lox-AracA
formou duas ligações de hidrogênio (His600, Asn425). O complexo 5-Lox-AracA
apresentou maior número de interações hidrofóbicas, o que pode ser explicado
devido ao seu maior volume molecular. Em relação ao Autodock Vina, o
complexo 5-Lox-EpiC também apresentou melhor resultado para energia de
ligação (-5,5 kcal / mol) quando comparado ao complexo 5-Lox-AracA (-4,4
Kcal / mol). A fig. 1 mostra a conformação resultante do acoplamento.
Observa-se que os ligantes estão na região do sítio ativo de 5-Lox próximo
ao resíduo Phe177. Sabe-se que o efeito farmacológico dos flavonoides se
deve ao caráter inibidor enzimático desses compostos (REDREJO et al., 2004).
Os resultados dos estudos in silico com a 5-Lox indicam que o ligante EpiC
apresentou parâmetros de afinidade melhores que o ligante AracA, comprovando
uma maior probabilidade da enzima interagir com o flavonoide do que com seu
ligante natural, inibindo a metabolização de ácido araquidônico em
leucotrienos, atenuando o processo inflamatório pulmonar, sugerindo ação
anti-inflamatória da (-) epi-catequina.
Resultados semelhantes podem ser observados in vivo por Ruijters et al.
(2014) e Xing et al. (2019) que presentaram a (-) epi-catequina como uma
nova opção terapêutica no tratamento da lesão pulmonar aguda.
Tabela 1
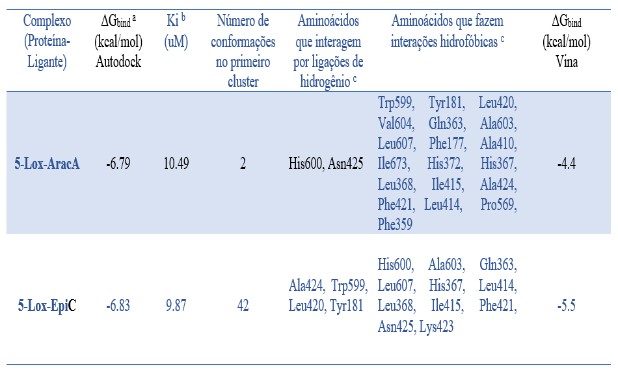
Parâmetros de afinidade do ancoramento molecular
Figura 1
Estrutura global das conformações resultado de
ancoramento molecular. 5-LOX é mostrado em uma
superfície transparente.
CONCLUSÕES: Diante da avaliação in silico, através do estudo por ancoramento molecular, os
resultados sugerem a inibição da enzima envolvida no processo de inflamação
pulmonar, 5-LOX, pelo flavonoide (-) epi-catequina. Desta forma evitando a
liberação de leucotrienos, comprovando a ação anti-inflamatória deste
flavonoide presente em diferentes plantas utilizadas na medicina popular.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: BARBOSA, U. R. Seleção de compostos naturais candidatos à inibição da enzima isocitrato liase do Paracoccidioides spp.: uma abordagem por triagem virtual e dinâmica molecular. 2016. 61 f. Dissertação (Mestrado), Univ. Federal de Goiás, Jataí, 2016.
BARROS, Maria Ester de Sá Barreto. Estudos de Docking Molecular, síntese e atividade biológica de análogos da (-)-massoialactona e da combretastatina A-4. 2015. (tese de doutorado).
CZAPSKI, G. A. et al. The lipoxygenases: their regulation and implication in Alzheimer’s disease. Neurochemical research, v. 41, n. 1-2, p. 243-257, 2016.
MEKA, B. et al. Synthesis, in vitro and in silico evaluation of diaryl heptanones as potential 5LOX enzyme inhibitors. Bioorganic chemistry, v. 80, p. 408-421, 2018.
PIÑERO, J.; FURLONG, L. I.; SANZ, F. In silico models in drug development: where we are. Current opinion in pharmacology, v. 42, p. 111-121, 2018.
RAMOS, R. M.; PEREZ, J. M.; BAPTISTA, L. A.; DE AMORIM, H. L. N. Interaction of wild type, G68R and L125M isoforms of the arylamine-N-acetyltransferase from Mycobacterium tuberculosis with isoniazid: a computational study on a new possible mechanism of resistance. Journal of molecular modeling, v. 18, p. 4013-4024, 2012.
REDREJO-RODRIGUEZ, M. et al. Lipoxygenase inhibition by flavonoids: semiempirical study of the structure–activity relation. Journal of Molecular Structure: THEOCHEM, v. 674, n. 1-3, p. 121-124, 2004.
RUIJTERS, E. J. B. et al. The anti-inflammatory efficacy of dexamethasone is protected by (−)-epicatechin. PharmaNutrition, v. 2, n. 2, p. 47-52, 2014.
TROTT, O.; OLSON, A. J. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading. Journal of computational chemistry, v. 31, n. 2, p. 455-461, 2010.
VERLI, H. Bioinformática: da biologia à flexibilidade molecular. 2014.
XING, J. et al. Epicatechin alleviates inflammation in lipopolysaccharide-induced acute lung injury in mice by inhibiting the p38 MAPK signaling pathway. International immunopharmacology, v. 66, p. 146-153, 2019.
