Realizado em Goiânia/GO, de 04 a 06 de Setembro de 2017.
ISBN: 978-85-85905-20-0
TÍTULO: SÍNTESE DE BASES DE MANNICH DERIVADAS DE 2’,4’-DIHIDROXICHALCONAS COM POTENCIAL ANTICÂNCER
AUTORES: Gomes Pereira, L. (UNIVERSIDADE FEDERAL DE GOIÁS) ; Peréz, C.N. (UNIVERSIDADE FEDERAL DE GOIÁS) ; Bernardes, A. (UNIVERSIDADE FEDERAL DE GOIÁS)
RESUMO: As chalconas são substâncias naturais que podem ser obtidas sinteticamente
via condensação de Claisen Schmidt. A classe das chalconas hidroxiladas tem
sido relacionada com atividade antitumoral. A aminoalquilação dos derivados
das chalconas (bases de Mannich) pode promover aumento da suas respectivas
bioatividades.Entretanto, os longos tempos reacionais e os baixos
rendimentos apresentam-se como desvantagens na síntese de aminoalquilados. O
presente projeto teve como objetivo a síntese de bases de Mannich derivadas
de hidroxichalconas com potencial anticâncer em altos rendimentos. As
caracterizações realizadas via RMN de núcleo ¹H confirmaram os compostos
chalcônicos e as bases de Mannich sintetizadas. Três dos compostos
apresentaram inibição superior a 60% em μg/mL.
PALAVRAS CHAVES: hidroxichalconas; bases de Mannich; câncer
INTRODUÇÃO: As chalconas se constituem como uma das principais classes de substâncias
naturais,podendo ser encontradas em plantas, vegetais, especiarias e
pertencem à família dos flavonoides - flavonoides de cadeia aberta. Em
termos de estrutura química, as chalconas são classificadas como cetonas
aromáticas α,β-insaturada, ou seja, se constituem como substâncias derivadas
da 1,3-difenil-2-propen-1-ona (REDDY, et. al, 2008).
A classe chalconas hidroxiladas tem sido amplamente estudada na literatura
devido seus efeitos benéficos, especialmente atividade antioxidante, além de
outros efeitos farmacológicos como antitumoral (YEN-CHIN, et al., 2007) e
anti-inflamatório (PRASAD, 2011).
Em relação à atividade antitumoral, hidroxichalconas tem sido descritas como
indutoras de morte celular por apoptose em várias linhagens cancerosas
devido seus efeitos pró-oxidantes (YEN-CHIN, et al., 2007). As chalconas
podem ser obtidas sinteticamente via Condesação de Claisen Schmidt (FU, et
al., 2014; KUMAR, et al., 2015).
As chalconas são passiveis de diversas modificações. Dentre
elas, tem-se a conversão em Bases de Mannich correspondentes, que são
frequentemente acompanhadas do um aumento na bioatividade (REDDY, et al.,
2008).
A reação de Mannich consiste na condensação da amônia ou uma amina primária
ou secundária com formaldeído e um composto que contenha pelo menos um átomo
de hidrogênio com pronunciada reatividade fornecendo produtos
aminoalquilados (KUMAR, et al.,2015). Entretanto, esta reação apresenta as
desvantagens de longos tempos reacionais elevando-se até por vários dias.
O presente projeto teve como objetivo a síntese de bases de Mannich
derivadas de 4'-hidroxichalconas e 2',4' - dihidroxichalconas com potencial
anticâncer em altos rendimentos.
MATERIAL E MÉTODOS: 1) Síntese das chalconas 4’ hidroxiladas: as sínteses das hidroxichalconas
1, 2 e 3 foram realizadas via condensação de Claisen-Schmidt. Na proporção
1:1, foram adicionados a 4’-hidroxiacetofenona e os benzaldeídos (1:1). A
reação seguiu a temperatura ambiente (t.a) e foi monitorada por
cromatografia em camada delgada (CCD). Ao final da reação,água gelada foram
adicionados ao meio e este também foi acidificado com solução de HCl 10% até
pH 3. Os precipitados foram filtrados e cristalizados em metanol.
2) Síntese das chalconas 2’, 4’ - dihidroxiladas: para a síntese das
chalconas dihidroxiladas 4, 5 e 6 foram realizadas a etapa de proteção da
2’, 4’dihidroxiacetofenona anteriormente à condensação aldólica, seguindo o
procedimento descrito a seguir. Em uma solução de 3,4-dihidro-α-pirano
dissolvido em diclorometano, adicionou-se uma suspensão de 2’,4’-
dihidroxiacetofenona e tolueno-4-sulfonato de piridinio (3:1:2) em
diclorometano. A reação foi agitada e monitorada por CCD. Findado o tempo
reacional, a reação foi neutralizada com solução de bicarbonato de sódio,
extraída com clorofórmio e concentrada à vácuo.
3)Síntese das Bases de Mannich:para a síntese dos compostos 8 e 9,
uma solução de morfolina e paraformaldeído (1:2) dissolvidos etanol
permaneceu sob refluxo (72 ºC) por 2 h. Posteriormente, as hidroxichalconas
(compostos 1 e 5) foi adicionada e a reação à pressão atmosférica (2:1 em
relação à quantidade de benzaldeído), sendo monitorada por CCD. Finalizada a
reação, o solvente foi evaporado e a mistura reacional foi dissolvida em
éter anidro e HCl gasoso foi borbulhado nesta solução a fim de se obter os
compostos na forma de cloretos.
4) Citotoxicidade:para a avaliação da citotoxicidade foi utilizado o método
MTT contra a linhagem HeLa.
RESULTADOS E DISCUSSÃO: Nos espectros de RMN 1H dessa classe de compostos, a presença de dubletos
entre 7.0 e 8.0 ppm com acoplamentos (J) de 15-16 Hz confirmam além da
condensação de Claisen Schmidt, a geometria trans da ligação dupla presente
nessas moléculas. Também foram identificados os sinais relativos aos
hidrogênios aromáticos (8 – 6 ppm) e aqueles relativos às metoxilas dos
compostos 1 e seu derivado base de Mannich 9. Além da indicação por
monitoramento por CCD confirmar a formação da base de Mannich a partir do
precursor 1, a grande diferença entre os pontos de fusão também sugere tal
conversão. Os dados espectroscópicos de RMN ¹H da base de Mannich 9,
confirma pela integração a quantidade esperada de hidrogênios aromáticos em
tal composto. As multiplicidades melhores definidas no espectro do precursor
1, se tornam mais complexas nos espectros da sua base de Mannich 9 devido ao
possível acoplamento entre o grupo hidroxila e as aminas com hidrogênios
vizinhos. Dificuldades na análise espectral do composto 8, impossibitaram a
confirmação dessa base de Mannich e por isso, tal confirmação está sendo
realizada por análise cristalográfica e também serão realizados testes com
diversos solventes para otimização dos espectros de RMN ¹H a serem obtidos.
Na Tabela 1, estão apresentados os rendimentos médios obtidos na síntese das
substâncias 1-9.
Na avaliação da inibição tumoral dos compostos 2, 6 e 9, foram obtidos os
resultados apresentados na Tabela 2.
Observa-se que tanto na dose de 30 µg/mL quanto na dose de 3,0 µg/Ml, a
inibição tumoral dos compostos apresentou a seguinte ordem: 2 > 9 > 6. Na
dose de 0,3 µg/Ml torna-se limitada a análise, uma vez que os desvios
padrões foram relativamente altos.
Tabela 1
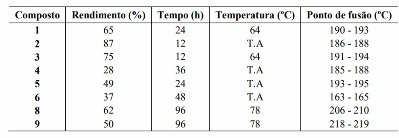
Rendimentos médios da síntese dos compostos (1 -
9).
Figura 1
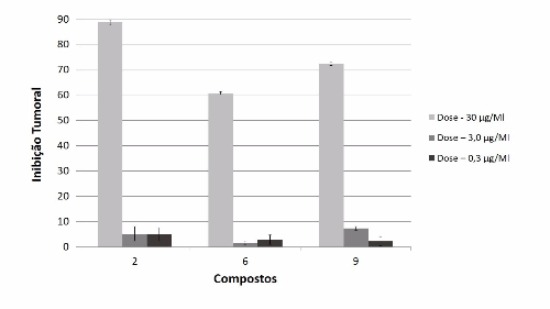
Comparação das atividades biológicas dos compostos
2, 6 e 9.
CONCLUSÕES: Foi possível avaliar algumas variáveis relacionadas com a obtenção de
compostos 2’,4’ – dihidroxichalcônicos e 4’-hidroxichalcônicos, bem como a
viabilidade da modificação desses compostos via reação de amino-alquilação
(Bases de Mannich).
Observou-se a relevância do estudo das condições reacionais para a obtenção de
compostos dihidroxilados que possuem a etapa adicional de proteção, uma vez
que os mesmos apresentaram baixos rendimentos em relação aos compostos que não
necessitam de proteção.
Foi observada atividade antitumoral superior à 60% em em 30 µg/Ml (pelo método
MTT).
AGRADECIMENTOS: Ao CNPq e à CAPES pelas bolsas de IC e doutorado e à CNPq pelo auxílio
financeiro. Ao laboratório de Ressonância Magnética Nuclear da UFG.
REFERÊNCIAS BIBLIOGRÁFICA: FU, Haoran et al. Synthesis and anti-tumor activity of novel aminomethylated derivatives of isoliquiritigenin. Molecules, v. 19, n. 11, p. 17715-17726, 2014.
KUMAR, Neeraj et al. Synthesis, analgesic and anti-inflammatory activities of chalconylincorporated hydrazone derivatives of mefenamic acid.Medicinal Chemistry Research, v. 24, n. 6, p. 2580-2590, 2015.
PRASAD, S. et al. “ROS and CHOP are critical for dibenzylideneacetone to sensitize tumor cells to TRAIL through induction of death receptors and downregulation of cell survival proteins”. Cancer research, v. 71, n. 2, p. 538-549, 2011.
REDDY, M. Vijaya Bhaskar et al. Design, synthesis, and biological evaluation of Mannich bases of heterocyclic chalcone analogs as cytotoxic agents. Bioorganic & medicinal chemistry, v. 16, n. 15, p. 7358-7370, 2008.
YEN-CHIN, L. et al. "Chalcone inhibits the activation of NF-κB and STAT3 in endothelial cells via endogenous electrophile". Life sciences, v. 80, n. 15, p. 1420-1430, 2007.
