Realizado em Vitória/ES, de 09 a 11 de Setembro de 2015.
ISBN: ISBN 978-85-85905-13-2
TÍTULO: Influência da variação da massa do catalisador na síntese enzimática do monoéster de xilitol
AUTORES: Rufino, A.R. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Teixeira, R.S. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Moraes, A.R.A. (UNIVERSIDADE FEDERAL FLUMINENSE) ; de Castro, H.F. (UNIVERSIDADE DE SÃO PAULO) ; Biaggio, F.C. (UNIVERSIDADE DE SÃO PAULO)
RESUMO: Para obtenção de ésteres de xilitol, os métodos químicos tradicionais utilizam
solventes tóxicos, ácidos fortes e temperaturas elevadas. Tal fato faz com que
a alternativa de uma síntese enzimática seja mais proveitosa e coerente com os
preceitos da Química Verde. Entretanto, mesmo realizando-se a síntese por via
enzimática, o tempo reacional ainda é extenso e as enzimas apresentam um custo
elevado. Este trabalho propõe a variação da massa do catalisador visando obter
rendimentos satisfatórios sem desperdício de material durante o processo. Para
realização das esterificações foi utilizado como catalisados a lipase de
Penicillium camembertii(Lipase G) imobilizada em suporte POS-PVA para
obtenção do monooleato de xilitol, chegando-se à uma massa ideal de 400mg de
derivado imobilizado.
PALAVRAS CHAVES: Penicillium camembertii; Monoéster de xilitol; Catálise enzimática
INTRODUÇÃO: Nos últimos anos têm ocorrido avanços significativos no uso de enzimas, em
função das exigências para que as indústrias operem seus processos em
condições de desenvolvimento sustentável, de química verde, ou em sistema de
tecnologia limpa (DA SILVA et al, 2005). As lipases são biocatalisadores com
importantes aplicações em diferentes áreas, podendo catalisar reações tanto em
meio aquoso como em meio orgânico, com teor de água restrito. Dentre os
processos mais comuns, a produção de biossurfactantes de ésteres de açúcar
merece um destaque especial (NITSCHKE et al, 2002). A Lipase de Penicillium
camembertii, conhecida como Lipase G, atua seletivamente na esterificação
de açúcares, apresentando alta atividade na acilação direta de glicerol para
obtenção de monoésteres partindo de ácidos graxos com diferentes comprimentos
de cadeia (MENDES et al, 2011). Os Ésteres de xilitol são muito utilizados
como emulsificantes e surfactantes nos alimentos, cosméticos e produtos
farmacêuticos (ADNANI et al, 2010). Eles também possuem ações antimicrobiana e
antitumoral. A síntese convencional de monoésteres de xilitol requer alta
temperatura, catalisadores ácidos corrosivos além de formar subprodutos
indesejados. Atendendo à Química verde, a catálise enzimática de ésteres
possibilita o uso direto do substrato, condições brandas de reação e alta
seletividade (ADNANI et al, 2011).Entretanto, o elevado custo das enzimas,
inviabiliza o processo. Muitas metodologias são adaptadas sem um estudo mais
detalhado da influência da massa do derivado imobilizado no rendimento
reacional. Neste trabalho serão realizados estudos para tentar minimizar a
massa do catalisador na reação específica de monooleato de xilitol, com
objetivo de tornar esta metodologia mais viável economicamente.
MATERIAL E MÉTODOS: Todos os experimentos foram realizados com a lipase de Penicillium
camembertii (Lipase G), imobilizada em um suporte híbrido POS-PVA
(polissiloxano-álcool polivinílico) pela técnica sol-gel, como proposto na
metodologia descrita na literatura (SANTOS et al, 2008). Outros reagentes
utilizados foram xilitol (Sigma-Aldrich), ácido oleico (Reagen), acetona
(Synth), epicloridrina (Sigma), hexano (Cromolime), éter de petróleo (Reagen),
hidróxido de potássio (Merck), ácido polivinílico (Acrós), t-butanol e
tetraetilortosilicato (Sigma-Aldrich). Para melhor solubilidade do xilitol em
meio orgânico e maior seletividade na preparação do seu respectivo monoéster,
foi realizada uma reação de proteção de quatro das cinco hidroxilas do açúcar,
conforme metodologia estabelecida em trabalhos anteriores (RUFINO et al,
2009). As reações para obtenção do monooleato de xilitol foram realizadas
estabelecendo-se uma razão molar 1:4 de xilitol protegido/ácido oleico, 10 mL
de t-butanol como solvente e variação mássica do derivado imobilizado. O
progresso da síntese foi acompanhado pela variação da relação das áreas ácido
oléico/Decano, das amostras retiradas no decorrer das reações, obtidas por
cromatografia em fase gasosa, utilizando-se um cromatógrafo Varian modelo CP
3380, coluna capilar CP-Sil8CB. O produto final foi caracterizado por IR e
RMN. As reações foram realizadas utilizando-se entre 100 e 500mg de derivado
imobilizado, com variações de 100mg.
RESULTADOS E DISCUSSÃO: O efeito da porcentagem mássica de lipase no meio reacional no rendimento de
esterificação foi determinado em reações realizadas a 50 ºC, com razão molar
de 1:4 (protegido/ácido graxo) partindo-se de 70mM de xilitol protegido. Os
resultados obtidos são apresentados na Figura 1 e Tabela A. Na Figura 1
verifica-se um aumento significativo do rendimento de esterificação com o
aumento da massa de derivado imobilizado, até atingir a massa equivalente a
400mg. A partir desta condição não ocorreram variações significativas no
rendimento de esterificação, ficando então estabelecido que uma massa superior
à 400mg, para esta reação específica, seria considerado um aumento
desnecessário de custo do processo. Cabe ressaltar que reações similares, com
outros substratos, foram utilizadas quantidades iguais ou superiores à 500mg
de derivado imobilizado.
Tabela A
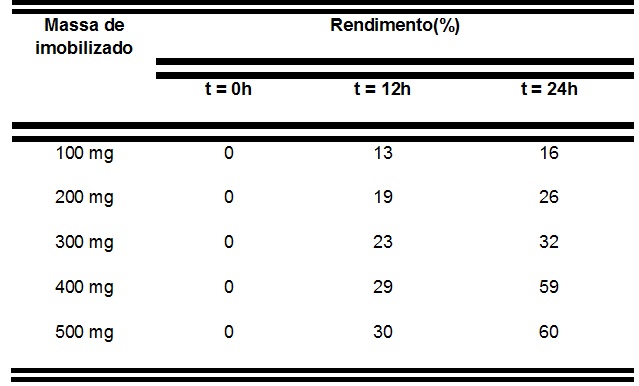
Rendimento da reação em função do tempo e massa de
catalisador.
Figura 1

Influência da massa de catalisador no rendimento
de esterificação em função do tempo.
CONCLUSÕES: Neste trabalho foi possível observar que, sempre que são realizadas adaptações
de metodologias na catálise enzimática, é importante que sejam realizados testes
para verificar a quantidade adequada de enzima para a reação específica,
evitando desta forma o encarecimento desnecessário do processo.
AGRADECIMENTOS: FAPERJ
REFERÊNCIAS BIBLIOGRÁFICA: ADNANI, A. ; BASRI, M. ; CHAIBAKHSH, N. ; AHANGAR, H.A. ; SALLEH, A.B. ; RAHMAN, R.N.Z.R.A. ; RAHMAN, M.B.A. Chemometric analysis of lipase-catalyzed synthesis of xylitol esters in a solvent-free system. Carbohydrate Research 346, 472–479 , 2011.
ADNANI, A. ; BASRI, M. ; MALEK, E.A. ; SALLEH, A.B. ; RAHMAN, M.B.A. ; CHAIBAKHSH, N. ; RAHMAN, R.N.Z.R.A. . Optimization of lipase-catalyzed synthesis of xylitol ester by Taguchi robust design method. Industrial Crops and Products 31 , 350–356, 2010.
DA SILVA, F. M. ; DE LACERDA, P.S. B. ; JUNIOR, J. J. DESENVOLVIMENTO SUSTENTÁVEL E QUÍMICA VERDE. Quim. Nova, Vol. 28, No. 1, 103-110, 2005.
MENDES, A.A. ; FREITAS, L. ; DE CARVALHO, A.K. ; DE OLIVEIRA, P.C. ; DE CASTRO, H.F. Immobilization of a Commercial Lipase from Penicillium camembertii (Lipase G) Different Strategies. Enzyme Research, Volume 2011, Article ID 967239, 8 pages, 2011.
NITSCHKE, M.; PASTORE, G.M. Biossurfatantes: propriedades aplicações. Química Nova, nº 25, 772-776, 2002.
RUFINO, A. R.; BIAGGIO, F. C.; SANTOS, J. C.; CASTRO H. F. Chemoenzymatic synthesis: a strategy to obtain xylitol monoesters. Journal of Chemical Technology and Biotechnology, nº 84, 957-960, 2009.
SANTOS, J. C.; PAULA, A. V.; NUNES, G. F. M.; DE CASTRO, H. F. Pseudomonas fluorescents lipase immobilization on polysiloxane-polyvinyl alcohol composite chemically modified with epichlorohydrin. Journal of Molecular Catalysis. B Enzymatic, nº 52-53, 49-57, 2008.
