Realizado em Vitória/ES, de 09 a 11 de Setembro de 2015.
ISBN: ISBN 978-85-85905-13-2
TÍTULO: Caracterização bioquímica de lipase produzida por Geotrichum sp. a partir de resíduos gordurosos domésticos
AUTORES: Degang, L. (IFSC) ; Serpa, G. (IFSC)
RESUMO: O presente trabalho teve como objetivo caracterizar bioquimicamente a lipase
produzida por Geotrichum sp. isolado de resíduos gordurosos domésticos. Foram
avaliados os efeitos causados na atividade enzimática devido à variações de
pH, presença de íons metálicos no meio reacional e cinética enzimática em
diferentes concentração de substrato para determinação de Km e Vmáx da enzima.
As análises foram realizadas visando a compreensão sobre a estabilidade da
enzima no meio reacional, a otimização de condições de processo para melhor
eficiência da atividade enzimática, além das constantes cinéticas.
PALAVRAS CHAVES: Geotrichum sp.; lipases; atividade enzimática
INTRODUÇÃO: As lipases (triacilglicerol-acil-hidrolases) têm despertado interesse das
indústrias por seu alto potencial, atuando em ligações éster-carboxílicas,
esterificação, interesterificação e transesterificação na interface organo-
aquosa, com aplicação nas industrias de laticínios, processamento de carnes,
tratamento de resíduos, química fina, entre outras (NAGARAJAN, 2012).
Fisiologicamente, as lipases têm catalisam a hidrólise do triacilglicerol
para a produção de ácidos graxos livres de cadeia longa, glicerol,
diglicerídios e monoglicerídios (COLLA, et. al. 2012). As lipases podem ser
encontradas facilmente na natureza, sendo de origem animal, vegetal ou
microbiana. Esta última é considerada a melhor fonte para a produção desta
enzima, pois possui uma fácil produção em massa, baixo custo de produção, a
especificidade da enzima e a versatilidade de suas propriedades. Dentre os
diversos grupos microbianos, os fungos filamentosos são excepcionais
produtores de lipase. E, esta enzima de origem fúngica, é a mais requerida
para a produção industrial. (ROVEDA et al., 2010). As enzimas possuem
atividade catalítica altamente especializada e influenciada por diversos
fatores ambientais e de processo. Para o estudo e caracterização das
enzimas, devem ser considerados diversos fatores e influências. Diante
destes aspectos, o presente trabalho tem como objetivo fazer uma
caracterização bioquímica das lipases, produzidas pelo fungo Geotrichum sp
(GUESSER et al. 2014), determinando-se condições de pH, verificar a
existência de interferência de íons metálicos na atividade enzimática e o
efeito da concentração de substrato na atividade enzimática para
determinação da constante de Michaelis-Menten (Km) e velocidade Máxima de
reação (Vmax), conforme PASTORE et al, 2003 e PADILHA, 2010.
MATERIAL E MÉTODOS: A caracterização bioquímica da lipase foi dividida em 3 partes: efeito do
pH, dos íons metálicos e da concentração do substrato, em relação à
atividade enzimática (PASTORE et al.,2003; PADILHA, 2010). Em 50mL de caldo
peptonado (50 g/L), contendo 1 g/L de MgSO4 e NaNO3 e uma emulsão de óleo de
oliva com Triton-X 5% (v/v), pipetou-se 1mL de uma suspensão de esporos do
fungo Geotrichum sp. O meio foi incubado por 48h, à 35ºC e 120rpm.
Centrifugou-se o meio a 3000 rpm por 10 min para separação do extrato
enzimático bruto, que foi utilizado na determinação da atividade enzimática.
A atividade foi determinada em um meio reacional contendo 4 mL de tampão
fosfato (50mM) pH 6,0, 1g de óleo de oliva emulsificado com Triton-X 5%
(v/v) e 1mL do extrato enzimático bruto, incubado por 1h, à 30ºC, sob
agitação de 120 rpm. Após o tempo de reação, foram adicionados 15mL de uma
solução álcool/acetona 1:1 (v/v) para parar a reação. A determinação da
atividade enzimática foi feita pelo método titulométrico de neutralização
utilizando KOH (50mM) padronizado. Para a caracterização bioquímica da
lipase, alterou-se as variáveis do meio reacional em análises diferenciadas.
Para análise do efeito pH, utilizou-se tampão fosfato a 50mM, nos pHs 5 a
9. Para avaliar a influência dos íons metálicos, o extrato enzimático bruto
foi armazenado por 30 dias na presença de dez diferentes íons metálicos (0,3
mM) a 4ºC. A atividade foi determinada no início e após 30 dias de
incubação. Para o estudo cinético utilizou-se diferentes concentrações de
substrato (óleo de oliva, 0,1 g/mL a 0,5 g/mL), no meio reacional. As
análises das atividades obtidas em cada experimento foram analisadas com
teste t Student para níveis de significância de 90 ou 95%, conforme o caso.
RESULTADOS E DISCUSSÃO: Verificou-se que em pH 7,0 a lipase atinge uma atividade ótima (Figura 1).
Sendo este o pH indicado para a realização de todas as análises de atividade
enzimática. O estudo do efeito dos íons bivalentes Ca e Mg observa-se que na
presença de MgSO4 10mM, a atividade enzimática aumenta em relação ao
controle (p < 0,1), já no meio contendo CaCl2 10mM há um decréscimo mais
significativo na atividade enzimática (p < 0,05). Os demais experimentos não
apresentaram diferença significativa. O extrato enzimático bruto foi
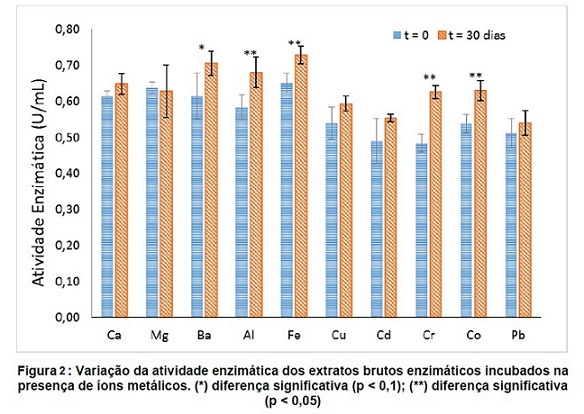
armazenado por 30 dias na presença de diferentes íons metálicos obtendo
resultados obtidos para a atividade enzimática da lipase no início e no
final do período de armazenamento (Figura 2). Na presença dos íons de Al,
Fe, Cr e Co houve uma diferença significativa da atividade enzimática no
início e no final do tempo de armazenamento (p < 0,05). A permanência na
presença do íon de Ba também levou a um aumento significativo da atividade
(p < 0,1). Os demais metais não afetaram de forma significativa a atividade
enzimática da lipase entre o início e o fim do armazenamento. Os metais de
transição e alcalinos terrosos podem formar complexos coordenados estáveis
com os resíduos de aminoácidos que compõem as enzimas. Quando complexados,
os metais podem alterar a estrutura terciária da enzima atuando como
inibidores ou ativadores da enzima (MOURA et al. 2014). O estudo cinético da
hidrólise do óleo de oliva catalisada pela lipase de Geotrichum sp. foi
realizado variando-se a concentração do substrato no meio reacional. Os
dados mostram a influência da emulsão óleo e água contendo diferentes
proporções de azeite de oliva (0,1 a 0,5 g/mL) na velocidade de hidrólise
pela lipase, com os quais calculou-se os valores de Km e Vmáx de 5,43 g/mL e
0,6387 U/mL, respectivamente.

CONCLUSÕES: A enzima atinge a sua atividade máxima em pH 7,0. A avaliação da interferência
dos íons metálicos indicou uma diferença significativa na atividade da enzima
para os íons de Al, Fe, Cr e Co (p < 0,05) e Ba (p < 0,1). Na análise
utilizando íons de Ca e Mg, constatou-se que houve diferença significativa na
concentração de 10 mM para o íon de Ca (p < 0,05) e para o íon de Mg (p <
0,1). O estudo cinético indicou um Vmáx igual a 0,639 U/mL e Km igual a 5,43
g/mL. Os valores encontrados podem referenciar futuras aplicações comerciais
desta lipase, já que indicam o meio reacional ideal.
AGRADECIMENTOS: Os autores agradecem ao CNPq pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: PADILHA, G. S. Caracterização, purificação e encapsulamento de lipase de Burkholderia cepacia. Tese de doutorado; Curso de Pós-Graduação em Engenharia Química; Universidade Estadual de Campinas, 2010.
PASTORE, Gláucia M.; COSTA, Vinicius dos Santos R. da; KOBLITZ, Maria Gabriela B.; Purificação parcial e caracterização bioquímica de lipase extracelular produzida por nova linhagem de Rhizopus sp. Ciência e Tecnologia de Alimentos. Campinas, p. 135-140, 2003.
COLLA, L. M.; REINEHR, C. O.; COSTA, J. A. V. Aplicações e produções de lipases microbianas. Revista de Ciências Exatas Aplicadas e Tecnológicas da Universidade de Passo Fundo - CIATEC-UPF, vol. 4 (2), p.p 1-14, 2012.
MOURA, J. J. G.; PAULETA, S. F.; MAIA, L. B. Química de coordenação e Biologia: Controlo da actividade enzimática por alteração da coordenação de centros metálicos catalíticos. Química – SPQ, II, n. 132, 2014.
GUESSER, J. V. C.; SERPA, G. Isolamento de micro-organismos com potencial uso para a produção de lipases a partir de resíduos gordurosos domésticos. In Encontro Nacional de Tecnologia Química, 7, 2014. Vitória, ES. Anais.
ROVEDA, Mirela; HEMKEMEIER, Marcelo; COLLA, Luciane Maria. Avaliação da produção de lipases por diferentes cepas de micro-organismos isolados em efluentes de laticínios por fermentação submersa. Ciência e Tecnologia de Alimentos. Campinas, p. 126-131, 2010.
NAGARAJAN, S. New tools for exploring “old friends-microbial lipases”. Applied biochemistry and biotechnology, v. 168, n. 5, p. 1163–96, nov. 2012.
