Realizado em Maceió/AL, de 28 a 30 de Agosto de 2013.
ISBN: 978-85-85905-04-0
TÍTULO: Avaliação da Equivalência Farmacêutica Através de Perfil de Dissolução em Comprimidos de Paracetamol
AUTORES: Boff, P. (UNIVERSIDADE DE PASSO FUNDO) ; Rodrigues, A. (UNIVERSIDADE DE PASSO FUNDO) ; Ortiz, J. (UNIVERSIDADE DE PASSO FUNDO) ; Bertol, C. (UNIVERSIDADE DE PASSO FUNDO)
RESUMO: O paracetamol é um medicamento muito utilizado pela população devido as suas
indicações contra dor e febre (analgésico e antipirético), porém, quando esse
medicamento não possui qualidade garantida pode provocar efeitos prejudiciais à
saúde de quem o consome. Em vista disso, o presente trabalho teve como objetivo
avaliar a qualidade de comprimidos de paracetamol 750 mg nos grupos de
referência, genéricos e similares a fim de verificar se esses cumprem com as
especificações descritas na Farmacopeia Brasileira 5° edição de 2010 e na ANVISA
RDC n° 31/2010. Realizaram-se vários teste de controle de qualidade nos três
grupos de medicamentos e posteriormente efetuo-se o perfil de dissolução para
avaliar a equivalência farmacêutica entre os grupos.
PALAVRAS CHAVES: Paracetamol; qualidade; Perfil de dissolução
INTRODUÇÃO: O paracetamol, um medicamento derivados da acetanilida, foi introduzido em 1893
e desde então, vem sendo muito utilizado devido as suas indicações contra dor e
febre, porém, quando esse medicamento não possui qualidade garantida pode
provocar efeitos prejudiciais à saúde de quem o consome e somando-se a isso há o
fato de que o medicamento pode ser adquirido sem a necessidade de prescrição
médica sujeitando o paciente a posologias incorretas. Ainda, ao procurar um
medicamento, o consumidor depara-se com, pelo menos, três opções diferentes
podendo ser, medicamentos de referência, genéricos e similares. Por possuírem
preços, marcas e laboratórios distintos surge a duvida se tais produtos possuem
a mesma qualidade, o que os diferencia é que o de referência são os inovadores
que possuem qualidade, eficácia e segurança comprovada cientificamente. Os
genéricos, por sua vez, são geralmente produzidos após a expiração da proteção
patentária do medicamento de referência, não possuem marca somente denominação
química. Já, o medicamento similar contém o mesmo princípio ativo, apresentando
a mesma concentração que é equivalente ao medicamento de referência, esse é
identificado por nome comercial ou marca e é, por vezes, o mais acessível
economicamente (BRASIL, 2003). O perfil de dissolução permite avaliar a
equivalência farmacêutica entre os medicamentos, sendo que essa requer esses
possuam mesma forma farmacêutica, via de administração e quantidade da mesma
substância ativa, devendo liberar quantidades iguais em um mesmo intervalo
posológico (BRASIL, 2010b). Portanto, com essa avaliação pode-se saber se o
efeito ao tomar o medicamento de um grupo ou de outro propiciará o mesmo efeito,
independente de laboratório produtor, marca ou custo.
MATERIAL E MÉTODOS: Para realização do perfil de dissolução utilizaram-se cinco comprimidos de cada
grupo, que foram colocados no dissolutor, como meio de dissolução usou-se 900 mL
de solução tampão fosfato pH 5,8 mantida a uma temperatura de 37 ºC, o
procedimento foi realizado utilizando o método de pás com agitação constante de
50 rpm por 30 minutos, onde retiraram-se alíquotas nos tempos de 5, 10, 15, 20 e
30 minutos. Após fez-se a leitura das amostras em espectrofotômetro no
comprimento de onda de 243 ηm e dos cinco pontos da curva analítica de
concentração 5, 10, 15, 20 e 25 µg/mL de paracetamol padrão secundário, ajustou-
se o zero com solução tampão fosfato pH 5,8. Para avaliar o perfil de dissolução
aplicou-se o método Modelo Independente Simples que emprega o Fator de
Semelhança (F2) e Fator de Diferença (F1) (BRASIL, 2010b).
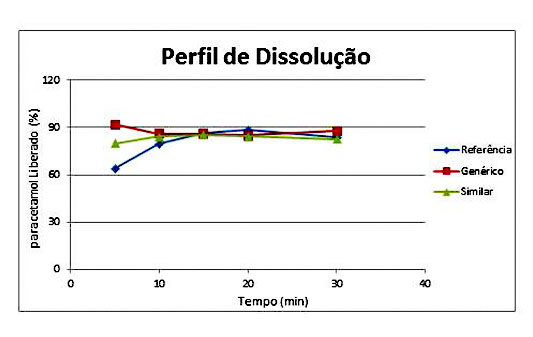
RESULTADOS E DISCUSSÃO: O perfil de dissolução permitiu determinar a equivalência farmacêutica entre os
comprimidos dos lotes analisados, essa foi calculada utilizando o percentual de
dissolução dos comprimidos de cada grupo frente ao percentual de dissolução dos
comprimidos de referência. A Figura 01 apresenta o percentual do paracetamol
liberado em relação ao tempo em minutos. Os comprimidos do grupo genérico
apresentaram o valor de F1 8,39 e F2 70,5 e os do grupo similar tiveram F1 3,55 e
F2 86,3 ambos calculados frente ao grupo de referência. Segundo ANVISA RDC n°
31/2010 para que os lotes sejam equivalentes farmacêuticos devem apresentar o
valor de F1 entre 0 a 15 e F2 entre 50 a 100, sendo assim, foram aprovados no
teste.
Figura 01: Perfil de dissolução.
CONCLUSÕES: A equivalência farmacêutica entre os medicamentos requer que esses contenham mesma
substância ativa, na mesma dosagem e forma farmacêutica, devendo liberar
quantidades iguais dessa substância em um mesmo intervalo posológico. Portanto,
concluiu-se que para esses lotes analisados, ao que se refere ao parâmetro
avaliado, o consumidor poderá escolher sobre qual das especialidades comprar
independente da marca, laboratório produtor ou custo do produto, com a certeza de
que os efeitos serão os mesmos para qualquer um dos lotes adquiridos.
AGRADECIMENTOS: A prof.ª Msc. Janaína Ortiz, a prof.ª Msc. Charise Bertol e a prof.ª Msc. Clóvia
M. Mistura pelas orientações e conhecimentos repassados.
REFERÊNCIAS BIBLIOGRÁFICA: BRASIL. Farmacopeia Brasileira. Brasília. Vol. 2. 5° ed. Fiocruz. 2010a. Disponível em: <http://www.anvisa.gov.br/hotsite/cd_farmacopeia/index.htm>. Acesso em 18 de maio de 2013.
BRASIL. Resolução Da Diretoria Colegiada – RDC n° 31, DE 11 DE AGOSTO DE 2010b. ANVISA. Disponível em: <http://portal.anvisa.gov.br/wps/wcm/connect/e7a4dd0047fe1949bc35be9f306e0947/RESOLU%C3%87%C3%83O-RDC+31,+DE+04.07.11.pdf?MOD=AJPERES>. Acessada em 06 de jul. de 2013.
BRASIL. Resolução Da Diretoria Colegiada – RDC n° 135 DE 29 DE MAIO DE 2003. ANVISA.Disponível em: <http://www.mpba.mp.br/atuacao/ceacon/legislacao/farmacia/nova_resolucao_ANVISA.pdf> Acessado em 06 de jul. de 2013.
