TÍTULO: ENRIQUECIMENTO PROTÉICO DA ALGAROBA
(Prosopis juliflora) UTILIZANDO Saccharomyces cerevisiae.
AUTORES: Rabelo, T. (UFAL) ; França, F. (UFRJ) ; Vasconcelos, J. (UFAL) ; Lima, T. (UFAL) ; Gomes, E. (UFAL)
RESUMO:O processo de enriquecimento protéico da Algaroba utilizando Saccharomyces
cerevisiae, tem como principal característica otimizar técnicas as condições da
região semi-árida, para a produção de fonte alimentar rica em proteínas.
Contribuindo para minimizar a carência alimentar na época crítica do ano e/ou
viabilizando no período onde os índices pluviométricos estão normalizados, pois há
um alto grau de desperdício. Foram utilizados diferentes quantidades de matéria
prima (47, 94 e 141 g), e concentração celular próximo a 1,0 x106, pH 7,0 e 0,3%
de extrato de lêvedo. O resultado de enriquecimento protéico da Algaroba mais
significativo foi obtido com 96 h de fermentação e 47g de matéria prima.
PALAVRAS CHAVES: ALGAROBA; ENRIQUECIMENTO PROTÉICO; SACCHAROMYCES CEREVISIAE
INTRODUÇÃO:Com o crescimento populacional, há necessidade de suprir a demanda por
alimentos, buscando-se novas alternativas viáveis, para produção destes e outros
produtos de valor comercial reconhecido. Os recursos regionais disponíveis no
semi-árido, propiciam o desenvolvimento de estudos para consolidação do
aproveitamento integral destes.
A algarobeira é um vegetal adaptado às condições climáticas do semi-árido
nordestino e possui grande potencial de produção de frutos que, se explorados
adequadamente, poderão ser transformados em produtos de alto valor agregado.
(www.ct.ufpb.br, 2009). Entretanto no período de índices pluviométricos
normalizados, há alta produção de vagens, sendo dessa forma fonte de
desperdício, chegando a ser considerada como uma “peste” em determinadas
regiões.
A alimentação racional dos ruminantes visa fornecer os nutrientes capazes de
manter e assegurar as exigências de sua manutenção e o nível de produção
pretendido. O sucesso da qualidade da carne e a exploração leiteira lucrativa se
tornam possíveis, quando se trabalha com as condições alimentares adequadas, que
permitem altas produções a custos mais econômicos. Isto se torna possível,
principalmente, por intermédio de um manejo nutricional, reprodutivo e sanitário
adequado (ARAÚJO et al., 2007).
O enriquecimento protéico de produtos naturais por bioprocesso em meio semi-
sólido, permite obter ração animal com valor nutritivo adequado. A
diversificação de substratos utilizáveis na fermentação semi-sólida, incluindo
resíduos agrícolas e industriais, contribui também para minimizar os problemas
de poluição no meio ambiente (CAMPOS, 2003).
A produção de alimentos de origem animal, rico em proteínas, vitaminas, e
minerais, pode minimizar a carência alimentar em época crítica do ano (CAMPOS,
2005).
MATERIAL E MÉTODOS:As vagens foram colocadas durante 24hs em estufa a 80°C, após o tempo
estabelecido, as vagens foram trituradas em liquidificador industrial. Foi
utilizada linhagem de Saccharomyces cerevisiae provenientes Usina Triunfo
(UTRI), cedida pelo Laboratório de Genética e Microbiologia Aplicada, do
Instituto de Ciências Biológicas e da Saúde – ICBS/UFAL.
Os experimentos foram conduzidos em bandejas de PVC medindo 10 x 17,5 cm e
altura de 4,3 cm. A distribuição de matéria - prima no reator foi feita
utilizando 47, 94 e 141 g; mesma concentração celular (106 UFC/mL), pH 7,0 e
0,30% de extrato de levaduras. Para preparação do inóculo, transferiu-se uma
alçada de levedura conservada em meio de cultura sólido, para 100mL de meio YEPD
contido em Erlenmeyer de 500mL. Após inoculação, o Erlenmeyer foi colocado na
Incubadora Refrigerada com Agitação Orbital (Shaker) durante 24 hs. Após esse
tempo, o meio apresentou aproximadamente 106 leveduras vivas/mL. Utilizou-se
100mL desse cultivo para da algaroba triturada.
Durante o processo fermentativo foram retiradas amostras com 0, 24, 48, 72 e 96
h, para as determinações analíticas.
DETERMINAÇÕES ANALÍTICAS
Viabilidade celular, observou-se a morfologia celular, segundo Antonini, 2004. A
determinação dos Açúcares Redutores Totais (ART) foi feita pelo método
volumétrico de Lane e Eynon (1950). Para determinar a umidade utilizou-se
método AOAC, 1992. A quantificação celular através da contagem de unidades
formadoras de colônia (UFC), foram realizadas cultivando-se os microrgansimos em
placas de Petri contendo o Meio YEPD (MARTINS, 1998), para determinação do pH,
utilizou-se o método potenciométrico, realizado com pHmetro digital. A proteína
bruta foi determinada com base no conteúdo de nitrogênio total, pelo método de
Kjeldhal(AOAC, 2005)
RESULTADOS E DISCUSSÃO:1.Cinética do Crescimento Microbiano.
A Figura 1 evidencia que, no experimento 1, houve crescimento considerável de 0
a 48 horas, estabilizando-se nesse patamar até as 96 horas de fermentação,
obtendo-se valor máximo de 1,84x107ufc/mL (concentração celular inicial de 1,96
x106). No experimento 2 houve crescimento gradativo até 96 horas, apresentando
concentração microbiana máxima de 1,14 x107ufc/mL (concentração celular inicial
de 1,60 x106ufc/mL). No experimento 3, a fermentação se iniciou com
3,55x106ufc/mL e a maior concentração celular foi obtida com 72 horas (1,38
x107ufc/mL); após esse tempo, houve declínio do crescimento.
2.Teor de Proteína
Na Figura 2, em todos os experimentos houve aumento de proteína bruta,
continuamente até 96 horas. Ocorreu acentuadamente nos experimentos 1 e 3,
principamente entre 48 horas e o final da fermentação (96 horas). No experimento
2, esse crescimento significante ocorreu até 72 horas, quando houve declínio,
tendendo à estabilização.
Observa-se que nos experimentos 1, 2 e 3 os valores máximos de proteína bruta
são de 13,45%, 11,77% e 11,21%, respectivamente (aumentos de 1,3, 1,9 e 2,6
vezes em relação ao valor inicial, após 96 horas de fermentação).
Franco et al (2010), utilizando Aspergillus niger e resíduos de goiaba que no
inicio da fermentação tinham 6,43% de Proteína Bruta, após 168 horas de
fermentação obtiveram 11,38% (acréscimo de 1,7 vez), valor próximos ao que foi
obtido pelos autores com outros resíduos. Estes valores são próximos aos que
foram obtidos no experimento 2.
Segundo Cangassu (2003), a determinação das condições ótimas de temperatura, pH
e oxigênio auxiliam no melhor entendimento da fisiologia microbiana, gerando
aumentos na produção de substâncias de interesse industrial como biomassa
microbiana.
Figura 1
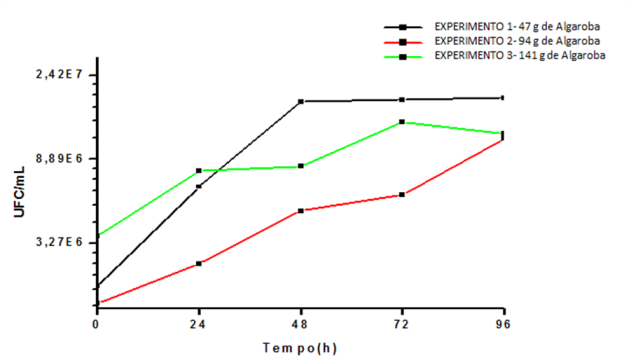
Unidades formadoras de colônias (UFC/mL), durante o
processo fermentativo
Figura 2
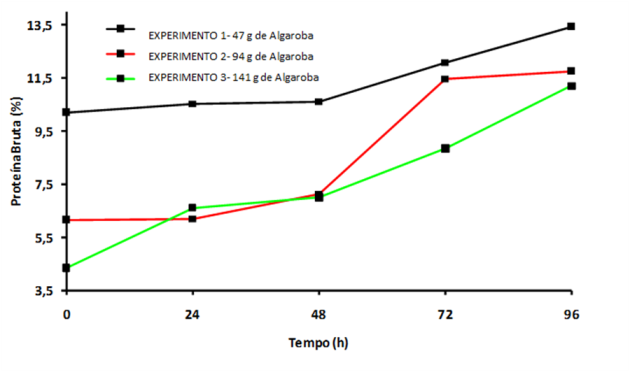
Variação do conteúdo de proteina bruta no decorrer
do processo fermentativo
CONCLUSÕES:•Conseguiu-se um produto com 17% de proteína.
•Os melhores resultados para enriquecimento protéico da algaroba foram para o
tempo de processo de 96 horas, usando-se 47g de matéria prima/reator, 0,30% de
extrato de lêvedo e pH de 7,0.
AGRADECIMENTOS: A DEUS!
REFERÊNCIAS BIBLIOGRÁFICA:ANTONINI, S.R.C.; Métodos de análises e monitoramento microbiológico em laboratório de destilaria, Universidade Federal de São Carlos, Centro de Ciências Agrárias – Campus de Araras, Dept°. Tecnologia Agroindustrial e Sócio-Economia Rural,2004
AOAC - Official methods of analysis of the Association Analytical Chemists. 18.ed. Gaithersburg, Maryland, 2005.
ARAÚJO, L. F; BRITO, E. A; NETO, M. B.; OLIVEIRA, S.; SANTOS, E. S; Bioconversão da Palma Forrageira, Tecnologia & Ciências Agropecuária, João Pessoa, v.1, n.1, p.59-61, set. 2007.
CAMPOS,, A. R. N.; SANTANA, R. A. C.; DANTAS, J. P.; OLIVEIRA, S. C.; SILVA, F. L. H.; Enriquecimento protéico do bagaço do pendúnculo de caju por cultivo semi-sólido, Revista de Biologia e Ciências da Terra, v.5, n.2, p. 50-54, set 2005.
CAMPOS, A. R. N.; Enriquecimento protéico do bagaço do pedúnculo de caju (Anarcadium occidentale L.) por fermentação semi-sólida. Campina Grande, Paraíba, 87p. (Dissertação) - Universidade Federal de Campina Grande, 2003.
CANGUSSU, A.S.R.; Cinética de crescimento e metabolismo de levedura potencialmente probiótica; Dissertação(Mestrado); Universidade Federal de Viçosa, 2003.
FRANCO, M.; SANTOS, T.C.; GOMES, P.P.; ABREU FILHO, G.; Enriquecimento protéico dos resíduos sólidos do processamento de frutas; ENCICLOPÉDIA BIOSFERA, Centro Científico Conhecer - Goiânia, v.6, N.11; 2010.
MARTINS, C. V. B.; HORII, J.; PIZZIRANI-KLEINER, A. A.; Fusão de protoplastos de Saccharomyces cerevisiae avaliada por floculação e produção de H2S. Sci. Agric. Vol. 55, Nº 1, Piracicaba, jan/apr 1998.
www.ct.ufpb.br, 2009
