TÍTULO: APLICAÇÃO DOS PROCESSOS FENTON, ELETROQUÍMICO E ELETRO-FENTON NA DEGRADAÇÃO DE CORANTES.
AUTORES: Silva, L. (UFAL) ; Tavares, M. (UFAL) ; Zanta, C. (UFAL) ; Tonholo, J. (UFAL) ; Soares, W.M.G. ()
RESUMO:Em função da crescente preocupação com o meio ambiente, várias tecnologias estão
sendo desenvolvidas, visando minimizar o impacto gerado sobre os recursos
hídricos. Dentre as novas tecnologias a reação de Fenton tem se destacado em
função dos reagentes (H2O2 e Fe2+) apresentarem baixa toxidade, baixo custo e
alta eficiência para a mineralização da maioria dos compostos orgânicos
poluentes. A associação da tecnologia eletroquímica à reação de Fenton torna o
processo ainda mais promissor, pois tem-se a possibilidade de co-geração do
radical hidroxila. No entanto nesse estudo os processos associados apresentaram
menor eficiência que os processos individuais para degradação do corante devido
a reações paralelas e a formação de material polimérico bloqueando os sítios
ativos do eletrodo.
PALAVRAS CHAVES: Fenton; Eletro-fenton; Corantes
INTRODUÇÃO:Embora as diferenças tecnológicas entre as pequenas e grandes indústrias sejam
bastante significativas, todas tem em comum a particularidade de utilizar
grandes quantidades de água. Este fato, associado ao baixo aproveitamento dos
insumos (corantes, detergentes, engomantes, amaciantes, etc.), faz com que as
indústrias sejam responsáveis pela geração de grandes volumes de resíduos, com
elevada carga orgânica e forte coloração (KUNZ et al., 2002).
Neste contexto, a reação de Fenton tem atraído grande interesse tanto da
comunidade científica como industrial, como um meio de tratamento de efluentes
contendo corantes (SALVADOR et al., 2012). O mecanismo clássico da reação de
Fenton é uma simples reação redox, na qual os íons de Fe(II) são oxidados a
Fe(III) e o peróxido de hidrogênio H2O2 é reduzido a um íon hidroxilo e um
radical hidroxila. (PIGNATELLO et al., 2006). O radical hidroxila é um forte
agente oxidante capaz de mineralizar compostos poluentes.
Outra tecnologia promissora é a eletroquímica, onde o agente oxidante é gerado
através de processos eletroquímicos.
No processo eletro-Fenton (EF), onde as reações ocorrem simultaneamente, o
radical OH passa a ser produzido em todo o meio e não apenas no ânodo
proporcionando ao processo eletro-Fenton um poder oxidativo mais elevado do que
a oxidação anódica. No processo eletro-Fenton, a regeneração do íon ferroso é
sensivelmente aumentada em relação ao reativo de Fenton, pois, além da
regeneração química, o íon ferroso pode ser regenerado eletroquimicamente.
(OTURAN e BRILLAS, 2007)
Este trabalho tem como objetivo avaliar e comparar a eficiência da reação de
Fenton e dos processos eletroquímico e eletro-Fenton no tratamento de um
efluente sintético contendo corante.
MATERIAL E MÉTODOS:A eficiência da reação de Fenton foi estudada variando-se as concentrações do
Fe2+ e do peróxido de hidrogênio em: 0,10; 0,25 e 0,50 mM e 5, 10 e 20 ppm,
respectivamente, para o tratamento de 250 ml da solução contendo 50 ppm do
corante azul, benzeno de metatitânio.
Nos processos eletroquímicos foram empregados eletrodos de ADE® comercial
(Ti/Ru0,3Ti0,7O2) como anodos e cátodo onde avaliou-se o efeito da corrente
aplicada variando-se a densidade de 20, 40 e 60 mA cm-2.
Determinada as condições otimizadas de cada metodologia avaliou-se a eficiência
das duas tecnologias associadas. Nesse estudo as concentrações do Fe2+ e do
peróxido de hidrogênio foram 0.5 mmol/L e 20 ppm, respectivamente, e aplicou-se
a densidade de corrente de 60 mA cm-2.
Amostras do efluente foram coletadas durante as reações e a eficiência dos
processos foi avaliada através de redução da concentração do corante analisada
por espectroscopia de absorção em 625nm.
RESULTADOS E DISCUSSÃO:Na reação de Fenton foi observada a melhor condição experimental, às
concentrações de 0,5mM de Fe2+ em 10 ppm de H2O2, onde obteve-se a redução de
97% da concentração do corante, em 1 hora de reação.
Para o processo eletroquímico a melhor eficiência foi obtida aplicando-se a
corrente de 60mA cm-2 onde obteve a redução de 87% da coloração após 3h de
reação.
Aplicando-se as duas condições otimizadas, ou seja, a densidade de 60 mA cm-2 e
as seguintes condições: 0,5mM de Fe2+ em 10 ppm de H2O2, realizou-se o processo
de EF. O processo EF apresentou eficiência inferior aos processos individuais
(Fig.1), essa redução da eficiência pode ser associada à geração de uma elevada
concentração de radicais hidroxila que beneficia a ocorrência de reações
paralelas que competem com a reação de degradação do corante e geram espécies
•HO2 com menor poder oxidante. Outra possibilidade é a abstração de algum
reagente de Fenton pelo processo eletroquímico. De fato, a adição de Fe2+ levou
a uma discreta redução da eficiência do processo eletroquímico (Fig. 2),
possivelmente devido à eletrodeposição do Fe2+ ou Fe3+ sobre o cátodo diminuindo
a concentração de ferro livre para a reação de Fenton.
Em paralelo, durante a reação de EF, foi observada a deposição de um material
polimérico de coloração alaranjada sob o ADE anódico, o que justifica a redução
significativa da eficiência do processo eletro-Feton, devido a bloqueio dos
sítios ativos do eletrodo.
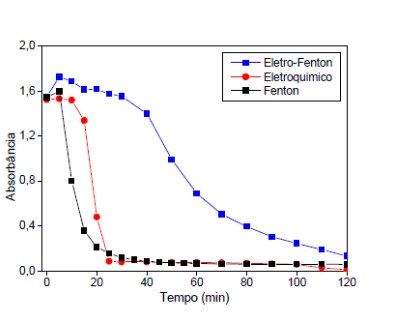
Figura 1- Absorbância da solução em função do tempo
de reação. Comparação das três técnicas na
degradação do corante modelo.
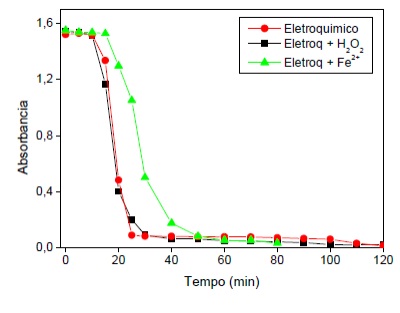
Figura 2- Absorbância da solução em função do tempo
de reação. Processo eletroquímico na presença de
ferro e peróxido de hidrogênio.
CONCLUSÕES:Os dados obtidos indicam menor eficiência da reação de Eletro-Fenton na degradação
do corante, possivelmente devido a formação de material polimérico sob o ânodo
diminuindo os sítios ativos, e devido a reações paralelas que abstrai o radical
peróxido e gera a espécie HO2• que apresenta menor poder de oxidação que o OH•.
Os resultados indicam que a reação de Eletro-Fenton pode ser otimizada, diminuindo
os reagentes de Fenton ou a densidade de corrente aplicada, reduzindo o custo
operacional e conseqüentemente ampliando a aplicabilidade do processo em escala
industrial.
AGRADECIMENTOS: Os autores agradecem a Deus e ao CNPq, FAPEAL e UFAL pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA:KUNZ, A.; PERALTA-ZAMORA, P.; DE MORAES, S. G.; DURAN, N. New tendencies on textile effluent treatment. Química Nova, v. 25, n.1, p.78-82, 2002.
OTURAN, M. A., BRILLAS, E., 2007, “Electrochemical Advanced Oxidation Processes (EAOPs) for Environmental Applications”, Portugaliae Electrochimica Acta, v. 25, pp. 1-18.
PIGNATELLO, J. J.; OLIVEROS, E., and MACKAY, A., 2006, “Advanced
Oxidation Processes for Organic Contaminant Destruction Based on the Fenton
Reaction and Related Chemistry”, Critical Reviews in Environmental Science and Technology, 36:1–84.
SALVADOR, T., MARCOLINO JR., L.H., PERALTA-ZAMORA, P., 2012, “Degradação de corantes têxteis e remediação de resíduos de tingimento por processos fenton, foto-fenton e eletro-fenton”, Quim. Nova, 35, 932-938.
