APOIO




Síntese orgânica verde
da Silva, C. (UFF) ; Moreira de Mesquita, C. (UFF) ; Ponzio, E.A. (UFF) ; Rangel Campos, V. (UFF)
Este trabalho descreve a síntese, em condições brandas, de três derivados isatínicos contendo grupamento semicarbazônico, tiossemicarbazônico e aminoguanidínico, e mostra os resultados da avaliação da atividade anticorrosiva deles. A utilização dos inibidores de corrosão, pelo setor petrolífero, se destaca como um dos principais meios de evitar desastres ambientais causados pela corrosão. Os produtos obtidos foram caracterizados por espectroscopia na região do Infravermelho, e por Ressonância Magnética Nuclear de 1H. Os rendimentos variaram entre 30% - 85%. Para determinação da eficiência anticorrosiva, as moléculas tiveram ensaios de perda de massa realizados em solução de HCl 1 mol.L-1, utilizando como corpo de prova cupon de aço. Os resultados da eficiência foram entre 70,85% - 81,67%.
Isatina; Inibidores Orgânicos; Corrosão
Corrosão pode ser entendida como o conjunto de fenômenos de deterioração de materiais, principalmente metálicos, devido a reações químicas ou eletroquímicas entre o material e o meio circunvizinho[1]. O setor petrolífero, que utiliza de dutos extensos de aço carbono para extração de petróleo e gás, é um dos que mais sofrem com os prejuízos gerados por esse fenômeno[2]. Segundo uma publicação feita pela revista eletrônica Macaé Offshore, em 2017, cerca de 30% de toda produção mundial de aço foi destinada para repor estruturas metálicas deterioradas por processo corrosivo[3]. Com intuito de reduzir a cinética das reações de corrosão, e, portanto, prejuízos ambientais e econômicos, substâncias, especialmente orgânicas (denominadas de inibidores de corrosão) vêm sendo utilizadas[4]. Dentre os inúmeros compostos orgânicos, utilizados para este fim, destacam- se os heterocíclicos, tais como os derivados hidrazônicos do núcleo isatínico[4]. Isto porque, esses compostos possuem em sua estrutura os componentes necessários, como anéis aromáticos, heteroátomos com elétrons não ligantes e elétrons π, os quais possibilitam a essas moléculas ficarem adsorvidas na superfície do metal que compõe o aço carbono, formando o filme protetor[5,6]. Vale salientar, que o planejamento sustentável da extração de petróleo, não se aplica somente na prevenção da corrosão dos dutos, mas também da cadeia produtiva e no pensar de toda síntese que envolverá a obtenção de um possível inibidor que será utilizado. Nesse sentido, o objetivo do trabalho consiste no planejamento, síntese branda e avaliação de três substâncias, como potenciais agentes anticorrosivos, derivados do núcleo isatínico com grupamentos semicarbazônicos (1a), tiossemicarbazônicos (1b) e aminoguanidínicos (1c).
O derivado isatínico 1a foi obtido reagindo-se, 0,679 mmol de isatina (comercial), 1,35 mmol de semicarbazida e 6 ml etanol. A reação foi mantida sob refluxo por 24h, formando-se um precipitado, de cor amarelada, e isolado por filtração simples e lavagem com etanol/água. O derivado isatínico 1c foi obtido partindo-se de 0,679 mmol de isatina, 0,679 mmol de hidrogenocarbonato de aminoguanidina e 6 ml de etanol. A reação foi mantida sob refluxo por 24h, formando-se um precipitado, de cor acastanhada, e isolado por filtração simples. O derivado isatínico 1b, foi obtido reagindo- se 0,679 mmol de isatina, 0,679 mmol de tiossemicarbazida e 5 ml de ácido acético glacial. A reação foi mantida sob refluxo e agitação por 3h, e isolada por filtração simples, seguida de lavagem com água e solução saturada de NaHCO3. Todas as reações foram feitas em tubo de schlenk, e, acompanhadas por CCD para verificar se reação tinha sido concluída. Cada produto obtido foi devidamente caracterizado por IV, RMN de H1 e ponto de fusão, comparando os resultados com os descritos na literatura. Quanto ao teste gravimétrico realizado, duas soluções de 400 e 40 mg.L-1 contendo as substâncias 1a e 1b, separadamente, foram preparadas. Com o auxílio de um fio de nylon, um dos cupons (devidamente lixados e limpos seguindo-se as orientações da norma ASTM G1 – 90, e posteriormente pesados) foi imerso em um tubo falcon contendo 50 mL de solução de HCl 1,0 mol.L-1, enquanto o outro corpo de prova foi imerso em outro tubo falcon contendo uma mistura de 50 mL da mesma solução ácida e 50 mL de solução do inibidor em água, e deixados por 2h. Após a exposição, além da lavagem química, as placas de aço foram submetidas a uma decapagem química com solução de Clark. Por fim, foram secas e levadas à segunda pesagem.
A influência da concentração na eficiência inibidora das moléculas 1a e 1b
foram verificadas pelo método gravimétrico realizados em duplicata e
apresentaram os resultados descritos na Tabela 1, pela taxa de eficiência do
inibidor e na Tabela 2, pela taxa de corrosão (TC) na ausência e na presença
do inibidor. De acordo com a Tabela 1, pode-se observar que as taxas de
corrosão foram maiores na ausência dos inibidores do que na presença,
conforme esperado, enquanto a Tabela 2 apresenta os valores para a taxa de
eficiência para as duas substâncias. Os resultados foram superiores a 50%,
mesmo em baixas concentrações. A eficiência de inibição depende de diversos
fatores, incluindo o número de centros de adsorção, modo de interação com a
superfície do metal, tamanho e estrutura molecular.[7]
No caso dos inibidores testados, a presença de nitrogênio, oxigênio e
enxofre como centros de adsorção, promove a formação de um quelato na
superfície do metal. Os pares de elétrons isolados desses átomos são doados
a superfície do metal, formando uma ligação coordenada com o ferro.[8] Além
disso, as ligações π conjugadas permitem que haja uma sobreposição dos
orbitais p da molécula com o orbital d vazio dos átomos de ferro do metal,
aumentando a adsorção do composto na superfície metálica. Outro fator que
também influencia a performance satisfatória das substâncias é a presença do
grupo azo, C=N. O par de elétrons desta ligação, além de conectar as duas
partes conjugadas da molécula, contribui para o aumento da deslocalização
eletrônica das ligações do sistema, envolvendo principalmente os anéis da
estrutura. Tal fato resulta em uma redução na diferença de energia entre os
orbitais HOMO e LUMO da molécula, aumentando a polaridade e,
consequentemente, o poder de inibição das substâncias.
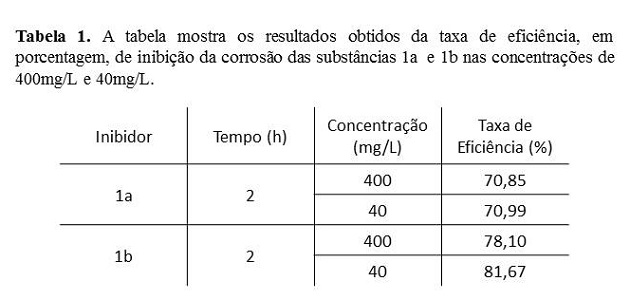
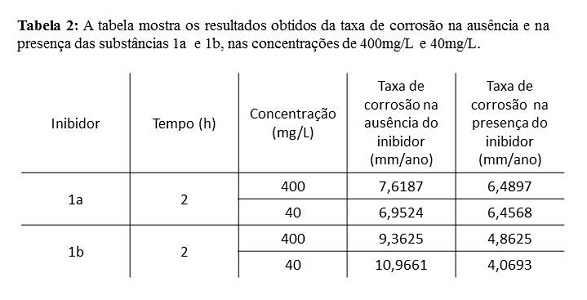
Os resultados destes estudos identificaram que os inibidores sintetizados apresentam altas taxas de eficiência, mesmo em baixas concentrações. Ainda assim, os percentuais de inibição dos sintéticos medidos por ensaio gravimétrico foram satisfatórios. O método permitiu a comprovação da eficiência de compostos orgân, contendo ligações π e átomos de oxigênio, nitrogênio e enxofre, como centros de adsorção, para utilização como inibidores de corrosão em meio ácido para o aço carbono ABNT 1020.
CAPES, CNPQ, FAPERJ, UFF.
[1] Telles, P.C.S. Materiais para Equipamentos de Processo, 2003, 275.
[2] GENTIL, Vicente. Corrosão. 6ª Ed. Rio de Janeiro: LTC, 2011.
[3] Redação. Setor naval: quais as diferenças entre oxidação, corrosão e ferrugem? Macaé Offshore, 2017. Disponível em: <http://www.macaeoffshore.com.br/capa/Materias.aspx?id=13113> Acesso em 02 out. 2019.
[4] Reznik, V. S. et al. Corrosion Science, 2008, 50, 392–403.
[5] D. Liu, X. Qiu, M. Shao, J. Gao, J. Xu, Q. Liu, H. Zhou, Z.
Wang, Mater. Corros. 2019, 1–10. https://doi.org/10.1002/
maco.201810700
[6] SANTOS, C. F.; ALBUQUERQUE, M. A.; OLIVEIRA, M. C. C.; ACHEVARRIA, A. A corrosão e os agentes
anticorrosivos. Revista Virtual de Química, vol 6, 2014.
[7]SINGH, A. K.; Quraishi M. A. Inhibiting effects of 5-substituted isatin-based Mannich bases on the corrosion of mild steel in hydrochloric acid solution. Journal of Applied Electrochemistry, vol. 40, p1293-1306, 2010.
[8] AHAMAD, I.; PRASAD, R.; Quraishi, M. A. Adsorption and inhibitive properties of some new Mannich bases of isatin derivates on corrosion of mild steel in acidic media. Corrosion Science, vol 52, p.1472-1481, 2010.