APOIO




Síntese orgânica verde
Martins Ferreira, J.L. (UERJ) ; Dias Senra, J. (UERJ) ; de Oliveira Domingos, J.L. (UERJ)
Tendo em vista a importância da catálise organometálica na formação de sistemas biarílicos e análogos, o trabalho apresentado tem como objetivo a síntese de biarilas contendo o cerne carbazólico por meio de reações de acoplamento cruzado C-C, catalisadas por nanopartículas de Pd(0). Um dos objetivos específicos envolve a realização das etapas com o emprego de condições reacionais ambientalmente benignas (solvente biocompatível, meio reacional reciclável, radiação micro-ondas). A metodologia utilizada para síntese dos cernes carbazólicos foi baseada na utilização do 3,6- diiodocarbazol, na presença de PEG-300, tendo Pd2(dba)3 como precursor catalítico. Através da radiação de micro-ondas (2 h), foi observado a formação do composto diarilado, também obtido nas condições de refluxo (24 h).
Carbazol; Nanopartículas de Pd; Acoplamento Cruzado
A obtenção de energia de forma eficiente, sustentável e abrangente continua sendo um desafio para a sociedade moderna. Células solares sensibilizadas por corantes (DSSC’s) possuem vantagens frente aos sistemas convencionais, tais como: menor custo, leveza, flexibilidade, facilidade na modulação das propriedades de transporte de carga, dentre outras. Segundo RAPHAEL et al, (2018), a energia solar fotovoltaica pode ser considerada umas das fontes de energia renováveis mais promissoras, pois provém de uma fonte abundante, limpa e segura, não gera ruídos e ainda permite a geração de energia elétrica em áreas remotas. As DSSC’s representam uma das classes mais promissoras e de menor impacto ambiental para a geração de energia elétrica. Em geral, o seu funcionamento envolve o suporte de moléculas orgânicas conjugadas (contendo grupos doadores e aceptores eletrônicos) em semicondutores inorgânicos e a conexão a um contra-eletrodo para a obtenção do efeito fotovoltaico. Segundo MAEGAWA et al, (2006), relataram que carbazóis 3,6-funcionalizados desempenharam boa performance na composição de células solares. A funcionalização e a extensão da conjugação, ou seja, o aumento da complexidade do anel do carbazol podem ser analisadas através das reações de acoplamento cruzado catalisadas por paládio (KUMAR; TAO, 2015), amplamente exploradas no âmbito da química sintética contemporânea. Tendo em vista os diversos benefícios de rendimentos/seletividades reacionais associadas ao uso de micro-ondas, neste trabalho são apresentados dados preliminares sobre o seu emprego para a síntese do 3,6-difenilcarbazol na presença de nanopartículas de Pd(0) estabilizadas em PEG-300.
Síntese do 3,6-diiodocarbazol: Em um balão de fundo redondo de 50 mL adicionou-se 1,0 mmol de carbazol, 20 mmol de dicloroiodato de potássio (KICℓ2) e 10 mL de acetonitrila (H3CCN). A mistura foi mantida à temperatura ambiente e sob agitação durante 60 minutos. A reação foi acompanhada por CCF, utilizando hexano/acetato de etila (9:1) e revelação UV. Após esse tempo, o meio reacional foi lavado com solução saturada de bissulfito de sódio e extraído com acetato de etila. A fase orgânica foi seca com sulfato de sódio anidro e evaporada sob pressão reduzida. Síntese do 3,6-difenilcarbazol: Em um balão de fundo redondo de 10 mL equipado com um condensador de refluxo foram adicionados 0,25 mmol de 3,6- diiodocarbazol, 0,5 mmol de ácido fenilborônico, 1,0 mmol de carbonato de potássio e 2 mol% do catalisador previamente preparado [ARVELOS, 2018]. A mistura foi agitada e aquecida a 90ºC por 24 horas. A reação foi acompanhada por CCF, utilizando hexano/acetato de etila (9:1) e revelação UV. Após esse tempo, o meio reacional foi extraído com água/acetato de etila. A fase orgânica foi seca com sulfato de sódio anidro e evaporada sob pressão reduzida. Esta reação também foi realizada em um reator de microondas (Anton Paar, Monowave 300), nas mesmas condições reacionais descritas. O meio reacional foi adicionado em um tubo de vidro fechado e a temperatura permaneceu constante (90ºC) em um período de 1 e 2 horas, com a potência variando entre 10-50W. O meio reacional foi extraído da mesma maneira que nas condições de refluxo.
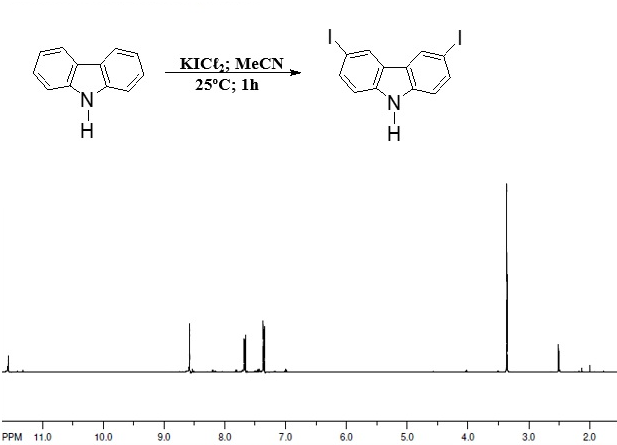
A obtenção do 3,6-diiodo-9H-carbazol foi realizada com dicloroiodato de
potássio (KICℓ2), protocolo já descrito na literatura e utilizado pelo grupo
de pesquisa, conforme mostrado no Esquema 1:
O produto da reação (3,6-diiodo-9H-carbazol) foi obtido com rendimento
superior a 80%. A análise do espectro de RMN 1H indica a presença de um
simpleto e dois dupletos entre 7,0 e 8,6 ppm, compatível com a descrição da
literatura (ARVELOS, 2018). A caracterização complementar foi realizada por
RMN 13C, FTIR e espectrometria de massas. Em seguida, o carbazol iodado foi
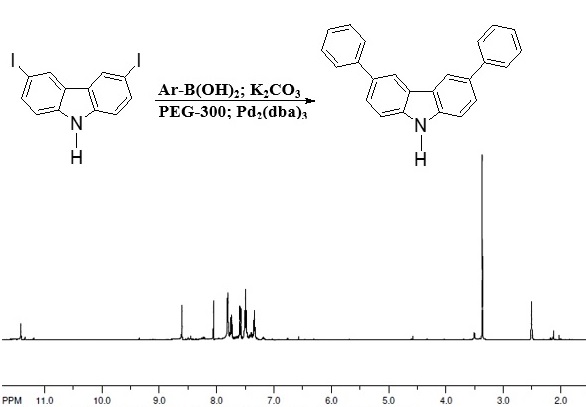
utilizado na reação de acoplamento cruzado do tipo Suzuki-Miyaura com o
intuito de aumentar a conjugação do anel carbazólico (Esquema 2). Como teste
preliminar, explorou-se a reação com o ácido fenilborônico na presença de
nanopartículas de paládio3. Essa metodologia, recentemente descrita pelo
grupo, demonstra a formação de nanopartículas de Pd(0) ativas a partir do
sistema Pd2(dba)3/PEG-300, as quais foram aplicadas para a obtenção do 3,6-
difenil-9H-carbazol, no entanto com tempos de reação de 24h O rendimento
observado para o 3,6-difenilcarbazol foi de 75%, sendo o único produto da
reação. Contudo, visando otimizar as condições reacionais, a reação foi
testada em microondas. Nessas condições, (input power = 10-50 W, T = 95°C, 2
mol % de Pd e 2 horas) observou-se a formação do 3,6-difenil-9H-carbazol em
alto rendimento (> 85%). A análise do espectro de RMN 1H indica a presença
de um multipleto contendo 10H. De acordo com dados do grupo (ARVELOS, 2018),
os conjuntos de sinais entre 7,5-7,2 ppm (m, 8H) e 7,8-7,6 ppm (t, 5H)
confirmam a presença do cerne biarílico. Além disso, um produto minoritário
foi observado, cujas características espectrais sugerem ser o produto
monoarilado.
Neste trabalho, são apresentados resultados visando a síntese do 3,6- difenilcarbazol em condições cataliticamente atrativas (uso de nanopartículas metálicas, meio reacional reciclável, uso de micro-ondas). Tendo em vista que a irradiação de micro-ondas possibilita o surgimento de efeitos térmicos e não-térmicos, um padrão de seletividade diferente foi observado. Outras reações encontram-se em andamento para a determinação das melhores condições de síntese em reações de Suzuki e outros acoplamentos cruzados.
FAPERJ, CNPq, CAPES e UERJ.
ARVELOS, M.S. et al. Revealing Pd Nanoparticles Formation from PEG-Mediated Decomposition of Organometallic Precursor and Their Application as Catalyst for the Synthesis of n-Extended Carbazoles. ChemistrySelect, v. 3, n. 33, p. 9725-9730, 2018
BATALHA, P. N., SAGRILLO, F. S., & GAMA, I. L. Acoplamento Cruzado C-C: Novas Metodologias, Aplicações e Descobertas ao Longo dos Últimos Anos. Revista Virtual de Química, Niterói, v. 6, n. 2, p. 494–550, Dez. 2013.
KUMAR, S.; TAO, Y.T. Synthesis of Polyarylated Carbazoles: Discovery toward Soluble Phenanthro- and Tetraceno-Fused Carbazole Derivatives. The Journal of Organic Chemistry, v. 80, n. 10, J. p. 5066-5076, 2015.
LU, C. et al. Simple Synthesis and Molecular Engineering of Low-cost and Star-shaped Carbazole-based Hole Transporting Materials for Highly Efficient Perovskite Solar Cells. Journal of Materials Chemistry A, v. 5, n. 38, p. 20263-20276, 2017.
MAEGAWA, Y. et al. A useful procedure for diiodination of carbazoles and subsequent efficient transformation to novel 3,6 bis(triethoxysilyl)carbazoles giving mesoporous materials, Tetrahedron Lett, v. 47, n. 39, p. 6957-6960, 2006.