APOIO




Catálise
Mendes Tanabe, N.B. (UFF) ; Ribeiro Barbosa, J. (UFF) ; Silva Rodrigues, T. (UFRJ) ; Checca, N.R. (CBPF) ; Cambraia Alves, O. (UFF) ; Martins da Silva, J.C. (UFF)
Uma grande quantidade de ureia é lançada em efluentes diariamente, pois a ureia está presente na urina humana e é produzida como fertilizante em indústrias. Foram sintetizadas nanopartículas de Ni suportadas em carbono e CeO2 com diferentes morfologias para aumentar a atividade catalítica frente a reação de eletro-oxidação da ureia. A caracterização foi feita a partir de DRX e TEM que comprovaram a presença de CeO2, carbono e Ni. Nos experimentos de VC, a adição de céria nanofio apresentou um valor de densidade de corrente 20% maior em relação a adição de céria comercial e 54% maior em relação ao catalisador suportado em carbono. Já nos experimentos de CA, a tendência manteve-se a mesma, mostrando assim que a presença de céria aumentou a atividade catalítica na reação de interesse.
eletrocatálise; ureia; nanomateriais
A água doce é um recurso escasso e seu consumo vem crescendo com o passar dos anos. Um grande volume de ureia é lançado em efluentes municipais diariamente, pois a urina humana contém cerca de 2 a 2,5 % de ureia em peso. Além disso, cada ser humano adulto produz em média cerca de 33 g de ureia por dia [3]. O descarte inadequado dessas águas residuais pode causar sérios problemas ambientais, pois a ureia pode decompor-se em amônia e ser emitida para atmosfera, sendo posteriormente oxidada a nitratos, nitritos e óxidos nítricos [6]. Dessa forma, se faz necessário o uso de tecnologias de baixo custo aplicáveis ao tratamento de efluentes domésticos e industriais para remover os contaminantes, dentre eles a ureia. A oxidação eletroquímica seria o método ideal, pois é uma tecnologia de baixo custo, de fácil controle e ainda é capaz de gerar hidrogênio como combustível alternativo ao mesmo tempo que limpa a água residual [11]. O H2 pode ser utilizado para produzir energia elétrica com alta eficiência e baixa emissão de poluentes em células a combustível [12]. Esse trabalho teve como objetivo a síntese e caracterização de nanopartículas (NPs) de níquel suportadas em carbono Vulcan e em uma mistura de carbono Vulcan 80% mais 20% de CeO2 com diferentes morfologias (esférica de origem comercial e nanofios) para serem aplicados como eletrocatalisadores no processo de eletro-oxidação da ureia. As nanopartículas de níquel foram sintetizadas pelo método do boro-hidreto de sódio [4], já os nanofios de céria foram sintetizados pelo método hidrotermal [8].
As nanopartículas foram sintetizadas pelo método do boro-hidreto de sódio [4], onde o Ni(NO3)2.6H2O (20% em peso), o carbono Vulcan (64% em peso) e o CeO2 (16% em peso) foram dissolvidos em etanol a 99,5%. N2 foi purgado no balão por 30 minutos. Adicionou-se NaBH4 sob agitação constante à temperatura ambiente e a solução resultante permaneceu sob agitação por mais 15 minutos. A dispersão com as nanopartículas foi centrifugada duas vezes por 30 minutos em etanol e depois duas vezes em água. Em seguida, o material foi seco a 70 °C por 12h na estufa. Para o preparo do eletrodo, coletou-se 8µL de uma dispersão preparada com náfion, álcool isopropílico, água e catalisador. Em seguida, o material foi seco a 60 °C por 5 minutos. A análise eletroquímica foi realizada em meio de KOH 1M e N2 foi purgado por 5 minutos antes da análise. As medidas foram realizadas num potenciostato DropSens e com 3 eletrodos, sendo um de trabalho, um contraeletrodo de platina e o de referência Hg/HgO. A caracterização eletroquímica em eletrólitos de porte (KOH 1 mol/L) foi realizada por medidas de voltametria cíclica (VC) entre 0 e 0,7V vs Hg/HgO onde 10 ciclos foram coletados com velocidade de varredura de 50 mV/s e 10 mV/s. A atividade eletrocatalítica dos materiais foi avaliada na presença de KOH 1 mol/L e ureia 0,33 mol/L por voltametria cíclica entre 0 e 0,7V vs Hg/HgO onde 5 ciclos foram coletados com velocidade de varredura de 10 mV/s. Por fim, realizaram-se medidas de cronoamperometria (CA) por 1 hora à 0,55V. Para caracterização das nanopartículas foram usados os seguintes equipamentos: JEOL JEM-2100 a 200 kV para se obter as imagens de TEM e X’Pert Pro PW3042/10 na faixa entre 20°<2Ɵ>90° (KαCu =1,54Å, escaneamento 0.025°s-1) para análise de DRX.
A água doce é um recurso escasso e seu consumo vem aumentando gradativamente com o passar dos anos. São produzidas, diariamente, grandes quantidades de águas residuais domésticas e industriais que contém compostos orgânicos (SAYED et al., 2019). Dentre os contaminantes presentes, pode-se citar a ureia. A ureia é um composto orgânico de fórmula H2NCONH2 produzido em larga escala na indústria como fertilizante e aditivo para ração animal (YAN; WANG; BOTTE, 2012). Um grande volume de ureia é lançado em efluentes municipais diariamente, pois a urina humana contém cerca de 2 a 2,5 % de ureia em peso. Além disso, é estimado que cada ser humano adulto produz em média cerca de 33 g de ureia por dia [1]. O descarte inadequado dessas águas residuais contendo ureia pode causar sérios problemas ambientais, visto que a ureia pode decompor-se naturalmente em amônia e, posteriormente, ser emitida para atmosfera. A amônia na atmosfera é instável e pode ser oxidada a outros poluentes nitrogenados como nitratos, nitritos e óxidos nítricos, e consequentemente, pode haver formação de chuva ácida (FELIX; CARDOSO, 2004).
Dessa forma, se faz necessário o uso de tecnologias de baixo custo aplicáveis ao tratamento de efluentes domésticos e industriais para remover os contaminantes, dentre eles a ureia. A oxidação eletroquímica da ureia a partir de águas residuais ricas nesse composto tem chamado muita atenção devido a diversos fatores, tais como: se tratar de uma técnica bem controlada, ter um longo período de operação e pela possibilidade de ampliação para processos de manipulação em larga escala. (YAN; WANG; BOTTE, 2012). Além disso, a oxidação eletroquímica da ureia também é capaz de gerar hidrogênio como combustível alternativo ao mesmo tempo que limpa a água residual (VEDHARATHINAM; BOTTE,
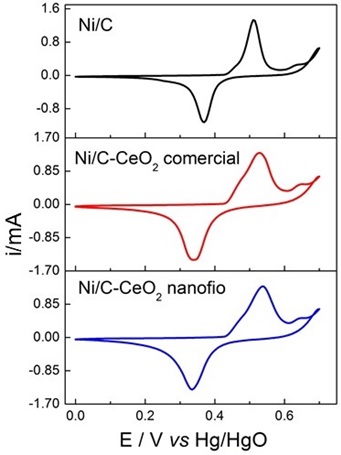
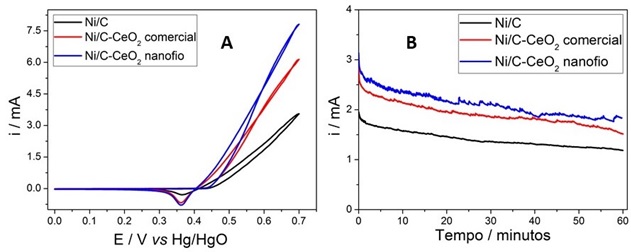
A partir dos resultados de DRX, nota-se que os eletrocatalisadores estão na fase Ni° e Ni(OH)2 e que os picos característicos do CeO2 estão presentes. Os experimentos de VC mostraram que ao adicionar céria nanofio a densidade de corrente foi 20% superior em relação a adição de céria comercial e 54% em relação ao catalisador suportado em carbono. Já nos experimentos de CA, a densidade de corrente para a adição de céria nanofio foi 28% maior que a adição de céria comercial e 120% maior do que o catalisador suportado em carbono.
CBPF, CAPES, LNNano, CNPQ, FAPERJ (processo n. E-26/211.371/2019 (250734)), CNPEM
1. ABD EL-LATEEF, H. M.; ALMULHIM, N. F.; MOHAMED, I. M. A.. Physicochemical and electrochemical investigations of an electrodeposited CeNi2@NiO nanomaterial as a novel anode electrocatalyst material for urea oxidation in alkaline media. Journal of Molecular Liquids, https://doi.org/10.1016/j.molliq.2019.111737
2. AZEREDO, N.F.B. et al.. Nanostructured mixed Ni/Pt hydroxides electrodes for BIA-amperometry determination of hydralazine. Journal of the Taiwan Institute of Chemical Engineers, vol 95, 475-480. 2019.
3. BOGGS, B. K.; KING, R. L.; BOTTE, G. G.. Urea electrolysis: direct hydrogen production from urine. Chemical Communications, vol 32, 4859-4861. 2009.
4. CHEN, J. et al. Galvanic replacement synthesis of NiPt/graphene as highly efficient catalysts for hydrogen release from hydrazine and hydrazine borane. Journal of Alloys and Compounds, vol 695, 3036-3043. 2017.
5. DU, H. et al. Design and synthesis of CeO2 nanowire/MnO2 nanosheet heterogeneous structure for enhanced catalytic properties. Materials Today Communications, vol 11, 103-111. 2017.
6. FELIX, E. P.; CARDOSO, A. A.. Amônia (NH3) atmosférica: fontes, transformação, sorvedouros e métodos de análise. Química Nova, vol 27, No 1, 123-130. 2004
7. SAYED, E. T. et al. Direct urea fuel cells: Challenges and opportunities. Journal Of Power Sources, vol 417, 159-175. 2019
8. SILVA, A. G. M. da. et al. Sub-15 nm CeO2 nanowires as an efficient nonnoble metal catalyst in the room-temperature oxidation of aniline. Catalysis Science & Technology, vol 8, No. 7, 1828-1839. 2018.
9. SINGH, R. K.; SCHECHTER, A. Electrochemical investigation of urea oxidation reaction on b Ni(OH)2 and Ni/Ni(OH)2. Electrochimica, vol 278, 405-411. 2018.
10. TRAN, T. Q. N. et al. CeO2-modified LaNi0.6Fe0.4O3 perovskite and MWCNT nanocomposite for electrocatalytic oxidation and detection of urea. Journal Of Electroanalytical Chemistry, vol 818, 76-83. 2018.
11. VEDHARATHINAM, V.; BOTTE, G. G. Direct evidence of the mechanism for the electro-oxidation of urea on Ni(OH)2 catalyst in alkaline medium. Electrochimica Acta, vol 108, 660-665. 2013
12. WANG, D. et al. Electrochemically reduced graphene oxide-nickel nanocomposites for urea electrolysis. Electrochimica Acta, vol 89, 732-736. 2012.