APOIO




Catálise
Martins, G. (UFRJ) ; Staudt, A. (UFRJ) ; Malafaia, C. (UFRJ) ; Leal, I. (UFRJ)
Epóxidos são compostos amplamente utilizados devido à alta reatividade do anel oxirano. Uma forma de se obter esses epóxidos é a partir de reação quimioenzimática. Portanto, o objetivo deste trabalho é determinar o solvente a ser utilizado em reações de epoxidação utilizando a enzima Novozym 435®. As reações foram conduzidas em shaker com agitação orbital de 250 rpm a 40°C a partir da mistura a razão molar 2:2:1 (β-pineno:ácido octanóico:UHP), quando utilizados os solventes ciclohexano, diclorometano e acetonitrila, e razão molar 2:1 (β-pineno:UHP) quando utilizado acetato de etila, com 10% de enzima. Como resultado, em acetato de etila obteve-se 40% de produto em 24 h. Logo, este trabalho serve como base, comprovando que acetato de etila é o solvente ideal para estas reações
epoxidação; monoterpeno ; biocatálise
Os epóxidos apresentam vasta aplicação industrial tendo em vista que estes podem ser utilizados na síntese de diversas substâncias. O potencial da epoxidação deve-se à alta reatividade do anel oxirano formado, que pode reagir com diversos nucleófilos (DA SILVA; NASCIMENTO, 2012). O primeiro uso de enzimas como catalisadoras de reações de epoxidação foi descrita em 1990, no qual utilizaram uma lipase imobilizada para catalisar a reação de perhidrólise, formando in situ perácido a partir da reação do ácido carboxílico e peróxido de hidrogênio, estes perácidos reagem diretamente com alcenos, formando o epóxido (BJÖRKLING; GODTFREDSEN; KIRK, 1990). Na literatura encontram-se diversos trabalhos relatando enzimas capazes de realizar este tipo de reação, como por exemplo, monooxigenases capazes de epoxidar alcenos utilizando oxigênio molecular (MEUNIER; DE VISSER; SHAIK, 2004) e cloroperoxidases utilizam peróxido de hidrogênio como precursores para a produção de epóxidos (COLONNA, 1993). No entanto, estas enzimas possuem limitações quanto a aplicação, pois necessitam de cofatores específicos ou não são capazes de manter a atividade catalítica em solventes orgânicos. Uma forma de contornar essas limitações é a partir do emprego de lipases, tendo em vista que lipases imobilizadas apresentam vantagens quando comparadas a outras enzimas, pois atuam em temperaturas mais brandas e a enzima, quando imobilizada, pode ser reutilizada por diversos ciclos (MOREIRA; NASCIMENTO, 2007) e são estáveis em solventes orgânicos (TANG et al., 2016). Baseado nisto, este trabalho tem como objetivo realizar a epoxidação de monoterpenos utilizando lipase B de Candida antarctica imobilizada (Novozyme 435®) bem como determinar o solvente ideal para a obtenção deste.
Material: Os reagentes utilizados neste estudo (β-pineno e ácido octanóico) foram adquiridos da empresa Sigma-Aldrich, Brasil. Os solventes adquiridos da empresa Tedia, Brasil. A enzima Novozym 435® de Candida antarctica B expressa em Aspergillus niger e imobilizada em resina de troca iônica acrílica macroporosa foi obtida pela empresa Novozymes, Brasil. Método: A reação de epoxidação foi conduzida em frasco de vidro a partir da mistura de 2 mmol de β-pineno, 2 mmol de ácido octanóico, 1 mmol de complexo de ureia-peróxido de hidrogênio (UHP) e 10 % da enzima Novozyme 435 (1422 U/mL) em relação a soma das massas do monoterpeno e do ácido octanóico, em 3 mL de solvente. Sendo que os solventes testados foram: ciclohexano, diclorometano, acetonitrila e acetato de etila, em reações a 40°C, sob agitação em shaker orbital (250 rpm), durante o período de 24 a 72 h. Quando avaliado o solvente acetato de etila não foi feita a adição de ácido octanóico a mistura reacional, tendo em vista que este solvente tem a capacidade de atuar como fonte de acila da própria reação (AKUNDEY et al, 2007). Alíquotas de 50 µL foram retiradas a cada 24 horas e analisadas por Cromatografia em fase Gasosa acoplada à Espectrometria de Massas (CG-EM) para determinar a taxa de conversão de substratos em produto, através da área relativa do produto formado. Nas amostras obtidas das reações com ácido octanóico fez-se derivatização das mesmas a partir da adição de 10 µL de MSTFA (N-Methyl-N-(trimethylsilyl)trifluoroacetamide) e sonicação durante 30 minutos antes da injeção.
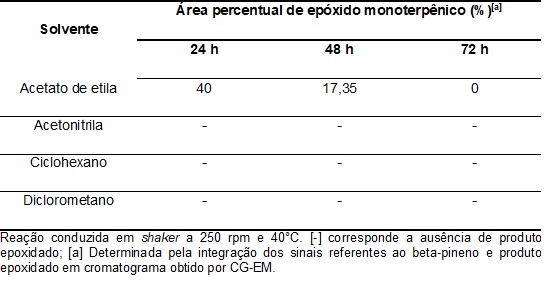
Pela análise dos cromatogramas percebeu-se que que a reação é favorecida
quando empregado o acetato de etila como solvente, quando comparado aos
outros solventes testados, como mostrado na Tabela 1, tendo em vista que a
reação com acetato de etila apresentou a melhor conversão, obtendo-se
aproximadamente 40% do epóxido (Spiro[biciclo[3.1.1]heptano-2,2'-oxirano),
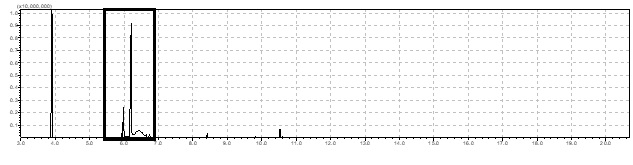
sem subprodutos após 24 horas de reação (Figura 1). O produto foi
identificado nos tempos de retenção de 5,97 e 6,2 minutos e o espectro de
massas obtido (m/z: 152, 79, 71) foi comparado com os espectros depositados
na Biblioteca NIST05 e apresentou 93% de similaridade com o epóxido do β-
pineno.
Em maiores tempos reacionais (48 e 72 h) observou-se que não houve consumo
significativo do monoterpeno em estudo (em relação a 24 h) bem como houve a
degradação do epóxido, formando-se principalmente subprodutos de enolização
e cetonas.
Akundey et al (2007) relatam em seu estudo que a utilização de ésteres como
solvente, apresentam vantagens já que que podem atuar tanto como solvente
quanto como substrato para a formação do perácido in situ.
Para os demais solventes observou-se a ausência da formação do produto de
interesse (Tabela 1) e a formação de diversos subprodutos, como aldeídos e
cetonas, sendo observados nos três tempos reacionais avaliados (24, 48 e 72
h). Ao contrário do que foi descrito por Da Silva e Nascimento (2012),
esperava-se que em solventes apolares a conversão fosse superior, visto a
maior solubilidade dos reagentes nestes solventes. Além da polaridade
destaca-se que nestes meios reacionais ocorre a adição de ácido octanóico e
o excesso de acidez promovido pelo mesmo pode ter influenciado na degradação
do epóxido (GOUD; PATWARDHAN; PRADHAN, 2006), já que estas moléculas são
altamente reativas.
Dentre os resultados obtidos, observa-se que acetato de etila apresentou-se como o solvente ideal para as reações de epoxidação. Além de ser financeiramente mais vantajoso, já que é capaz de atuar como solvente e substrato da reação, neste meio reacional obteve-se a melhor conversão (40 % de epóxido formado em 24 horas). Baseado nisso, em trabalhos posteriores pretende-se otimizar esta reação, alterando-se parâmetros como o percentual de biocatalisador, razão molar de monoterpeno/UHP, temperatura e utilizar outros reatores, tais como micro-ondas e fluxo-contínuo
CAPES, CNPq, FAPERJ
ANKUDEY, E.; OLIVO, H.; PEEPLES, T. Lipase-Mediate Epoxidation Utilizing Urea—Hydrogen Peroxide in Ethyl Acetate. ChemInform, v. 38, n. 8, 2007.
BJÖRKLING, F.; GODTFREDSEN, S. E.; KIRK, O. Lipase-Mediated Formation of Peroxycarboxylic Acids Used in Catalytic Epoxidation of Alkenes. Journal of the Chemical Society, Chemical Communications, n. 19, p. 1301–1303, 1990.
COLONNA, S. Enantiasel~ve Epoxidation DStyrene Derivativea by Cbloropeddase Cdalysi8. v. 4, n. 6, p. 1325–1330, 1993.
DA SILVA, J. M. R.; NASCIMENTO, M. D. G. Chemoenzymatic Epoxidation of Citronellol Catalyzed by Lipases. Process Biochemistry, v. 47, n. 3, p. 517–522, 2012.
GOUD, V. V.; PATWARDHAN, A. V.; PRADHAN, N. C. Studies on the Epoxidation of Mahua Oil (Madhumica Indica) by Hydrogen Peroxide. Bioresource Technology, v. 97, n. 12, p. 1365–1371, 2006.
MEUNIER, B.; DE VISSER, S. P.; SHAIK, S. Mechanism of Oxidation Reactions Catalyzed by Cytochrome P450 Enzymes. Chemical Reviews, v. 104, n. 9, p. 3947–3980, 2004.
MOREIRA, M. A.; NASCIMENTO, M. G. Chemo-Enzymatic Epoxidation of (+)-3-Carene. Catalysis Communications, v. 8, n. 12, p. 2043–2047, 2007.
TANG, Q. et al. Lipase-Driven Epoxidation Is A Two-Stage Synergistic Process. ChemistrySelect, v. 1, n. 4, p. 836–839, 2016.