ÁREA
Química Computacional
Autores
Viana, K.P. (UEMA) ; Sousa, A.S. (UEMA) ; Santos, P.L.L. (UEMA) ; Almeida, P.H.B. (UEMA) ; Fernandes, R.M.T. (UEMA) ; Khan, A. (UEMA)
RESUMO
O presente trabalho apresenta os cálculos de otimização e frequência realizados das reações isodésmicas de acetato de metila nas temperaturas 0K, 298K, 500K, 1000K e 1500K pelo método DFT. A escolha do acetato de metila como combustível alternativo vem por algumas de suas características químicas, como a baixa massa molecular, estabilidade em condições normais de temperatura e pressão e decomposição térmica que gera CO e CO2, ácido acético, etanol e vapores d’água. Por essas características, ele demonstra ser menos agressivo que os derivados de petróleo enquanto combustível, o que justifica o estudo sobre esse acetato para aplicação em combustível alternativo. Os cálculos que serão expostos em tabelas demonstram o comportamento do acetato de metila nas temperaturas mencionadas.
Palavras Chaves
Acetato de Metila; Reações isódesmicas; Combustível alternativo
Introdução
O petróleo e seus derivados, desde o século XX, movem a era da velocidade. Plásticos, asfalto, gás natural, combustível, todos advém do petróleo. Porém, esses hidrocarbonetos, além de muito impulsionarem o ciclo cotidiano, também trazem diversos problemas ambientais. O impacto no meio ambiente causado pela queima da gasolina pelos automóveis juntamente com o prazo de existência do petróleo chama a atenção dos ambientalistas e cientistas em geral para solucionar tais problemas (HAWKEN, 2000). Atualmente existem os biocombustíveis como o etanol, cuja principal matéria- prima é a cana-de açúcar, mas que também pode ser adquirido através do milho e da soja, por exemplo, os provenientes do acetato de metila e etila, entre outros. O desenvolvimento desses combustíveis alternativos deixou de ser pela preocupação com o esgotamento das reservas e passou a ser pela pressão dos ambientalistas sobre as indústrias automobilísticas “A indústria automotiva tem modernizado continuamente a tecnologia dos motores, buscando uma queima mais eficiente dos combustíveis e uma redução da emissão de gases, visando atender às crescentes exigências ambientais” (GOLDENSTEIN E AZEVEDO, p.244, 2006). O desenvolvimento desses novos combustíveis ocorreu devido aos avanços da Química Computacional juntamente com o estudo da termodinâmica, que estuda as interações da energia nas quais as variações de temperaturas são importantes. Algo de suma importância no estudo de combustíveis, pois o comportamento deste em diversas temperaturas é algo crucial a se conhecer antes do uso comercial, uma vez que negligenciado, pode interferir no seu bom desempenho e colocar vidas em risco, como por exemplo, o acetato de metila, usado em combustível alternativo que ao entrar em combustão, seu vapor pode explodir se a ignição for em área fechada. O estudo termodinâmico e cinético das reações do acetato de metila (também chamado de etanoato de metila) provém da necessidade do controle desse composto, pois o mesmo apresenta subprodutos, que podem causar problemas para a indústria, o que tornou o estudo viável a partir da complexidade em se propor um modelo cinético de combustão a partir de parâmetros cinéticos para moléculas de ésteres de massa molecular elevada (RIZZO, 2013). Este trabalho utilizou a Teoria Funcional da Densidade (DFT), que, como diz (MORGON e CUSTODIO1 1995), surgiu como uma forma de facilitar e melhorar o cálculo de moléculas, oferecendo resultados mais rápidos e precisos por meio da química computacional. O cálculo de grandes moléculas foi o mais beneficiado com o desenvolvimento deste método, o que contribuiu para o avanço da Química Quântica nas demais pois contribuiu para a invenção de novos matérias, e tendo aplicações importantes no estudo de metais e semicondutores. Com a ajuda de computadores a DFT permitiu estudar sistemas cada vez mais complexos, o que influenciou no estudo de sólidos, moléculas e átomos, além de ter um papel fundamental nas áreas nanotecnologia e biotecnologia. Observados todas essas possibilidades graças ao DFT, o comitê do Nobel de Química atribuiu o prêmio á Walter Kohn e John Pople. Apesar disto, a introdução desta teoria na Química foi lenta. De acordo (MARQUES e BOTTI, 2006) essa introdução apenas tornou-se possível com a contribuição de J. Pople que a introduziu no seu programa de computador Gaussian, tornando-se o programa de Química Quântica mais usado em todo o mundo. Segundo (PONOMAREV e TAKHISTOV, 1997), uma reação isodésmica é um processo químico hipotético, onde o número de ligações de cada tipo formal permanece o mesmo de cada lado da reação, ou seja, as reações isodésmicas do acetato de metila precisa ter a mesma quantidade e os mesmos átomos da reação principal, por exemplo, porém, as reações precisam continuar mútuas. Um outro ponto é que o calor de uma reação isodésmica é uma medida dos desvios das atividades das energias de ligação. Esse desvio, segundo os autores, é formado para um determinado sistema, o que pode ser interpretado em termos de físico-química orgânica. A Energia Livre de Gibbs (G), em termos básicos, é a energia necessária de que um processo necessita para realizar trabalho em temperatura e pressão constantes. Para (CHEN, 2019) defende Energia Livre de Gibbs molar, ou Energia livre de GIBBS parcial, em J/mol deve ser identificada com um potencial químico, uma vez que o potencial químico de uma substância é a energia química por mol da substância, o que deste modo, a Energia Livre de Gibbs é a energia química e a substância pode ser pura ou um sistema multicomponente. Por outro lado, a Entalpia (H) é a energia térmica que cada composto presente em uma reação possui, ou seja, é a energia interna da molécula. A entalpia também pode ser entendida como a energia, sobre pressão constante, poderia ser transformada em calor.
Material e métodos
Sobre os cálculos das moléculas de acetato de metila, primeiro foi calculado sobre a molécula completa, depois alguns átomos iam sendo retirados e os íons iam sendo calculados. Todos os valores foram tabelados e serão demonstrado a seguir juntamente com sua respectiva molécula. Após isto, todos as reações obtidas a partir dessa composição foram desenhados e calculados no GaussianView e Gaussian 09W, respectivamente. Logo depois, o desenho de cada estrutura da molécula, veio a parte do cálculo. No Gaussian há a opção de “Calculate”, que acessada mostra os parâmetros para os cálculos. Os utilizados foram “Otimização e Frequência”. Em seguida, a escolha do método foi o já citado, DFT na base Pople. Como o processador e RAM do notebook utilizado são rápidos o suficiente para permitir a rapidez dos cálculos, por volta de 2 minutos os resultados já estavam prontos, resultados esses referentes à Entalpia, Energia Livre de Gibbs, Energia Interna, Capacidade Volumétrica e Entropia. Esse mesmo procedimento foi realizado 65 vezes nas cinco temperaturas trabalhadas (0K, 298K, 500K, 1000K e 1500K) uma vez que ao todo foram trabalhadas 13 reações isodesmicas. O trabalho faz uso de métodos baseados na Teoria do Funcional da Densidade (DFT), B3LYP com a base de Pople e o tempo médio de cada cálculo foi em torno de 5min em no Notebook da Lenovo Ideapad S145, 8ª Geração com processador Intel Core i5, 8GB de RAM e 1TB de armazenamento. Com todos os resultados tabelados e transformados para J/mol (Energia de Gibbs (G) e Entalpia(H) estavam em Hartree; Entropia (S), Capacidade Volumétrica (CV), estavam em cal/mol e a Energia Interna (U) estava kcal/mol. O cálculo para a entalpia e energia livre de Gibbs de formação foi realizado utilizando-se os valores experimentais dos átomos componentes da molécula em questão, o Etano (C6H6), tabelados na literatura.
Resultado e discussão
Na Figura 2 estão os resultados obtidos através do GaussianView e Gaussian 09W,
da qual podemos tirar os seguintes resultados:
A Entalpia e entropia de todas as reações são parecidas, e quase não tiveram
variação, observando os valores tabelados, vê-se que seus valores se mantem com
certa constância, o que indica certo equilíbrio no sistema.
A Energia Livre de Gibbs, por outro lado teve várias variações, ora oscila
drasticamente como na reação 6 e 7, ora mantêm-se estável como na reação 5. Nas
reações 1, 2,3, 4 e 7, em relação à Energia Livre de Gibbs, ela é não espontânea
nos pontos 298 a 500K, e torna-se espontânea a partir de 500K. De acordo com a
pesquisa essa reação indica que a substância pode sim ser usada em máquinas
térmicas de alta temperatura, como foguete, por exemplo, pois a partir de 500K
acontece uma diminuição linear drástica da variação da Energia Livre de Gibbs
(ΔG), o que indica que a energia útil do sistema para realizar trabalho é
espontânea e cresce de forma satisfatória.
Em relação à entalpia, percebemos que a ela é constante a partir de 500K com uma
variação pouco significativa apresentando valores abaixo de 0 (ΔHº<0) o que
significa que a reação é do tipo exotérmica.
A reação 5 apresenta uma variação pouco significativa na Energia de Gibbs,
apresentando valores abaixo de 0 o que representa que apesar de constante
apresenta energia útil suficiente para realizar trabalho no sistema. Em relação
à energia de Entalpia existe valores abaixo de 0 representando uma reação
exotérmica mais baixa.
Na reação 6, entre os pontos 0 e 298K existe uma diminuição dos valores da
Energia Livre de Gibbs e um aumento repentino até o ponto 500K, tendo atividade
espontânea a partir do ponto de 1500K. Assim como a Entalpia com valores
positivos apresenta uma absorção de energia no sistema.
A entropia nas reações 1, 2, 3, 4, 5, 6 e 7 apresenta valores positivos e
significa que há um grau de desordem, contudo seus valores são muito baixos e
próximos de zero mantendo estabilidade na questão vibracional das moléculas, mas
ela não interfere na eficiência de trabalho em alguns pontos (principalmente de
500 a 1500K) que o Acetato de Metila pode desempenhar.
A comparação dos resultados dos cálculos das moléculas e com a molécula do
etanol, atual biocombustível mais utilizado no Brasil é para dar ênfase nos prós
no uso do Acetato de Metila como biocombustível.
O valor encontrado para a entalpia de formação (ΔrHº) do etano (C6H6) em 298K
foi ΔrHº = -88,90 kJ/mol, em comparação com o valor experimental ΔrHº = -82,62
kJ/mol é um valor muito aproximado, o que confirma a veracidade dos cálculos
apresentados até aqui. Segundo (BIZZO, 2012) como a entalpia de formação
(combustão) é a variação de entalpia de quando um componente sofre combustão
completa com temperatura e pressão constante, apesar de ser um pouco maior que o
valor, o valor encontrado ainda demonstra que o etano tem uma boa combustão em
298K e se aproxima da entalpia de combustão do etanol no estado líquido (ΔrHº=
-66,37J/mol)
O Acetato de Metila é um éster que possui um comportamento muito padronizado de
acordo com as reações hipotéticas utilizadas apresentando um ΔG que diminui a
partir da temperatura de 500K, tendo uma diminuição linear e constante. Além
disso, grande parte das reações apresentaram uma entropia estável, podendo ser
usado de maneira satisfatória em por exemplo, foguetes, e máquinas térmicas de
alta temperatura. Além disso, pode ser um combustível viável para os automóveis,
apresentando produtos da combustão pouco nocivos.
Contudo, analisou-se que a taxa de reação para algumas reações não é viável, e
que em uma reação hipotética (reação 6) houve um momento em que a ΔG aumentou
entre os pontos 298K e 500K, o que pode indicar pouca eficiência de trabalho e
energia útil para o sistema, como por exemplo, o motor à combustão. Além disso,
apresenta em alguns pontos, principalmente abaixo de 500K, um comportamento não
espontâneo da reação. Em alguns casos, onde a entalpia indica que a reação é
endotérmica, absorve calor.
Os parâmetros termoquímicos avaliados vão de encontro com a literatura,
apresentando grande potencial para o uso, seja industrial, aeroespacial e até
mesmo automobilístico. Porém foram encontrados resultados que desfavorecem a sua
taxa de eficiência, mostrando que em algumas das hipóteses utilizadas, seu
comportamento é ativo (apresenta desempenho), contudo é muito baixo. Logo para
que seu uso seja otimizado deve-se levar em consideração essas
falhas/adversidades, criando soluções.
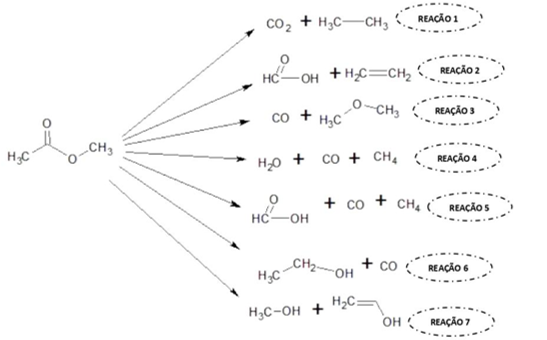
Reações isodésmicas obtidas a partir da decomposição \r\ntérmica do Acetato de Metila
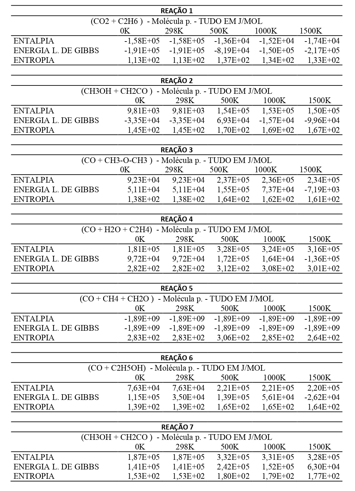
Resultados termodinâmicos das interações entre as \r\nreações isodésmicas
Conclusões
Na investigação dos parâmetros do Acetato de Metila, foi possível notar a eficiência do combustível alternativo em comparação com outro do mercado, o etanol, e os resultados foram muito satisfatórios, apresentando uma capacidade de realizar trabalho tendo instabilidade molecular e grande poder de combustão. O processo de análise das reações hipotéticas do tipo isodesmicas mostraram que o tipo químico do produto e a quantidade interferem no desempenho de reatividade, logo aquelas reações que apresentam decomposição térmica de moléculas como monóxido de carbono e metano – além da água – mostram uma espontaneidade maior do processo mesmo em temperaturas baixas como abaixo do 2° ponto de observação. Além de apresentar uma capacidade de queima e eficiência melhores que o etanol por exemplo, também pode-se destacar seu uso para a indústria e projetos espaciais, pois em altas temperaturas a energia útil resultado das reações é alta e mostra que pode ser utilizado em maquinas mais potentes, capazes de gerar mais força ou energia térmica em grande escala. E a sua estabilidade molecular mostra que o processo de combustão pode ser controlado e otimizado, o traz maior segurança para quem manuseia e faz seu uso. Então, por apresentar resultados que destacam sua eficiência alta, estabilidade molecular, e poucos agentes nocivos ao meio ambiente, o acetato de metila é um forte candidato a combustível alternativo sendo que poderia ser utilizado para fazer uma transição, aos poucos, daqueles derivados do petróleo para uma fonte mais renovável. Essa pesquisa contribuiu tanto para a química computacional, de modo a ampliar o acervo bibliográfico dessa área quanto para os tecnólogos em biocombustíveis para desenvolver projetos e tecnologias mais sustentáveis de combustíveis renováveis.
Agradecimentos
Agradeço à DEUS pelas bençãos. Agradeço ao Profº. Dr. Alamgir Khan e à UEMA pela oportunidade. Agradeço à minha família, Arthur Sousa, Pedro Santos e Pedro Almeida pela ajuda e companheirismo.
Referências
ATKINS, J.; PAULA, J. Físico-Química, 8ª. Edição. Rio de Janeiro. LTC Editora. 2008.
BIZZO, W. A. EM 722-Geração, Distribuição e Utilização de vapor. Notas de Aula: Capítulo, 2012. Disponível em https://www.fem.unicamp.br/~em672/GERVAP2 .Acessado em 12/08/2023. Acessado em 24/08/2023
BRONDANI, L. N. Produção de biodiesel a partir de matéria-prima com alto teor de acidez: modelagem cinética e termodinâmica, simulação e otimização. 2022. Tese de Doutorado. Universidade Federal de Santa Maria. Disponível em: http://repositorio.ufsm.br/handle/1/27534. Acessado em 17/08/2023.
PEREIRA, S. L.; BAPTISTA, L. Estudo cinético da abstração do hidrogênio do acetato de metila. UERJ, 2022. Disponível em: https://doi.org/10.21826/viiiseedmol202040. Acessado em 18/08/2023.
CHEN, L. Chemical potential and Gibbs free energy. Mrs Bulletin, v. 44, n. 7, p. 520-523, Cambridge, 2019. Disponível em https://doi.org/10.1557/mrs.2019.162. Acessado em 18/08/2023.
GOLDENSTEIN, M.; AZEVEDO, R. L. S. Combustíveis alternativos e inovações no setor automotivo: será o fim da" era do petróleo”? Banco Nacional de Desenvolvimento Econômico e Social, 2006. Disponível em: http://web.bndes.gov.br/bib/jspui/handle/1408/2531. Acessado em 17/08/2023.
FEREY, G.; SERRE, C.; DEVIC, T.; MAURIN, G.; JOBIC, H; LLEWELLYN, P. L.; DE WERELD, G.; VIMONT, A.; DATURI, M.; CHANG, J.S. Why hybrid porous solids capture greenhouse gases? Chemical Society Reviews, v. 40, n. 2, p.550-562, 2011. Disponível em https://doi.org/10.1039/C0CS00040J. Acessado em 23/08/2023.
HAWKEN, Paul. Capitalismo natural. 1 ed. São Paulo: Editora Cultrix, 2000.
MARQUES, M. A.; BOTTI, S. O que é e para que serve a Teoria dos Funcionais da Densidade. Gazeta de física, v. 29, n. 4, p. 10-15, 2006. Disponível em: https://www.tddft.org/bmg/files/papers/5038049.pdf. Acessado em 18/08/2023.
MORGON, N. H.; CUSTODIO, R. Teoria do funcional de densidade. Química Nova, v. 18, n. 1, p. 44-55, 1995. Disponível em: http://submission.quimicanova.sbq.org.br/qn/qnol/1995/vol18n1/v18_n1_10.pdf. Acessado em 18/08/2023.
OCHTERSKI, J. W. Thermochemistry in gaussian. Gaussian Inc, v. 1, p. 1-19, 2000. Disponível em https://www.cup.uni-muenchen.de/ch/compchem/G98thermo.pdf. Acessado em 22/08/2023.
PONOMAREV, D. A.; TAKHISTOV, V. V. What are isodesmic reactions? Journal of chemical education, v. 74, n. 2, p. 201, 1997. Disponível em https://doi.org/10.1021/ed074p201. Acessado em 20/08/2023.
RIZZO, Guilherme Augusto. Simulações de dinâmica molecular aplicadas à combustão de biodiesel. Repositório Digital, 2013. Disponível em: https://www.lume.ufrgs.br/handle/10183/85658. Acessado em 13/07/2023.
SOUZA, A. M. G. P. Termodinâmica Química. CESAD, 2009. Disponível em: https://cesad.ufs.br/ORBI/public/uploadCatalago/19133916022012Termodinamica_Quimica_Aula_1.pdf. Acessado em 22/07/2023.
SOARES, C. V. Simulação de processos de adsorção molecular em material nanoporoso constituído por tereftalato e zircônio. Repositório Digital, 2016. Disponível em: https://repositorio.ufjf.br/jspui/handle/ufjf/1819. Acessado em 22/07/2023.
















