ÁREA
Química Computacional
Autores
Santos, P.L.L. (UEMA) ; Almeida, P.H.B. (UEMA) ; Viana, K.P. (UEMA) ; Sousa, A.S. (UEMA) ; Fernandes, R.M.T. (UEMA) ; Khan, A. (UEMA)
RESUMO
A escolha do tipo de combustível é fundamental para melhor eficiência de motores e máquinas térmicas. Logo as propriedades das substâncias a serem utilizadas devem ser levadas em consideração para que o alto desempenho e a taxa de queima sejam adequados para a execução de um trabalho. A presente pesquisa busca analisar parâmetros termoquímicos, por meio do método semiempírico DFT (teoria funcional da densidade) utilizando o conjunto de base Pople, através de reações hipotéticas do tipo isodesmicas nas temperaturas de 0K, 298K, 500K, 1000K, 1500K. Durante o tratamento de dados notou-se que a eficiência do álcool era visível entre o 2° e o 3° ponto de temperatura, apresentado processo reacionário espontâneo e energia útil para realização de trabalho, além de estabilidade na entropia.
Palavras Chaves
ISODESMICAS; COMBUSTIVEL ; TERMOQUIMICA
Introdução
Durante a Idade Média, além da energia eólica e dos moinhos de vento, muitos artefatos mecânicos foram desenvolvidos para otimizar a realização de atividade que exigiam força, inclusive máquinas que aproveitavam o vapor para gerar energia. Contudo, a Revolução Industrial que eclodiu durante a Idade Moderna deu início ao uso de combustíveis fósseis, principalmente o carvão mineral e o petróleo. O uso desses combustíveis, entretanto, gerou e ainda gera uma série de problemas, como ambientais, conflitos territoriais, mostrando-se necessário a busca de fontes de energia alternativas e renováveis. Uma das fontes mais utilizadas ultimamente principalmente pelos países desenvolvidos é a energia nuclear, uma das principais fontes de energia elétrica, oriunda da fissão nuclear. (ANEEL, 2009). Outra fonte renovável de energia é a eólica, levando muitos países a construírem potentes turbinas, apesar dessa fonte ter alguns impactos negativos, como a poluição visual, ruídos, interferir na rota de aves, podendo desencadear graves problemas ecológicos, além da interferência eletromagnética nos canais de comunicação. (Goldenstein e Azevedo, 2006) Além dessas fontes, a biomassa tem sido muito utilizada na produção de energia, sendo uma fonte orgânica que permite a produção de biocombustíveis, potenciais substitutos dos combustíveis fósseis, além de reduzir as emissões de dióxido de carbono. (PETROBRAS, 2006) Logo depois, o crescimento populacional e o desenvolvimento de novas tecnologias fizeram a demanda energética aumentar consideravelmente, gerando uma busca cada vez maior por combustíveis mais eficientes. - Os combustíveis são substancias que , ao sofrerem reações químicas com o oxigênio liberam energia térmica que pode ser convertida em energia mecânica e realizar trabalho mecânico, por exemplo – Historicamente, o ser humano fez o uso do carvão inicialmente no período da Idade Média, passando posteriormente pela Revolução Industrial e adicionando os combustíveis fosseis no período moderno. (FONSECA, 1972; HÉMERY; BEBIER; DELÉAGE, 1993). As mudanças climáticas estão diretamente ligadas com o consumo de petróleo e gás, pois seus derivados são utilizados todos os dias como combustíveis em automóveis e na indústria emitindo em grande quantidade gases como óxidos de enxofre e nitrogênio, e gases estufa como dióxido de carbono e metano. (BIZERRA, DE QUEIROZ e COUTINHO. 2018) A preocupação com o consumo de petróleo não é um assunto atual, pois de acordo com Seiffert (2010) foi a partir de 1960 que a preocupação em relação a poluição da atmosfera foi acentuada. (BIZERRA, DE QUEIROZ e COUTINHO. 2018)Mas foi na década de 1970 que ocorreu uma busca por soluções contra os efeitos negativos da queima de combustíveis. (LEITE e LEAL. 2007) Uma das alternativas para contribuir com o meio ambiente foi a utilização de biocombustíveis, que podem ser obtidos de maneira renovável pela fermentação de açucares e amidos podendo ter como matérias-primas: milho, beterraba, trigo, mandioca e a cana de açúcar. Logo, é também atribuído a sua produção locais com grande potencial agrícola – como o Brasil - e a grande parte da produção mundial se baseia nas tecnologias de primeira geração, ou seja, a partir de técnicas de fermentação e esterificação (açúcares, amidos, óleos vegetais, gordura animal). O butanol é um álcool, composto orgânico de forma estrutural C4H10O que possui muitas vantagens tanto para motores a combustão, quanto para a indústria e ao meio ambiente. Pode ser produzido a partir de biomassa de baixo custo, apresentando caráter renovável e econômico; pode ser usado na indústria como solvente e na produção de energia; apresenta baixo índice de corrosão em comparação com o etanol. Além disso, pode ser utilizado como complemento em misturas com outros combustíveis como a gasolina e o etanol sem perder a eficiência na combustão. (NATALENSE.2013) A química computacional, que cresceu em paralelo com a mecânica quântica, apresenta hoje metodologia semiempíricas capazes de determinar por meio de funções teóricas as propriedades de substancias, materiais ou compostos. Tendo importância também na previsão do comportamento de sistemas. Além de ter uma vantagem econômica em relação aos métodos empíricos (ensaios), é uma ferramenta versátil para o entendimento de mecanismos fundamentais de reações (picos de comportamento) e informações uteis sobre o comportamento do material a ser estudado. (CARIDADE e RODRIGUES, 2021) Logo, o objetivo deste trabalho é fazer uma análise teórica utilizando a química computacional para determinar as propriedades termoquímicas e cinéticas de reações hipotéticas do tipo isodesmicas da decomposição térmica do nbutanol com o intuito de compreender suas propriedades termoquímicas e comportamento de cinética; como base será utilizado o método DFT(B3LYP) com variações de temperaturas.
Material e métodos
Foi feita a determinação das reações isodesmicas a serem utilizadas. Como a base das reações é a molécula de nbutanol então buscou-se por derivações mais elementares como a retirada de água (H2O), gás metano (CH4) e gás hidrogênio por exemplo. Então estabeleceu-se duas reações químicas contendo como produtos dois tipos de espécimes químicos e outras duas reações apresentado mais de dois espécimes químicos como resultado. Em seguida, foi feita a utilização de softwares de modelagem para a pesquisa. Nesse caso, utilizou-se o programa Gaussian09 e Gaussianview para fazer a modelagem das molecas em formato 3D e calcular por meio do método DFT (Teoria Funcional da Densidade) juntamente com o Conjunto de Base Pople (B3LYP) para determinar as propriedades termodinâmicas semiempíricas pelo computador. Inicialmente, utilizou-se o programa Gaussview para modelar as moléculas e radicais de interesse, a interface disponibilizava átomos e suas variações com todos os tipos de ligação química possível (simples, dupla, tripla e ressonância, além da arranjo geométrico espacial adequado) e a função de deletar, adicionar e mudar o comprimento e o ângulo entre os átomos. Em seguida, após a modelagem molecular, utilizou-se a função “Gaussian Calculation Setup”, podendo ser acessada pelo comando “Ctrl+G”; a atividade determinada foi de otimização e frequência, identificada como “ot + freq.” – a otimização é o processo que calcula e reorganizaa estrutura química em seu estado de menor energia, e a frequência para calcular o conjunto de funções teóricas. Na aba de ‘método”, identificada como “Method”, programou-se com DFT, conjunto de Base Pople (B3LYP) e adicionou-se a condição de temperatura, que seriam os pontos determinados e estudados. Para cada espécime química, as temperaturas calculadas forma de 0K, 298K, 500K, 1000K e 1500K. Após a máquina calcular as funções, foi emitido um arquivo de saída do programa na forma de ‘.LOG’ que abriu a molécula otimizada e junto um arquivo de notas – formato de bloco de notas – com as propriedades termoquímicas encontradas. E para tratar os dados, utilizou-se o programa Excel para melhor organizar cada propriedade de cada espécime químico estudado, além disso foi feito a conversão das unidades de medida, pois o programa fornece os resultados em Hartree/ partícula, Kcal/mol e cal/mol. Em seguida, calculou-se a Energia livre de Gibbs de formação para algumas moléculas “chave” das reações de decomposição térmica para ser feita uma análise com dados da literatura e dos bancos de dados existentes para a comparação dos resultados. O computador utilizado tem as seguintes configurações: modelo Positivo, processador Intel(R) Atom (TM) x5-z8330 CPU@1,44GHz; ram instalada de 4,00 GB; sistema operacional de 64 bits; Windows 10 Home Single Language.
Resultado e discussão
Nota-se que em relação a capacidade térmica das moléculas de estudo existe um
comportamento quase padrão em relação as variações de temperatura. Para a
molécula principal, nbutanol, a medida em que em a temperatura aumenta, sua
capacidade térmica cresce mais que as outros espécimes químicos, logo para que
tal aumente uma unidade calorifica é necessário investir altos valores de
energia apresentando uma capacidade de estabilidade em decorrência da
decomposição térmica. Vale ressaltar que tal estudo utiliza como base a
propriedade de Capacidade térmica e não de Calor especifico sensível pois trata-
se de uma análise isolada do caso de cada molécula, analisando-os como corpo e
não como substancia. Os produtos resultados das reações isodesmicas apresentam –
com exceção do C4H8 – em decorrência do aumento de temperatura em especial ao
gás hidrogênio e ao C2H4.
Percebe-se que a variação de entalpia apresenta aumento significante de
seus valores entre o ponto 298K e 500K, uma vez que nessa faixa ocorre a
autoignição.
De acordo com os valores da energia livre de Gibbs, a variação mesmo em
temperaturas baixas apresenta valores negativos representando atividade
espontânea e consequentemente capaz de realizar trabalho, mas é entre os pontos
298K e 500K que se nota uma maior variação tendendo a grande eficiência dos
produtos das reações (que na maioria são inflamáveis, explicando a ação) e
mostrando grande energia útil para sua utilização.
A seguir as relações da energia livre de Gibbs, da Entropia e da
Entalpia de cada reação de decomposição do butanol.
Nota-se que os gráficos da reação 1 e 3 possuem semelhanças assim como os 2 e 4.
Nota-se que a Energia Livre de Gibbs decai gradativamente à medida que a
temperatura aumenta, sendo em alguns casos a sua inercia (reação 2 e 4).
As reações trata-se de hipóteses de decomposição térmica, mas que
respeitam os parâmetros termoquímicos.
Nas reações 1 e 3, notamos que a ∆G, variação da energia livre de
Gibbs, diminui bastante entre a medida em que se aumenta a temperatura. No
ponto 298K já possível notar uma mudança em seu comportamento, mas
especificamente entre 298K e 500K, o que está próximo da temperatura dos motores
a combustão e representa um resultado de eficiência, pois quando ∆G < 0
consideramos o processo reacionário espontâneo, logo realiza trabalho, logo é
possível dizer que possui semelhança com as notícias e com a literatura
referentes a NATALENSE, 2013.
Analisando as reações 2 e 4, nota-se que ∆G, variação da energia livre
de Gibbs encontra-se em equilíbrio dinâmico, mas em termos matemáticos é visível
que seus valores diminuem à medida que se aumenta a temperatura. Contudo, esse
conjunto de reação mostra que ainda há energia útil para a realização de um
trabalho de forma espontânea em no sistema mesmo que não tenha uma diferença
significativa. Tal hipótese de um desempenho menor em relação as reações 1 e 3
se deve pela escolha dos produtos da decomposição do nbutanol, pois nesses casos
(2 e 4) temos a produção de 3 tipos diferentes de espécies moleculares, entanto
nas reações 1 e 3 tem a formação de 2. A quantidade dos tipos de produtos deve
interferir na questão da energia necessária produzida para trabalho no sistema.
A molécula de C2H4 foi uma selecionada para fazer uma comparação com a
literatura e os dados já existentes, e segundo Holm, T., em 1974 o valor
encontrado da entropia de formação a 298k foi de -82,62 (+/-0,48) kcal/mol e
segundo o mesmo, em 1981, em outras pesquisas encontrou o valor de -71,51 (+/-
0,53) utilizando o método RSC. Logo, o resultado encontrado neste trabalho foi
de aproximadamente -79,67 kcal/mol. O motivo da diferença pode ser o fato de que
no Gaussian o estudo foi feito com base em uma única unidade molecular, em
comparação com uma reação empírica que envolve um conjunto. Contudo, o resultado
foi muito próximo, e é utilizado para validação das outras substâncias
envolvidas.
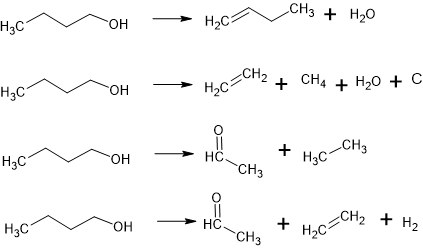
Reações isodesmicas selecionadas para a analise da \r\ndecomposição termica do butanol.
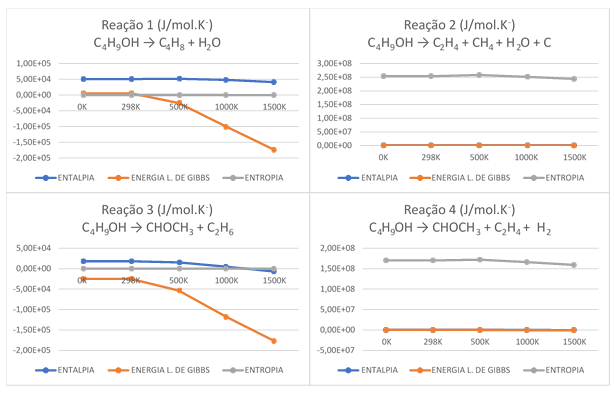
Variação das propriedades das reações isodesmicas \r\nselecionadas, em relação a entalpia, energia livre \r\ne entropia.
Conclusões
Com o uso da química computacional, utilizando o método DFT(B3LYP) foi possível determinar de maneira semiempírica as propriedades termoquímicas para a investigação do nbutanol e sua eficiência como biocombustível. O uso dessa tecnologia ajuda as pesquisas por ser de baixo custo econômico, pois não há a necessidade de gasto de reagentes e por ter resultados muito próximos dos empíricos, além de contribuir bastante com a literatura e em ramos da engenharia, principalmente na química de materiais. O nbutanol é um álcool que vem sendo bem visto pelas empresas e pesquisadores como uma alternativa mais viável e eficiente, pois possui uma viabilidade para ser incrementado tanto sozinho quanto junto a outros combustíveis para alimentação de automóveis e maquinas térmicas. Além disso, a presente pesquisa encontrou resultados que favorecem o seu uso e vão de encontro com a literatura, porém ,em algumas das hipóteses testadas, encontrou-se algumas situações onde a eficiência da reação da energia de trabalho não foi tão satisfatório quanto o esperado, provando que mesmo sendo um forte concorrente dos combustíveis alternativos ainda é preciso ter uma noção maior de seu comportamento em uma variedade maior de hipóteses. E suas propriedades são muito favoráveis e pode ser utilizada nas engenharias, como a mecânica por exemplo, para o desenvolvimento de maquinas e motores capazes de utilizar o nbutanol – seja de maneira independente como misturado a outro combustível – para aproveitar o máximo de seu desempenho e ajudar/incentivar a sociedade a buscar, desenvolver e conviver com tecnologias mais sustentáveis.
Agradecimentos
Agradeço à DEUS pelas bençãos. Agradeço à CNPq pelo fomento. Agradeço ao Prof. Dr. Alamgir Khan e à UEMA pelas oportunidades. Agradeço à minha família, à Karliane Viana, Pedro Santos e Pedro Almeida pela ajuda e companheirismo.
Referências
ANEEL. Parte III: Fontes não renováveis - Energia Nuclear. Intranet Ipen, 2009. Disponível em https://intranet.ipen.br/portal_por/conteudo/biblioteca/arquivos/atlas_par3_cap8.pdf. Acessado em 17/08/2023.
BIZERRA, A. M. C.; DE QUEIROZ, J. L. A.; COUTINHO, De. A. M. O impacto ambiental dos combustíveis fósseis e dos biocombustíveis: as concepções de estudantes do ensino médio sobre o tema. Revista Brasileira de Educação Ambiental (RevBEA), v. 13, n. 3, p. 299-315, 2018. Disponível em https://doi.org/10.34024/revbea.2018.v13.2502. Acessado em 18/07/2023
FONSECA, R. S. Iluminação elétrica. São Paulo, SP: McGraw-Hill do Brasil, 1977. p.136
GOLDENSTEIN, M.; AZEVEDO, R. L. S. Combustíveis alternativos e inovações no setor automotivo: será o fim da" era do petróleo”? Banco Nacional de Desenvolvimento Econômico e Social, 2006. Disponível em: http://web.bndes.gov.br/bib/jspui/handle/1408/2531. Acessado em 17/08/2023.
HÉMERY, D.; BEBIER, J. C.; DELÉAGE, J. P. Uma História da Energia. Brasília: Editora Universidade de Brasília. 1993. Disponível em https://www.memoriadaeletricidade.com.br/acervo/18237/uma-historia-da-energia. Acessado em 15/08/2023.
HOLM, T.. The thermochemistry of alkyllithium reagents. Journal of Organometallic Chemistry, v. 77, n. 1, p. 27-30, 1974. Disponível em https://doi.org/10.1016/S0022-328X(00)89416-4. Acessado em 20/07/2023.
HOLM, T. J. Chem. Soc., Perkin Trans. II. 1981. Disponível em https://webbook.nist.gov/cgi/cbook.cgi?Name=C2H6&Units=CAL&cTG=on&cTC=on&cTP=on&cTR=on#ref-37. Acessado em 22/08/2023.
LEITE, R. C. C.; LEAL, M. R. L. V. O biocombustível no Brasil. Novos estudos CEBRAP, p. 15-21, 2007. Disponível em https://doi.org/10.1590/S0101-33002007000200003. Acessado em 20/08/2023
NATALENSE, Júlio César. Prospecção tecnológica do biobutanol no contexto brasileiro de biocombustíveis. 2013. Tese de Doutorado. Universidade de São Paulo. Disponível em https://www.teses.usp.br/teses/disponiveis/85/85131/tde-13082013-091628/en.php. Acessado em 15/08/2023.
OCHTERSKI, J. W. Thermochemistry in gaussian. Gaussian Inc, v. 1, p. 1-19, 2000. Disponível em https://www.cup.uni-muenchen.de/ch/compchem/G98thermo.pdf. Acessado em 22/08/2023.
PETROBRAS. Biocombustíveis. 50 perguntas e respostas sobre este novo mercado. 2006. Disponível e http://www.ecoclima.org. br/br/Informacoes%20Tecnicas/Cartilha_ Biocombustiveis.pdf. Acesso em: 04/02/23.
SEIFFERT, Mari Elizabete Bernardini. Gestão ambiental: instrumentos, esferas de ação e educação ambiental. Editora Atlas, 2007.
















