ÁREA
Química Verde
Autores
Santos Junior, C.R. (UFPA) ; Maia, H.S. (UFPA) ; Aleixo, V.F.P. (UFPA)
RESUMO
Este estudo explora a possível utilização do gás hidrogênio gerado como subproduto da eletrocloração. Na eletrocloração ocorre a eletrólise da água salgada, resultando hipoclorito de sódio e gás hidrogênio como alguns dos produtos da reação. Destacamos o potencial de regiões litorâneas para gerar hidrogênio de forma sustentável por possuir grande abundância de água salgada e fácil instalação de fontes renováveis de energia, como solar e eólica. Além disso, enfatizamos o impacto ambiental positivo, reconhecemos desafios de infraestrutura e discutimos perspectivas promissoras para a produção de hidrogênio, impulsionando a sustentabilidade energética.
Palavras Chaves
Sustentabilidade; Eletrocloração; Hidrogênio
Introdução
A jornada de descoberta na eletrólise da água tem raízes profundas, remontando ao tempo de Cavendish, um cientista visionário que separou a água em dois misteriosos gases, denominados "ar fictício" e "ar inflamável," revelando posteriormente que o segundo era o gás hidrogênio. Cavendish também desvendou a intrigante possibilidade de inflamar hidrogênio ao misturá-lo com o ar, resultando na produção de água. Essas revelações intrigantes provocaram a curiosidade de Lavoisier, que, por sua vez, se aventurou a realizar o processo inverso, dissociando as moléculas de água em hidrogênio e oxigênio, para depois reunir esses elementos e uma pequena quantidade de água. Em 1785, esse esforço culminou na confirmação de que o hidrogênio e o oxigênio eram os blocos fundamentais da água, oficialmente batizando o processo como "eletrólise" em 1789. Desde então, a pesquisa e o desenvolvimento na eletrólise da água se voltaram para o uso de hidrogênio como uma fonte de energia sustentável de fontes renováveis, buscando reduzir sobrepotenciais e custos em aplicações em larga escala. Uma direção promissora inclui a exploração de novos catalisadores à base de metais não preciosos e a consideração de alternativas como o uso de água salgada como eletrólito. Hoje, a eletrólise da água demanda água pura, uma commodity cara e limitada. Assim, surge a perspectiva de uma tecnologia que aproveita a vasta reserva de água salgada, representando 96% do total, espalhada por 70% da superfície terrestre. Isso abriria portas para o potencial energético sustentável das áreas costeiras áridas, permitindo a utilização de fontes renováveis como energia solar e eólica. Além disso, a natureza próxima do pH neutro da água do mar torna a eletrólise mais prática, com maior durabilidade dos equipamentos e segurança operacional, especialmente nas zonas costeiras ideais para a produção de hidrogênio a partir da eletrólise da água salgada (CAMARGO, 2021). Quando os eletrolisadores são alimentados por uma fonte de energia elétrica renovável ou nuclear, o hidrogênio produzido é considerado "verde" devido à ausência de emissões de dióxido de carbono em sua cadeia de produção. A eletrólise da água do mar é frequentemente empregada na produção de hipoclorito de sódio, utilizado como agente biocida em indústrias de grande porte que utilizam água do mar como fluido de resfriamento. Nas instalações de eletrocloração da água do mar, o hidrogênio gerado costuma ser diluído e liberado na atmosfera. Atualmente, as pesquisas relacionadas ao hidrogênio estão focadas principalmente na geração de energia elétrica e térmica por meio das células a combustível. Esses dispositivos têm a capacidade de converter energia química em eletricidade e energia térmica de forma limpa e ecologicamente correta. As células a combustível são dispositivos eletroquímicos que realizam essa conversão direta, operando de forma contínua e gerando corrente contínua(HENRIQUES, 2022).
Material e métodos
Inicialmente, foram realizadas investigações para compreender a eletrólise da água, particularmente da água salgada, com o objetivo de justificar a utilização do hidrogênio gerado como subproduto do processo de eletrocloração e identificar as reações químicas envolvidas. Permitindo dimensionar as taxas de produção dos produtos envolvidos no procedimento. Uma parte da reação eletroquímica da salmoura ocorre no anodo da célula eletrolítica, corforme mostra a equação I: 2Cl- ⇒ Cl2+2e-. Enquanto a outra parte ocorre no cátodo da célula, conforme mostra a equação II: 2H2O + 2Na+ + 2e- ⇒ 2NaOH + H2. Na situação proposta, as células não apresentam separação entre cátodo e ânodo, permitindo que o cloro produzido reaja com o hidróxido de sódio, resultando na formação de hipoclorito de sódio no meio reacional, conforme representado na equação III: 2NaOH + Cl2 ⇒ NaClO + NaCl + H2O. Vale lembrar que o hidrogênio é gerado como subproduto da reação no cátodo. Utilizando das equações I, II e III, pode-se chegar a uma reação geral para caracterizar a eletrocloração, conforme mostra a equação IV: H2O + 2Na+ + 2Cl- ⇒ 2NaClO + NaCl + H2. Para encontrar o valor das massas dos produtos nessas condições basta efetuar a multiplicação das suas quantidades de matéria(mols) pela suas respectivas massas molares, obtidas a partir de cálculos com auxílio de uma tabela periódica. Dessa forma, efetuou-se os calculas para o hipoclorito de sódio, o gás hidrogênio e o cloreto de sódio: Massa de NaClO:2mol × 74,44g/mol = 148,88g; Massa de H2: 1mol × 2g/mol = 2 g; Massa de NaCl: 1mol × 58,44g/mol = 58,44g.
Resultado e discussão
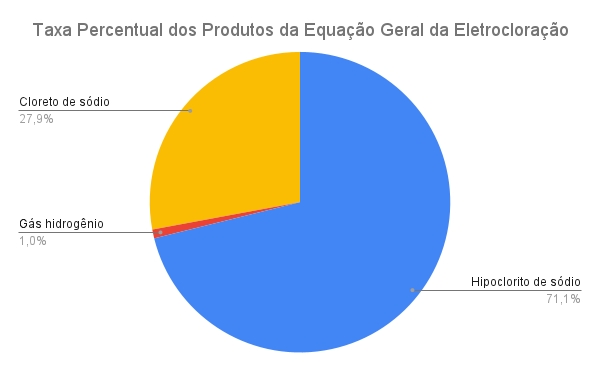
Assim, com os resultados de massas gerados pela eletrocloração e uso de uma
planilha eletrônica, o Gráfico 1 foi gerado para indicar os percentuais dos
produtos adquiridos pelo processo, visto que a nas mesmas condições não haverão
alterações nas proporções percentuais de massa independente da quantidade de
matéria utilizada nos reagentes. Vale lembrar que se a eletrólise ocorrer
com o uso de energias renováveis, o gás hidrogênio gerado é caracterizado como
"hidrogênio verde" e é bem mais valorizado devido ao seu caráter ambiental. Por
fim, percebe-se que a razão de massa gerada de hipoclorito de sódio por massa
gerada de gás hidrogênio é de aproximadamente 75, indicando uma necessidade de
uma futura análise econômica para saber se esse aproveitamento é viável
financeiramente.
Fonte: Autores, 2023.
Conclusões
Logo, o gás hidrogênio obtido por eletrólise é uma solução promissora para impulsionar a transição energética rumo a um futuro mais sustentável. O litoral brasileiro, com suas condições geográficas e climáticas favoráveis, emerge como uma região promissora para a produção de hidrogênio verde devido o seu potencial para o uso de energia alternativas. Ademais, o estudo demonstrou que a produção de hipoclorito de sódio, produto final da eletrocloração da água salgada, pode resultar no desperdício de gás hidrogênio. Para cada tonelada de NaClO produzido, aproximadamente 13,4 kg de hidrogênio são desperdiçados, levando em consideração a proporção encontrada a partir dos cálculos. Isso ressalta a importância de ajustar o processo para se fazer uso desse hidrogênio, desde de que seja economicamente viável. Desse modo, este trabalho oferece insights valiosos sobre a viabilidade e o potencial do hidrogênio verde obtido por eletrólise para a construção de um futuro energético mais limpo e sustentável. Considerando os avanços tecnológicos, os aspectos econômicos e ambientais, bem como as oportunidades de mercado.
Agradecimentos
Referências
CAMARGO; C.A.D. Catalisadores contendo metais de transição sobre estruturas de nitrogênio e carbono para produção de hidrogênio por meio da eletrólise de água salgada. São Paulo: Instituto de Pesquisas Energéticas e Nucleares, 2021.
HENRIQUES, C.L.;LOURENÇO, G.R. Estudo do beneficiamento do hidrogênio coproduzido por eletrocloração da água do mar em usinas nucleares. Brasil: Universidade Federal do Rio de Janeiro, 2022.