ÁREA
Química Verde
Autores
Moura, H.O.M.A. (UFRN) ; Câmara, A.B.F. (UFRN) ; Souza, E.C. (UFRN) ; Silva, B.R. (UFRN) ; Pereira, E.S. (UFRN) ; Costa, J.L.B. (UFRN) ; Silva, L.C.J. (UFRN) ; Campos, L.M.A. (UNIFACS) ; Carvalho, L.S. (UFRN)
RESUMO
A celulose é um dos mais importantes biopolímeros naturais e tem sido estudada na literatura como fonte renovável para a produção de plataformas químicas essenciais para a indústria de biorrefinaria, capaz de ser convertida em diversos compostos químicos. A separação da celulose ainda é desafiadora, devido a natureza recalcitrante da biomassa. Neste trabalho, foram avaliados o pré-tratamento combinado ácido/peróxido-alcalino (APA), da cavitação ultrassom (US) e da associação destes dois métodos (USA + PA) foi estudada em diferentes condições de biomassas residuais do Brasil: bagaço de cana-de-açúcar e sabugo de milho. A eficiência do tratamento, foi avaliada através da deconvolução de picos de DRX e seus parâmetros de cristalinidade, assim como análises de MEV e FTIR.
Palavras Chaves
Biomassas residuais; Celulose branqueada; Pré-tratamento combinado
Introdução
A biomassa lignocelulósica é o material biológico mais abundante e renovável disponível na Terra, sendo composto principalmente por celulose, hemicelulose e lignina, que estão fortemente associados entre si (Kumar; Sharma, 2017), podem ser utilizadas como matéria-prima de biorrefinarias para a produção de inúmeros compostos químicos, desde novos polímeros até moléculas plataforma de alto valor agregado (Werpy; Petersen, 2004). O benefício desta biomassa se inicia com etapas de pré-tratamentos químicos, físicos ou biológicos, para que ocorra a ruptura da sua estrutura complexa e recalcitrante, promovendo o aumento da acessibilidade da biomassa (redução da recalcitrância) e a separação das suas frações com elevada pureza (Chen et al., 2017). Dentre as principais frações da lignocelulose, a celulose é a mais estudada e utilizada para fins industriais. Este polímero natural é composto por unidades de repetição que consistem em dois anéis de anidroglucose unidos por uma ligação β-1,4 glicosídica (Ciolacu et al., 2012). Ao passar pela extração, a celulose que é naturalmente encontrada na forma de seu alomorfo cristalino de tipo I (cadeias paralelas) tende a mudar de conformação para assumir a estrutura mais reativa do alomorfo tipo II (cadeias antiparalelas), podendo, a depender da efetividade dos tratamentos realizados, tornar-se parcial ou completamente amorfa (Moura et al., 2018). Alguns dos principais tratamentos para extração da celulose são os que utilizam os métodos com explosão a vapor, micro-ondas, ultrassom, pré-tratamentos ácidos e básicos, dissolução com solventes orgânicos e líquidos iônicos, organosolv e peróxido de hidrogênio alcalino, entre outros (Chen et al., 2017; Kumar; Sharma, 2017). Porém, os métodos de pré-tratamento combinados tem sido o foco dos pesquisadores da área, que buscam unir as principais vantagens dos diversos tratamentos para aumentar a acessibilidade da biomassa e prepará-la para os processos de branqueamento, a fim de obter uma celulose de alta pureza e reatividade (Campos, 2017). O pré-tratamento combinado utilizando ácido diluído, seguido de uma etapa de tratamento com peróxido de hidrogênio em pH elevado (ácido/peróxido-alcalino, APA), tem se mostrado um processo promissor para a remoção de hemicelulose e lignina e a formação de uma estrutura lignocelulósica mais acessível (Assumpção et al., 2016; Campos, 2017; Martínez-Patiño et al., 2017). O tratamento com ácido sulfúrico diluído, por exemplo, é capaz de hidrolisar com eficiência a fração hemicelulósica sem degradar significativamente a celulose (Chandel et al., 2014), e o uso de um sistema com hidróxido de sódio e peróxido de hidrogênio possibilita a remoção seletiva de lignina por reações de oxidação e hidrólise (Rabelo et al., 2014). A efetividade destes tratamentos químicos pode ainda ser otimizada através da utilização de uma etapa assistida por um tratamento físico como a cavitação ultrassom, que promove a ruptura das paredes celulares devido a fenômenos mecânicos, térmicos e químicos, melhorando a ação do reagente presente no sistema (Chemat et al., 2017). A eficiência destes tratamentos é comumente determinada com base em uma análise composicional padrão que envolve uma série de experimentos demorados, produz efluentes químicos e necessita de uma quantidade significativa de biomassa (Sluiter et al., 2012). Por isso, alguns trabalhos buscam avaliar o uso de técnicas analíticas convencionais, como a difratometria de raios X (DRX) (Park et al., 2010; Moura et al., 2018), em conjunção a ferramenta estatística de deconvolução de picos (separação de picos presentes em uma “curva soma”). A aplicação deste método matemático permite uma determinação mais simples e eficiente de características importantes, associadas à cristalinidade, a acessibilidade e a composição da amostra tratada, parâmetros de grande importância na análise do efeito dos tratamentos nas fibras das diferentes biomassas, e que impactam diretamente na reatividade e pureza da celulose isolada posteriormente. Este trabalho contribui com a avaliação da efetividade do pré-tratamento combinado ácido/peróxido-alcalino (APA) para aumentar a acessibilidade de biomassas residuais comuns do Brasil: bagaço de cana-de-açúcar e sabugo de milho, a partir de diferentes condições e incluindo uma etapa assistida por ultrassom. Os efeitos dos pré-tratamentos foram estudados sobre a morfologia das biomassas através de imagens de microscopia eletrônica de varredura (MEV), enquanto a análise composicional dos materiais in natura foi realizada através da metodologia padrão desenvolvida pelo laboratório NREL. Além disso, as biomassas pré-tratadas foram analisadas através da deconvolução de picos dos difratogramas de raios X e de seus parâmetros de cristalinidade, cujos resultados foram associados às bandas presentes nos espectros de infravermelho com transformada de Fourier (FTIR) para a determinação do pré-tratamento mais eficiente para cada biomassa.
Material e métodos
As sínteses deste trabalho foram desenvolvidas pela equipe de pesquisa do LABTEN e realizadas no Laboratório de Síntese e Caracterização de Petróleo III-IQ-UFRN. As caracterizações foram obtidas em parceria com a central analítica do instituto de química da UFRN. Reagentes e equipamentos: Os reagentes utilizados foram ácido sulfúrico (H2SO4), 95-98%, peróxido de hidrogênio (H2O2), 30%, hidróxido de sódio (NaOH) em micropérolas, 98% e álcool etílico, 99%, ácido acético glacial, P. A., clorito de sódio, P. A. e isopropanol, 99,5%. Os equipamentos foram peneiras série Taylor 752ª, evaporador rotativo 802D, aquecedor com banho-maria 550, balança analítica TE214S, moinho de facas Hamilton Beach, estufa Q-317B252, bomba de vácuo 131B, agitador magnético com aquecimento MA100M36 e agitador mecânico RW 20. Tratamentos combinado ácido/peróxido-alcalino (APA), ultrassom (US) e (US + APA): A obtenção da celulose foi feita baseada nos procedimentos metodológicos realizados por Moura (2019). A metodologia consiste em tratar a biomassa previamente, passando por lavagem seguida de secagem a 80 ºC por 24h, em seguida é feita uma moagem e peneiração até atingir um tamanho de 25-50 mesh, após isto uma nova secagem é realizada. Em sequência as biomassas são submetidas aos pré- tratamentos, que são tratamento US, tratamento (APA) e tratamento USA + PA. Após estas etapas as biomassas foram lavadas e filtradas, e em seguida passaram pelo processo de branqueamento até resultar na celulose branqueada (Campos, 2017; Moura 2018). Avaliação da eficiência dos pré-tratamentos e das celuloses branqueadas: A eficiência dos tratamentos foi avaliada por difração de raios X, que é capaz de determinar a cristalinidade e a acessibilidade da fração celulósica quando aliada aos cálculos de parâmetros de cristalinidade, que variam com o maior grau de ruptura da lignocelulose; e por espectroscopia de FTIR, que mostra as bandas características dos grupos químicos dos principais componentes das biomassas e é capaz de detectar a variação das suas intensidades, após os pré-tratamentos (Moura et al., 2018). A aquisição dos espectros de FTIR foi realizada no espectrômetro IRAffinity-1 (Shimadzu) com sistema de refletância total atenuada (ATR) MIRacle (PIKE Technologies). Os padrões de difração de raios X das amostras foram analisados em um equipamento Bruker D2Phaser equipado com detector Lynxeye e radiação de cobre (CuKα, λ=1,54 Å). A deconvolução dos difratogramas foi realizada através do método aplicado por Park e colaboradores (2010), utilizando o software PeakFit v4.12 (Systat Software, Inc.). Assim, uma série de operações de iterações realizadas pelo programa, a fim de encontrar o melhor ajuste dos picos a curvas Gaussianas com base na obtenção do menor valor de erro padrão (SE, standard error), coeficiente de determinação (R2) mais próximo de 1 e maior valor de F (teste de Fischer) possível, sendo considerado um ajuste satisfatório quando F>10.000 (Park et al., 2010).
Resultado e discussão
Neste tópico serão apresentados e discutidos os resultados obtidos de análise
composicional das biomassas in natura, incluindo apenas a deconvolução dos dados
de DRX e da análise de MEV-FEG levando a uma discussão dos parâmetros de
cristalinidade como ferramenta para avaliar os efeitos dos pré-tratamentos
aplicados.
CARACTERIZAÇÃO DAS BIOMASSAS IN NATURA: A caracterização composicional das
biomassas in natura foi realizada de acordo com a metodologia padrão utilizada
atualmente no Brasil e no mundo, através do procedimento analítico NREL/TP-510-
42618, e os resultados obtidos, juntamente com os dados composicionais inferidos
em outros trabalhos.
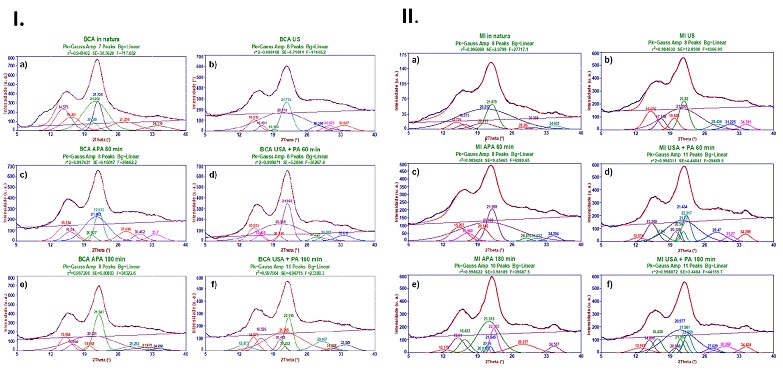
Difratogramas de raios X, deconvolução e parâmetros de cristalinidade: Para as
deconvoluções dos dados de DRX trouxemos as amostras de BCA e MI (Figura 1.I. e
1.II.), que mostram com mais detalhes as mudanças ocorridas após os pré-
tratamentos.
A deconvolução para a amostra de BCA in natura revelou picos referentes aos
planos de rede (1-10), (110) e (200) característicos de celulose nativa Iβ em 2θ
de 14,6°, 16,3° e 21,7° (French, 2014), com uma larga banda referente a presença
de material amorfo (principalmente hemicelulose e lignina) posicionada na região
citada na literatura (Park et al., 2010), em 2θ de 21,2°. Os picos dos planos
(1-10) e (110) comumente se apresentam como uma única banda larga nessa região
devido a presença de material amorfo (El Oudiani et al., 2011).
Uma leve assimetria na base do pico principal é observada em ~20°, devido a um
ombro formado pelos picos (012) e (102) em 20,5°, mais definido em amostras de
celulose branqueada. Entre 25° e 33° há uma banda referente a somatória da
contribuição de picos menores de celulose, e em 34,1° observa-se uma banda cuja
principal contribuição é do plano de rede (004), presente em celuloses Iβ e II
(French, 2014). Apesar do bom ajuste observado na região que contém os picos
cristalinos e a banda amorfa, a interferência causada pela grande complexidade
da biomassa natural até aproximadamente 2θ de 13° dificultou a obtenção de bons
resultados estatísticos, alcançando R2 = 0,948 e F = 717, 68, bem abaixo do
desejado (F>10.000).
O padrão característico de celulose in natura continua no decorrer dos
tratamentos com valores satisfatórios de R2 (>0,996) e F (>17.445,2), com uma
variação mais pronunciada na área da fração amorfa, até que varia de forma mais
significativa no difratograma obtido para a amostra tratada com sonicação na
etapa ácida, seguido da etapa peróxido-alcalino por 180 min (USA + PA 180 min).
A diferença mais notória é a formação de uma pequena assimetria no topo do pico,
que pôde ser revelada através da deconvolução como o início da transformação do
alomorfo nativo para a celulose de tipo II, cujo pico em 21,4° do principal
plano de rede, o (020), ocorre em uma região de 2θ abaixo do usual para a
celulose de tipo I, mais próxima de 21° (Cheng et al., 2011). Além deste, os
picos referentes aos planos (1-10) e (110) de celulose II ficaram evidentes em
12,9° e 20,5°, respectivamente, como mostrado na Figura 1. I.
As amostras de BCA submetidas ao tratamento APA convencional (APA 60 min e APA
180 min) apresentaram um aumento de cristalinidade em relação a biomassa in
natura, que pode ser atribuído não só à remoção de lignina e hemicelulose, mas
também a organização das cadeias de celulose. O aumento mais significativo
ocorreu no tratamento onde a etapa com peróxido-alcalino durou 60 min, onde o
CrId passou para 61,92% e o FWHM diminuiu, aumentando o tamanho dos domínios
cristalinos. Com o aumento no tempo de tratamento (180 min) a cristalinidade
voltou a cair (55,69%) e a maior exposição ao meio básico promoveu a
desorganização das cadeias celulósicas e reduziu o tamanho dos cristalitos,
aumentando o FWHM para 2,41°.
Os difratogramas deconvoluídos das amostras de sabugo de milho (MI) natural e
pré- -tratado estão apresentados na Figura 1.II. A amostra de sabugo de milho
(MI) in natura apresentou perfil de celulose nativa Iβ, com picos em 2θ de
14,7°, 16,3° e 21,9° correspondentes aos planos de difração (1-10), (110) e
(200), respectivamente. Essa característica foi mantida nas amostras tratadas
com US em suspensão de água e com o tratamento APA convencional de menor duração
(APA 60 min), entretanto, observou-se o surgimento de picos característicos de
celulose II nas amostras MI USA + PA 60 min, MI 180 e MI USA + PA 180 min.
Apesar de a cavitação ultrassom ser tradicionalmente conhecida como um pré-
tratamento físico com alta eficiência para romper a estrutura lignocelulósica e
desorganizar os domínios celulósicos cristalinos, ele também promove a produção
de radicais oxidantes que atacam quimicamente a matriz de biomassa (Chemat et
al., 2017). Além disso, o ultrassom pode romper as ligações α-O-4 e β-O-4 na
lignina, causando a remoção deste composto através da ação de pequenas bolhas de
cavitação. As bolhas formadas crescem até um tamanho crítico e se tornam
instáveis, colapsando violentamente e atingindo pressões de até 1800 atmosferas
e temperaturas de 1727–4727 °C (Hassan; Williams; Jaiswal, 2018). Assim, como
descrito por Sinha e Rout (2009) e observado para o tratamento APA nas outras
duas biomassas avaliadas neste trabalho, o uso de US pareceu favorecer a
formação de novas ligações de hidrogênio entre as cadeias celulósicas e a maior
ordenação delas através da quebra de suas ligações com a estrutura da lignina
presente na biomassa do sabugo de milho.
O tratamento APA 180 não assistido por US promoveu o aumento da cristalinidade
da biomassa, bem como o APA 60 min, além da formação de uma nova fase de
celulose II de alta cristalinidade (L = 8,67 nm). Os tratamentos assistidos por
US também promoveram a formação de cristalitos de celulose II, porém, houve um
decréscimo significativo no índice de cristalinidade e no valor de L da celulose
II contida na amostra USA + PA 180 min em relação aos resultados obtidos para a
amostra com menor tempo de tratamento (USA + PA 60 min), indicando a formação de
celulose amorfa a partir do ataque químico do sistema peróxido-alcalino aos
domínios cristalinos de celulose II. Este resultado está de acordo com as
informações contidas na literatura a respeito da maior reatividade desse
alomorfo em comparação ao alomorfo nativo (Ciolacu; Popa, 2010), que ocorre
devido a sua estrutura com conformação célula unitária monoclínica composta por
duas cadeias celulósicas anti-paralelas, reduzindo a quantidade de interações
intramoleculares de ligações de hidrogênio, responsáveis pela rigidez das
cadeias, e facilitando a desorganização do cristalito (Credou; Berthelot, 2014).
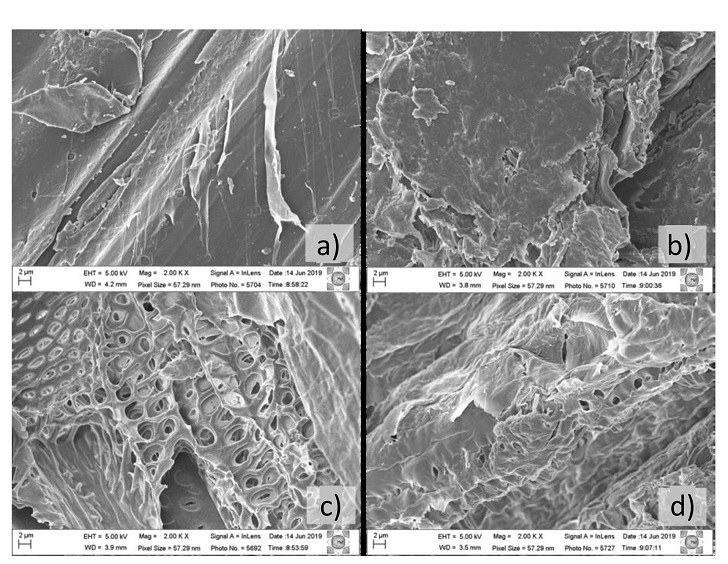
Imagens de MEV-FEG: As imagens obtidas através da análise de MEV-FEG (Figura 2)
das biomassas in natura apresentaram uma estrutura vegetal bem organizada, com
fibras lisas, compactas e sem ruptura aparente, como descrito na literatura
(Corrales et al., 2012). Após os pré-tratamentos, as amostras selecionadas para
posterior isolamento das celuloses branqueadas (BCA USA + PA 60 min, PA USA + PA
60 min e MI APA 180 min) apresentaram fissuras, poros e a formação de uma parede
celular estratificada, devido a explosão das microbolhas geradas pela cavitação
ultrassom sobre a superfície das fibras vegetais e a remoção química de
componentes lignocelulósicos. Este fenômeno ocorrido nas amostras pré-tratadas
tende a favorecer a acessibilidade das biomassas para o processo de separação
das celuloses (Assumpção et al., 2016).
Conclusões
Os pré-tratamentos APA e USA + PA das biomassas de bagaço de cana-de-açúcar e sabugo de milho apresentaram eficiências variáveis na redução da recalcitrância das estruturas lignocelulósicas, de acordo com a análise do polimorfismo das amostras e dos parâmetros de cristalinidade inferidos através da deconvolução dos dados de DRX, que foram correlacionados às variações das bandas de absorção apresentadas nos espectros de FTIR e a morfologia analisada pelas imagens de MEV. Esta análise permitiu determinar o método de pré-tratamento mais eficiente para cada tipo de biomassa com base no maior conteúdo de celulose tipo II gerada e na menor intensidade de bandas referentes à hemicelulose e lignina, bem como mostrar que os tratamentos, de fato, alteraram a estrutura microscópica das biomassas, gerando fendas e descamações nas fibras, e que o uso de cavitação US associada ao tratamento químico APA tem um impacto significativo na mudança de cristalinidade e na remoção dos não celulósicos. As celuloses branqueadas, produzidas a partir das biomassas pré-tratadas selecionadas, apresentaram uma amorficidade significativa em relação as biomassas in natura, indicando que os tratamentos químicos e físicos aplicados nesta metodologia foram eficientes para isolar celuloses de alta reatividade para a biorrefinaria. Por fim, a ferramenta matemática de deconvolução se mostrou promissora em associação com técnicas analíticas para o estudo da composição, da cristalinidade da celulose e da acessibilidade de biomassas a fim de avaliar o desempenho de pré-tratamentos que preparam a lignocelulose para processos de isolamento de celulose e posterior conversão, no conceito de biorrefinaria. Como perspectiva futura, as celuloses produzidas serão utilizadas em testes de conversão para avaliar suas reatividades em relação a celulose comercial.
Agradecimentos
Os autores agradecem o apoio do LABTEN/IQ/UFRN e da RPCC/PETROBRAS. Este estudo foi parcialmente financiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001.
Referências
ASSUMPÇÃO, S. M. N.; PONTES, L. A. M.; CARVALHO, L. S.; CAMPOS, L. M. A.; ANDRADE, J. C. F.; SILVA, E. G. Pré-tratamento combinado H2SO4/H2O2/NaOH para obtenção das frações lignocelulósicas do bagaço da cana-de-açúcar. Revista Virtual de Química, 2016, v. 8, p. 803-822.
CAMPOS, L. M. A. Novas rotas de pré-tratamento e hidrólise enzimática do bagaço da cana-de-açúcar visando a obtenção de glicose. 2017. 223f. Tese (Doutorado em Engenharia Química) - Programa de Pós-Graduação em Engenharia Química, Universidade Federal da Bahia e Universidade Salvador, Salvador, BA, Brasil, 2017.
CHANDEL, A. K.; ANTUNES, F. A. F.; ANJOS, V.; BELL, M. J. V.; RODRIGUES, L. N.; POLIKARPOV, I.; AZEVEDO, E. R.; BERNARDINELLI, O. D.; ROSA, C. A.;
PAGNOCCA, F. C.; SILVA, S. S. Multi-scale structural and chemical analysis of sugarcane bagasse in the process of sequential acid– base pretreatment and ethanol production by Scheffersomyces shehatae and Saccharomyces cerevisiae. Biotechnology for Biofuels, 2014, v. 7, p. 1-17.
CHEMAT, F.; ROMBAUT, N.; SICAIRE, A.-G.; MEULLEMIESTRE, A.; FABIANOTIXIER, A.-S., ABERT-VIAN, M. Ultrasound assisted extraction of food and natural products. Mechanisms, techniques, combinations, protocols and applications. A Review. Ultrasonics Sonochemistry, 2017, v. 34, p. 540-560.
CHEN, H.; LIU, J.; CHANG, X.; CHEN, D.; XUE, Y.; LIU, P.; LIN, H.; HAN, S. A review on the pretreatment of lignocellulose for high-value chemicals. Fuel processing Technology, 2017, v. 160, p. 196-206.
CIOLACU, D.; PITOL-FILHO, L.; CIOLACU, F. Studies concerning the accessibility of different allomorphic forms of cellulose. Cellulose, 2012, v. 16, p. 55-68.
CORRALES, R. C. N. R.; MENDES, F. M. T.; PERRONE, C. C.; SANT’ANNA, C.; SOUZA, W.; ABUD, Y.; BOM, S. E. P.; FERREIRA-LEITÃO, V. Structural evaluation of sugar cane bagasse steam pretreated in the presence of CO2 and SO2. Biotechnology for Biofuels, 2012, v. 5, p. 1-8.
EL OUDIANI, A.; CHAABOUNI, Y.; MSAHLI, S.; SAKLI, F. Crystal transition from cellulose I to cellulose II in NaOH treated Agave americana L. fibre. Carbohydrate Polymers, 2011, v. 86, p. 1221–1229.
FRENCH, A. D. Idealized powder diffraction patterns for cellulose polymorphs. Cellulose, 2014, v. 21, p. 885-896.
KUMAR, A. K.; SHARMA, S. Recent updates on different methods of pretreatment of lignocellulosic feedstocks: a review. Bioresources and Bioprocessing, 2017, v. 4, n. 7, p. 119.
MARTÍNEZ-PATIÑO, J. C.; RUIZ, E.; ROMERO, I.; CARA, C.; LÓPEZ-LINARES, J. C.; CASTRO, E. Combined acid/alkaline-peroxide pretreatment of olive tree biomass for bioethanol production. Bioresource Technology, 2017, v. 239, p. 326-335.
MOURA, H. O. M. A.; CAMPOS, L. M. A.; SILVA, V. L.; ANDRADE, J. C. F; ASSUMPÇÃO, S. M. N.; PONTES, L. A. M.; CARVALHO, L. S. Investigating acid/peroxide-alkali pretreatment of sugarcane bagasse to isolate high accessibility cellulose applied in acetylation reactions. Cellulose, 2018, v. 25, n. 10, p. 5669–5685.
MOURA, J. C. M. S.; BONINE, C. A. V.; VIANA, J. O. F.; DORNELAS, M. C.; MAZZAFERA, P. Abiotic and Biotic Stresses and Changes in the Lignin Content and Composition in Plants. Journal of Integrative Plant Biology, 2010, v. 52, n. 4, p. 360–376.
PARK, S.; BAKER, J. O.; HIMMEL, M. E.; PARILLA, P. A.; JOHNSON, D. K. Cellulose crystallinity index: measurement techniques and their impact on interpreting cellulase performance. Biotechnology for Biofuels, 2010, v. 3, p. 1-10.
RABELO, S. C.; ANDRADE, R. R.; MACIEL, FILHO R.; COSTA, A. C. Alkaline hydrogen peroxide pretreatment, enzymatic hydrolysis and fermentation of sugarcane bagasse to ethanol. Fuel, 2014, v. 136, p. 349-357.
SHARMA, V.; NARGOTRA, P.; BAJAJ, B. K. Ultrasound and surfactant assisted ionic liquid pretreatment of sugarcane bagasse for enhancing saccharification using enzymes from an ionic liquid tolerant Aspergillus assiutensis VS34. Bioresource Technology, 2019, v. 285, p. 1-12.
SLUITER, A.; HAMES, B.; RUIZ, R.; SCARLATA, C.; SLUITER, J.; TEMPLETON, D.; CROCKER, D. Determination of Structural Carbohydrates and Lignin in Biomass. National Renewable Energy Laboratory, 2012, p. 1-15.
WERPY, T.; PETERSEN, G. Top Value Added Chemicals from Biomass, Part I - Results of Screening for Potential Candidates from Sugars and Synthesis Gas. National Renewable Energy Laboratory, v. 1, 2004.
















