ÁREA
Química Verde
Autores
Silva, J.L.H. (UNIVERSIDADE FEDERAL DA PARAIBA) ; Neto Queiroz, J.N.C. (UNIVERSIDADE FEDERAL DA PARAIBA) ; Borges, L.V.S. (UNIVERSIDADE FEDERAL DA PARAIBA) ; Silva, C.A.G. (UNIVERSIDADE FEDERAL DA PARAIBA) ; Coelho, A.F.S. (UNIVERSIDADE FEDERAL DA PARAIBA) ; Curbelo, F.D.S. (UNIVERSIDADE FEDERAL DA PARAIBA) ; Pessoa, M.E.A. (UNIVERSIDADE FEDERAL DA PARAIBA)
RESUMO
O trabalho teve como objetivo fazer uma análise microbiológica de componentes de um fluido de perfuração a base de microemulsão,a fim de determinar fontes de contaminação.Na avaliação microbiológica as amostras foram preparadas por meio da diluição decimal seriada e submetidas ao plaqueamento em superfície,utilizando Ágar Padrão para Contagem nas placas de Petri,para a Contagem de Microrganismos Aeróbios Mesófilos, sendo determinadas as Unidades Formadoras de Colônia por mililitro.Os componentes do fluido analisados foram: óleo de coco (OC),solução aquosa de glicerina (A/G),pó da concha de molusco (PCM),solução aquosa viscosificante (GX) e tensoativo,que o óleo de coco saponificado.Foi verificado contaminação na A/G,PCM e GX.Observou-se,que o tensoativo possui indicação de ação bactericida
Palavras Chaves
Análise microbiológica ; Fluido de perfuração ; pó da concha
Introdução
O fluido de perfuração de petróleo atua no bombeamento da unidade de perfuração até o poço pelo interior da coluna de perfuração e a parede do poço, que chega a peneira vibratória, onde serão separados os sólidos extraídos e em seguida é resfriado e tratado para ser reutilizado (GUIMARÃES, 2007). Os Fluidos de perfuração são um componente essencial e muito usado no processo de perfuração de poços de exploração de petróleo e gás. Os fluidos devem apresentar características físico - química semelhantes com os tipos de formações perfuradas (SILVA, 2021). Pois a incompatibilidade do fluido de perfuração com a formulação, pode provocar um aumento significativo no custo total da perfuração, provocando uma redução na eficiência do poço e, com isso, baixa produtividade (Reed, 1989; Bennion et al., 1994; Zhou et al., 1996; Tare et al., 1999; Knox e Jiang, 2005; Qiansheng et al., 2010; Khodja et al., 2010; Denney, 2011; Qiu et al., 2011; Qutob e Byrne, 2015; Elkatatny et al., 2019; Zhao et al., 2019). Os fluidos de perfuração formulados a base de microemulsão veem sendo uma alternativa, porque diferente das emulsões tem melhor estabilidade termodinâmica e tamanho estrutural, proporcionando longevidade a sistemas de misturas do tipo óleo/água (Tartaro et al., 2020). Os estudos mostram que fluidos a base de microemulsão apresentam vantagens em relação aos fluidos aquosos comuns, como por exemplo: menor perde de circulação, aumento das taxas de perfuração e preservação da vida útil da broca, lubrificação mais eficiente da coluna de perfuração, bem como redução dos custos da perfuração (GONÇALVES, 2018). Na preparação de sistemas microemulsionados, geralmente não são empregados agentes bactericidas na sua formulação, porque existem alegações, de que esses sistemas apresentam grandes quantidades de tensoativo, o que dificulta o desenvolvimento de microrganismos, inibindo seu crescimento (CONSTÂNCIO, 1993). A análise dos componentes individualmente é importante para determinar as principais fontes de contaminação, assim como a análise do fluido formulado, para confirmar a inibição de crescimento microbiano por ação do tensoativo, sem que seja necessária adição de um agente bactericida. Microrganismos não sobrevivem em óleo, e é necessário água para a sua reprodução e crescimento. Nos fluidos de perfuração formulados a base de microemulsão água em óleo (A/O), a água está praticamente inacessível aos microrganismos, sendo essa uma das principais causas da ação antimicrobiana. Existe outra hipótese que justifica a ação antimicrobiana que é o fato de afetar a estrutura e a função da membrana citoplasmática microbiana (JONES, et al., 1997; BORTOLETTO et al., 1998). Existem também alguns relatos sobre as propriedades antimicrobianas das microemulsões como os de AL-ADHAM et al., (2000) que avaliaram a estabilidade de várias microemulsões, sob o ponto de vista microbiológico, através da observação da cinética de morte e microscopia eletrônica de transmissão das bactérias Pseudomonas aeruginosa e Staphylococcus aureus. Foi comprovado que o rompimento das membranas foi a principal causa de morte, ocorrendo muito rápido, em pouco menos de 45 segundos, após o contato com as substâncias.
Material e métodos
As soluções para análise foram preparadas de acordo com o método de diluição decimal seriada que é indicada em ensaios quantitativos, para reduzir o número de microrganismos por unidade de volume,permitindo a contagem, a série de diluição normalmente é decimal, para que o cálculo dos resultados seja facilitado (SILVA,et al,2018).Para as análises foram usados as diluições de 10- 1, 10-2 e 10-3, que é o recomendado para amostras com contaminação na faixa de 3 a 1.000g/mL (SILVA,et al,2018). O meio de cultura escolhido foi o Ágar Padrão para Contagem (PCA) que não é um meio seletivo. Amostras analisadas 1.Óleo de Coco (OC) – líquido 2.Pó da Concha de molusco (PCM) – Sólido 3.Solução aquosa de glicerina (FA) - líquido 4.Solução aquosa e viscosificante (100mL de água para 1g de goma) – líquido 5.Óleo de coco saponificado (OCS) macerado – Sólido 6.Fluido de perfuração a base de microemulsão Preparo de amostras para análise Para esse estudo foi utilizado o procedimento de diluentes para ensaios gerais de quantificação que de acordo com TAYLOR (2015) recomenda a Água Peptonada 0,1% (H2Op 0,1%). Para a primeira diluição (10-1) foram adicionados 10mL (para amostra líquida, retiradas com pipeta volumétrica de 10mL) ou 10g de amostra (para amostra sólida) de amostra em um Erlemayer contento 90ml de H2Op 0,1%, para a segunda diluição (10-2) foi retirada uma alíquota de 1mL da amostra de 10-1 e adicionada em um tubo contendo 9mL de H2Op 0,1% e, para terceira diluição (10-3) foi retirada uma alíquota de 1mL da amostra de 10-2 adicionado em um tubo contendo 9mL de H2Op 0,1% , as alíquotas foram retiradas para as diluições de 10-2 e 10- 3 com uma pipeta de precisão. Foi realizado o plaqueamento em superfície, nas placas de Petri contendo o meio Ágar PCA 20 mL em cada placa, indicado porque não expõe os microrganismos ao calor do meio fundido, permitindo a visualização de características morfológicas e diferenciais de colônias(SILVA,et al,2018). O processo padrão é inoculação de 0,1mL/placa de cada diluição, que possui limite de detecção de 10 Unidades Formadoras de Colônia por mililitro (UFC/mL) para produtos líquidos (SILVA, et al, 2018).A inoculação das amostras foi feita em duplicata, o procedimento de inoculação consistiu na retirada de uma alíquota de 0,1mL de todas as diluições com uma pipeta de precisão para as placas. Com a amostra já inoculada na placa, foi feito o espalhamento da amostra com o auxílio de uma alça de Drigalski estéril. Após a inoculação, as placas foram colocada em estufa à 35º C por 5 dias. A contagem foi realizada nas placas de Petri contendo de 25 a 250 colônias e a determinação das UFC/g ou mL foi realizada multiplicando o número de colônias pelo fator de diluição.Para Correção do valor para g ou mL o resultado foi multiplicado por 10. Para as placas onde não houve crescimento microbiano foi considerado o número de colônias na diluição 10-1 como sendo 1 e o resultado expresso em <10 UFC/g ou mL estimado (est.) (SILVA,2018).
Resultado e discussão
As amostras analisadas mostraram que os componentes do fluido que mais indicaram
contaminação microbiológica foram a solução aquosa e viscosificante 1,31x10^5 e
1,23x10^5 UFC/mL placas 5 e 6 respectivamente , pó da concha de molusco com
5,50x10^2 e 2,30x10^3 UFC/mL placas 7 e 8 respectivamente e a
solução aquosa de glicerina com 2,20x10^3 UFC/mL (segunda duplicata apenas placa
4), conforme mostra a Tabela 1 e Figura 1. É importante ressaltar que, não se
pode desconsiderar o resultado da A/G, porque se trata de uma quantidade elevada
de crescimento microbiano.
As demais amostras analisadas, óleo de coco (OC) e óleo de coco saponificado
(OCS) não apresentaram crescimento microbiano. Para o OC, isso se justifica por
ser um produto industrializado e já ter sofrido tratamento prévio, e mesmo
apresentando duas supostas colônias na diluição de 10^-2 e uma na de 10^-3 da
primeira duplicada mostrada na placa 1, e nenhuma nas demais placas, seria
possível confirmar que se trata de contaminação externa, no entanto, foi
observado que essas supostas colônias são apenas óleo de coco que em baixas
temperaturas apresentam característica sólida e cor branca como visto nas placas
1 e 2 (Figura 1).
Ao analisar as placas 9 e 10 com OCS sugere-se a hipótese de uma possível ação
bactericida por parte desse tensoativo, visto que é um produto sintetizado em
laboratório, sem muito controle de contaminação externa, que poderia ter sido
facilmente contaminado, quando formulado e mesmo assim não apresentou
crescimento microbiano, mas para concluir essa ação, foi necessário analisar o
fluido.
O fluido formulado foi analisado, e como mostrado na Figura 1. placa 11 e 12 e
na Tabela 1 as diluições feitas em duplicata não apresentaram crescimento
microbiano, apresentando apenas uma colônia de fungo isolada na placa da
diluição de 10^-1, o que pode ter sido uma contaminação do ambiente. Analisando
os resultados do OCS e do fluido formulado de forma conjunta, foi possível obter
resultados significativos da ação bactericida do OCS, até mesmo junto com os
outros componentes do fluido que apresentaram contaminação.
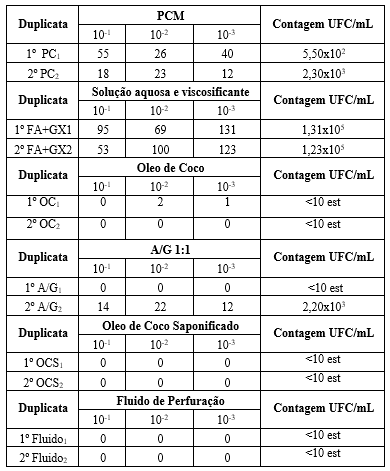
Cálculo de contagem de UFC/mL
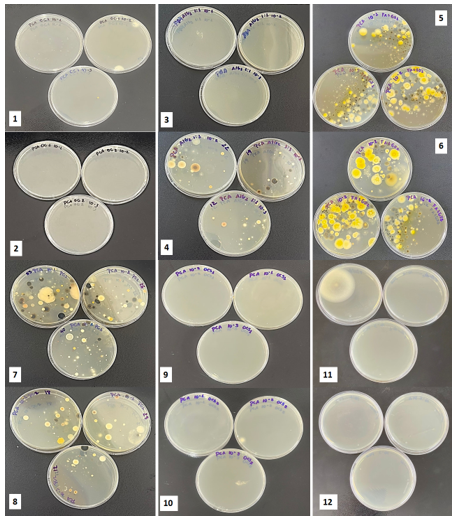
placas de amostras: OC1 e OC2 “1 e 2”, A/G1 e A/G2 \r\n“3 e 4”,GX1 e GX2 “5 e 6”, PCM1 e PCM2 “7 e 8”, OCS1 \r\ne OC2 “9 e 10” e fluido1 e fluido2 “11 e 12\"
Conclusões
A análise microbiológica dos componentes usados na formulação de fluidos de perfuração a base de microemulsão foi importante para determinar as principais fontes de contaminação desse fluido, possibilitando concluir que as maiores fontes de contaminação presentes na formulação do fluido são: solução aquosa e viscosificante goma xantana, solução aquosa de glicerina, pó da concha de molusco. O não crescimento de microrganismos no OCS já indica uma ação bactericida deste tensoativo, no entanto para este trabalho foi realizada também a análise microbiológica do fluido de perfuração formulado com tensoativa para que fosse possível confirmar a ação bactericida. Após as análises microbiológicas do fluido formulado, foi possível concluir características de ação bactericida presentes na solução tensoativa, porque mesmo com o fluido contendo goma xantana e pó da concha de molusco, e sem anti bactericida na sua formulação, não apresentou crescimento bacteriano, mas ainda são necessários mais estudos para concluir o tempo dessa ação e assim determinar a vida útil desse fluido.
Agradecimentos
Os autores agradecem ao LAMI/UFPB e LAPET/UFPB pela estrutura disponível para o desenvolvimento da pesquisa e ao Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (Cnpq), Chama CNPq/SEMPI/MCTI nº 021/2021.
Referências
AL-ADHAM, I.S.I; KHALIL, E.; AL-HMOUD, N.D; KIERANS, M.; COLLIER,P.J. Microemulsions are membrane-active, antimicrobial, self-preserving systems. J. Appl. Microbiol., v.89, p 32-39, 2000.
BENNION, D. B.; THOMAS, E. B.; BENNION, D. W.; BIETZ, R. E. Underbalanced Drilling And Formation Damage – Is It a Total Solution?. In: Annual Technical Meeting, 1994, Calgary, Alberta. DOI: 10.2118/94-17.
BORTOLETO, R.K.; OLIVEIRA, A.H.; RULLER, R.; ARNI, R.K.; WARD, R.J. Tertiary strutural changes of the alpha-hemolysin from Staphylococcus aureus on association with liposome membranes. Arch. Biochem. Bioph., v. 351, p. 47-52, 1998.
CONSTÂNCIO, K.F.S. Contaminação microbiológica de produtos cosméticos. Rev. Racine, v.11, p. 13-14, 1993.
DENNEY, D. Improving Compatibility of Drilling Fluid, Completion Fluid, and Other WellTreatment Fluids for Deepwater Wells. J. Pet. Technol., v. 63 (11), p. 65-66, 2011. DOI:10.2118/1111-0065-JPT.
ELKATATNY, S.; JAFARKHANLY, T.; AL-MAJED, A.; MAHMOUD, M. Formation Damage Avoidance by Reducing Invasion with Sodium Silicate-Modified Water-Based Drilling Fluid. Energies, v. 12, 1485, 2019. DOI: 10.3390/en12081485.
GONÇALVES, T. S. S. Desenvolvimento de fluidos de perfuração poliméricos a base de microemulsões e avaliação de suas propriedades. Dissertação de mestrado. Universidade Federal do Rio Grande do Norte. Natal, 2018.
GUIMARÃES, I. B.; ROSSI, L. F. S. Estudo dos constituintes dos fluidos de perfuração: proposta de uma formulação otimizada e ambientalmente correta. 4º Congresso Brasileiro de Pesquisa e Desenvolvimento em Petróleo e Gás. Campinas, 2007.
KHODJA, M.; CANSELIER, J.; BERGAYA, F.; FOURAR, K.; KHODJA, M.; COHAUT, N.; BENMOUNAH, A. Shale problems and water-based drilling fluid optimization in the Hassi Messaoud Algerian oil field. Appl. Clay Sci., v. 49, p. 383-393, 2010. DOI: 10.1016/j.clay.2010.06.008.
KNOX, D.; JIANG, P. Drilling Further with Water-Based Fluids – Selecting the Right Lubricant. In: SPE International Symposium on Oilfield Chemistry, 2005, The Woodlands, Texas. DOI: 10.2118/92002-MS.
QIANSHENG, Y.; SHUJIE, L.; XINGJIN, X. Drilling fluid technology for horizontal wells to protect the formations in unconsolidated sandstone heavy oil reservoirs. Pet. Explor. Dev., v. 37 (2), p. 232-236, 2010. DOI: 10.1016/S1876-3804(10)60029-8.
QIU, X.; MORGENTHALER, L.; MARTCH, W.; VU, H.; CHTAY, M.; DAVID, V. Chemical additives for improving compatibility of drilling fluid, completion fluid and other well treatment fluids for deep water wells. In: SPE International Symposium on Oilfield Chemistry, 2011, The Woodlands, Texas, EUA. Paper Number: SPE-141513-MS. DOI:10.2118/141513-MS.
QUTOB, H.; BYRNE, M. Formation damage in tight gas reservoirs. In: SPE European Formation Damage Conference and Exhibition, 2015, Budapeste, Hungria. DOI: 10.2118/174237-MS
REED, M. G. Formation damage prevention during drilling and completion. In: SPE Centennial Symposium at New Mexico Tech, 1989, Socorro, New Mexico. DOI: 10.2118/20149-MS.
SILVA, N. D. et al. Manual de métodos de análise microbiológica de alimentos e água. 5º.ed. São Paulo: Editora Edgard Blucher Ltda., 2018, E-book. ISBN 9788521212263. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521212263/. Acesso em: 10 jul. 2023.
SILVA, R. Microemulsão inibidora de formações reativas aplicada em fluidos de perfuração de poços de petróleo e gás – Tese (Mestrado em Engenharia Química) – Universidade Federal da Paraíba, p.18.
TARE, U. A.; TAKACH, N. E.; MISKA, S. Z.; GROWCOCK, F. B.; DAVIS, N. Investigation of drilling fluids containing blast furnace slag for their potential impact on formation damage—a laboratory study. ASME. J. Energy Resour. Technol., v. 121(3), p. 149–153, 1999. DOI: 10.1115/1.2795974.
Tartaro, G., Mateos, H., Schirone, D., Angelico, R., Palazzo, G., 2020. Microemulsion microstructure(s): a tutorial review. Nanomaterials 10, 1657. https://doi.org/ 10.3390/nano10091657
TAYLOR, T.M., SOFOS, J.N., BODNARUK, P. & ACUFF, G.R., 2015. Sampling plans, sample collection, ship-ment, and preparation for analysis. In: SALFINGER, Y. & TORTORELLO, M.L. (eds.), Compendium of Methods for the Microbiological Examination of Foods, 5th ed. American Public Health Association, Washington, D. C. Chapter 2, pp.13-25.
ZHAO, X.; QIU, Z.; SUN, B.; LIU, S.; XING, X.; WANG, M. Formation damage mechanisms associated with drilling and completion fluids for deepwater reservoirs. J. Pet. Sci. Eng., v. 173, p. 112-121, 2019. DOI: 10.1016/j.petrol.2018.09.098.
ZHOU, Z.; GUNTER, W. D.; KADATZ, B.; CAMERON, S. Effect of clay swelling on reservoir quality. J. Can. Pet. Technol., v. 35(7), p. 18-23, 1996. DOI: 10.2118/96-07-02.
















