ÁREA
Química de Produtos Naturais
Autores
Romagnoli, E.S. (UNIVERSIDADE ESTADUAL DE LONDRINA) ; Branco, I.G. (UNIVERSIDADE ESTADUAL DE LONDRINA) ; de Souza, E.G. (UNIVERSIDADE ESTADUAL DE LONDRINA) ; Campos, J.W. (UNIVERSIDADE ESTADUAL DE LONDRINA) ; Silva, N.F. (UNIVERSIDADE ESTADUAL DE LONDRINA) ; Brandão, M.C. (UNIVERSIDADE ESTADUAL DE LONDRINA) ; Angilelli, K.B. (UNIVERSIDADE ESTADUAL DE LONDRINA) ; Borsato, D. (UNIVERSIDADE ESTADUAL DE LONDRINA)
RESUMO
Para inibir o processo oxidativo e aumentar o período de indução, foram adicionados extratos naturais de folhas de gabiroba (Campomanesia xanthocarpa), cascas de jabuticaba (Myrciaria cauliflora) e flores de hibisco (Malvaviscus arboreus) com propriedades antioxidantes. Os ensaios de estabilidade oxidativa nas amostras contendo ou não extratos foram realizados nas temperaturas de 110, 115, 120 e 125 ºC, sendo obtidos, os valores de período de indução (PI). Por extrapolação dos dados experimentais do logaritmo natural dos valores, em diferentes temperaturas, foi estimado o período de indução das amostras em temperatura ambiente. A partir dos resultados, nota-se que extratos foram eficientes, aumentando os valores de PI das amostras quando comparadas ao controle.
Palavras Chaves
Biodiesel; Extratos naturais; Estabilidade oxidativa
Introdução
Com o aumento dos problemas ambientais causados pelo uso de combustíveis fósseis, têm-se buscado alternativas energéticas, utilizando recursos renováveis, para atender as demandas atuais. Uma dessas alternativas é uso do biodiesel que apresenta propriedades semelhantes ao diesel e que pode ser utilizado em mistura a esse combustível derivado do petróleo reduzindo assim as emissões de CO2 e SO2 (HASSAN et al., 2022). Este biocombustível é um éster alquílico produzido por meio da reação de transesterificação de óleo vegetal, animal com um álcool de cadeia curta (GUO et al., 2022; GALVAN et al, 2020). O biodiesel, ao contrário dos combustíveis fósseis que são relativamente inertes, apresenta uma maior tendência à degradação podendo assim não manter suas características estáveis, durante o seu transporte e armazenamento. Esta menor estabilidade química do biodiesel está relacionada com a presença de insaturações na sua cadeia carbônica que, em contato com o oxigênio do ar e contaminações por íons de metais de transição e água, pode sofrer o processo de oxidação com a formação de gomas e compostos como ácidos orgânicos, aldeídos, ésteres, cetonas, alcoóis, peróxidos que levam a alterações de suas propriedades como combustível (BORSATO et al., 2012; CHENDYNSKI et al., 2019). Uma das formas de retardar ou inibir o processo oxidativo e aumentar o tempo de armazenamento do biodiesel é com a adição de compostos químicos antioxidantes. Extratos de diferentes vegetais vem sendo estudados e têm sido utilizados para melhorar a estabilidade química do biodiesel, pois possuem em sua composição grupos fenólicos, que apresentam a propriedade de doar hidrogênio aos radicais livres formados, impedindo assim a propagação da reação de oxidação do biodiesel (CORREIRA, et al. 2020). O objetivo deste trabalho foi realizar a extração de compostos fenólicos de folhas de gabiroba (Campomanesia xanthocarpa), cascas de jabuticaba (Myrciaria cauliflora) e flores de hibisco colibri (Malvaviscus arboreus) e avaliar a atividade antioxidante destes extratos em biodiesel.
Material e métodos
O biodiesel utilizado neste estudo foi obtido por meio de transesterificação de uma mistura de sebo comercial e azeite de oliva na proporção de 50% w/w, empregando como catalisador básico da reação, hidróxido de potássio (SIGMA–ALDRICH, 95%) na concentração de 0,8% (w/w) e álcool metílico (FMaia PA 99.8%). O processo de obtenção do biodiesel foi realizado, com refluxo contínuo a 60 °C, durante duas horas. Após este período, foi realizada a separação da glicerina e o biodiesel foi lavado primeiramente com solução aquosa de ácido clorídrico (1,5% m/m) e depois com água, ambos a 80°C, até que fosse atingido pH neutro e na sequência o biodiesel então foi desumidificado. Para a preparação dos extratos, as folhas de gabiroba (Campomanesia xanthocarpa), cascas de jabuticaba (Myrciaria cauliflora) e flores de hibisco (Malvaviscus arboreus) foram secas em estufa na temperatura de 60 °C até peso constante, separadamente. Na sequência, cada amostra seca foi triturada, pesado 10g e foram adicionados 250 ml de etanol absoluto. As misturas foram deixadas em repouso ao abrigo da luz a temperatura ambiente durante 48 horas. Após este período, os extratos foram filtrados em papel filtro quantitativo (UNIFIL®), concentrados até aproximadamente 50 mL com auxílio de placa de aquecimento a 60°C e por fim transferidos para balões volumétricos de 50 mL nos quais aferiu-se os volumes com etanol absoluto (CORREIA et al., 2020). O teor de compostos fenólicos totais de cada extrato foi determinado por meio do método Folin-Ciocalteau, utilizando espectrômetro UV-Vis (Thermo Scientific, modelo: Evolution 60), até 760 nm. O teor de fenóis foi expresso em equivalentes de ácido gálico (EAG) por grama de matéria seca das folhas de gabiroba, cascas de jabuticaba e hibisco colibri (CHENDYNSKI, et al., 2019). As amostras foram preparadas adicionando-se 7,5% de cada extrato, em 100 g de biodiesel. O volume de extrato utilizado foi determinado por ensaios preliminares para que cada amostra (biodiesel + extrato) apresentasse período de indução (PI) de acordo com a norma EN 14214 (2020) e Resolução ANP n° 798 (2019) de 8h e 12h respectivamente. O álcool presente nos extratos foi removido por evaporação em placa de aquecimento a 60 °C antes da sua adição ao biodiesel. A determinação do período de indução das amostras de biodiesel controle (sem a adição de extrato) e contendo os extratos de folhas de gabiroba, cascas de jabuticaba, flores de hibisco colibri, foi realizada utilizando o equipamento Rancimat (Metrohm, modelo 873), nas temperaturas de 110, 115, 120 e 125 °C de acordo com a norma EN 14112 (2020).
Resultado e discussão
A adição de extrato natural com propriedades antioxidantes vem sendo
avaliada, devido à presença de compostos fenólicos em sua composição, uma vez
que é uma alternativa para retardar ou inibir o processo de oxidação do
biodiesel, consequentemente aumentando seu tempo de armazenamento sem alterações
significativas das suas propriedades físico-químicas (CORREIA et al., 2020).
Os extratos alcoólicos obtidos de cascass de jabuticaba, folhas de gabiroba e
flores de hibisco colibri, foram analisados quanto à concentração de fenóis
totais pelo método Folin-Ciocalteau. O teor de fenol total expresso em
equivalente de ácido gálico, nos extratos de cascas de jabuticaba, folhas de
gabiroba e flores de hibisco colibri foram, 28,56 mg EAG g-1 massa
seca, 18,16 g EAG g-1 massa seca e 10,39 EAG g-1 massa
seca respectivamente.
Os valores obtidos estão compatíveis aos observados em outros estudados. Pascoal
et al. (2011) analisaram as folhas de Campomanesia adamantium e encontraram
35,04 mg EAG g-1 de extrato. Sant'anna et al., (2017) analisaram
folhas de Campomanesia xanthocarpa e foi obtido o valor de 3,7360 mg EAG
mL-1 de extrato. Da Silva et al. (2017) também estudaram a cascas da
jabuticaba (Myrciaria jaboticaba), e no estudo apresentaram valor de total de
fenóis de 23,73 ± 1.65 EAG g-1 sendo a cascas da jabuticaba em pó.
Kannan et al., (2018) analisaram o teor de fenóis das flores (Malvaviscus
arboreus) de cor vermelha, baseado no método Folin– Ciocalteu, e obtiveram 42,57
± 0.68 EAG g-1. Para avaliar as propriedades antioxidantes dos
extratos de folhas de gabiroba, cascas de jabuticaba e flores de hibisco
colibri, amostras de biodiesel com e sem o extrato foram submetidas ao ensaio de
estabilidade oxidativa nas temperaturas de 110, 115, 120 e 125 ºC, para
determinação dos períodos de indução (PI) pelo método de degradação acelerada
empregando o equipamento Rancimat de acordo com a norma EN 14112 (2020). A
estabilidade oxidativa, é um dos fatores mais importantes na avaliação da
qualidade do biodiesel, pois, permitindo assim a comercialização e assegurando a
validade deste durante o armazenamento. Este parâmetro deve seguir as
especificações estabelecidas pela Agência Nacional do Petróleo, Gás Natural e
Biocombustíveis (ANP), que através da resolução n° 45 de agosto de 2014,
estabelece o limite mínimo em horas. A Tabela 1 apresenta os valores do período
de indução (PI), em horas (h), nas para as amostras de biodiesel contendo os
diferentes extratos naturais e para a amostra controle obtidos nas temperaturas
de 110, 115, 120 e 125 ºC. Pelos resultados obtidos, observa-se que o PI diminui
com o aumento da temperatura, contudo, nota-se que em comparação com a amostra
controle, todas as amostras contendo extratos, obtiveram maiores valores de PI
em todas as temperaturas, indicando que, a adição dos extratos é favorável para
inibir/retardar o processo de oxidação do biodiesel. Deve-se destacar que, as
amostras de biodiesel contendo os extratos de folhas de gabiroba, cascas de
jabuticaba e flores de hibisco apresentaram, na temperatura de 110 ºC, períodos
de indução de 13,82 h, 14,31 h e 13,68 h respectivamente, sendo estes valores
acima do mínimo exigido pela Resolução ANP nº 798 (2019), 12 horas, como também
para norma EN 14214 (2020) que é de 8 horas. A taxa de oxidação do biodiesel, e
consequentemente a estabilidade oxidação, não possui relação apenas ao número
total de ligações duplas, mas também com à posição dos átomos de carbono bis-
alílico, o qual é mais suscetível a oxidação, devido à reação oxidativa
radicalar. Logo, os ésteres metílicos poli-insaturados são mais suscetíveis à
oxidação do que os monoinsaturados (YAAKOB; NARAYANAN; PADIKKAPARAMBIL, 2014;
SURAJ; KRISHNASAMY; SUNDARARAJAN, 2019). Para avaliar o PI do biodiesel, em
condições mais realistas, na presença e ausência dos extratos naturais,
realizou-se o tratamento dos dados obtidos nos ensaios realizados nas
temperaturas de 110, 115, 120, 125 °C (Tabela 1). Os valores de PI (em dias)
foram convertidos para o logaritmo e plotou-se gráfico log de PI versus
temperaturas. Estes foram ajustados linearmente e extrapolado para a temperatura
de 25 ºC. A Figura 1 ilustra as retas resultantes do ajuste da temperatura em
°C de cada tratamento versus o tempo em dias para as amostras de biodiesel
controle e com adição dos extratos naturais. De acordo com a figura 1, a amostra
de biodiesel contendo apenas extrato de folhas de gabiroba apresentou o maior PI
na temperatura de 25 °C, sendo aproximadamente 27 vezes maior que o valor do
controle com 480 dias. Isto evidencia que as propriedades antioxidantes das
folhas de gabiroba atuaram na redução do processo oxidativo do biodiesel.
Contudo, as amostras contendo extrato de cascas de jabuticaba e flores de
hibisco também apresentaram valores de PI maiores na temperatura de 25 °C, do
que amostra controle, indicando que, a utilização destes também é favorável na
redução da degradação do biodiesel.
Os coeficientes de determinação (R2) observados variaram de 0,97 a
0,99 mostrando a qualidade dos ajustes, o que sugere a possibilidade de
extrapolação dos dados para obter o período de indução em condições de
temperatura mais realistas. Em todas as amostras de biodiesel contendo os
extratos a extrapolação para a temperatura de 25 ºC apresentou valores menores
que o controle com R2=0,99. Entretanto, os resultados deste estudo com relação
as condições mais realistas, devem ser interpretados com cautela pois a
exposição ao ar, contaminação por metais e outros iniciadores de radicais,
exposição à água, luz e calor podem contribuir para a degradação do biodiesel,
diminuindo o PI, afetando assim a estabilidade oxidativa do biodiesel.
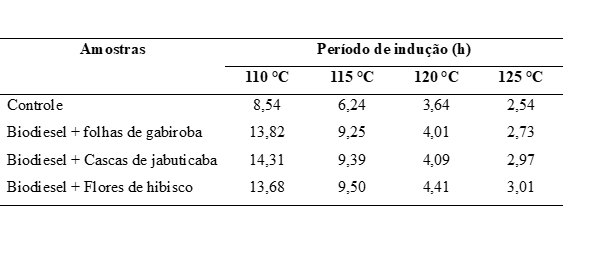
Valores de período de indução obtidos para as amostras de biodiesel contendo extratos naturais e para a \r\namostra controle nas diferentes temperaturas.
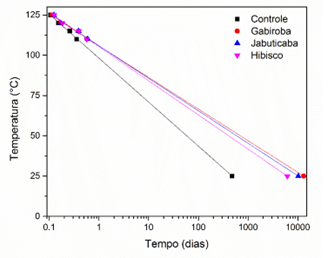
Relação entre o logaritmo do Período de Indução (d) e as temperaturas de ensaio amostras de biodiesel \r\ncontrole e com adição dos extratos naturais.
Conclusões
O uso de extratos naturais de folhas de gabiroba, cascas de jabuticaba e flores de hibisco mostraram-se eficientes para retardar o processo de oxidação do biodiesel. A extrapolação dos dados é uma técnica útil para estimar o PI do biodiesel em condições mais realistas, em temperatura ambiente, contudo deve os resultados devem ser analisados com certa cautela, pois diversos fatores além da presença de extratos naturais com propriedades antioxidantes podem interferir no processo de oxidação do biodiesel.
Agradecimentos
A Universidade Estadual de Londrina, CNPq, CAPES e Fundação Araucária.
Referências
BORSATO, DIONÍSIO et al. Cinética da oxidação de biodiesel de óleo de soja em mistura com TBHQ: determinação do tempo de estocagem. Química Nova, v. 35, n. 4, p. 733-737, 2012.
BRASIL. RESOLUÇÃO, ANP Nº. 798, Agência Nacional do Petróleo, Gás Natural e Biocombustíveis de 01.08. 2019–DOU 02.08. 2019.
CHENDYNSKI, L. T. et al. Analysis of the formation of radicals in biodiesel in contact with copper and metallic alloys via electronic paramagnetic resonance (EPR). Fuel, v. 242, p. 316-322, 2019.
CORREIA, I. A. S. et al. Inhibition of the biodiesel oxidation by alcoholic extracts of green and black tea leaves and plum pulp: Application of the simplex-centroid design. Renewable Energy, v. 160, p. 288-296, 2020.
EN14214. Liquid petroleum products. Fatty acid methyl esters (FAME) for use in diesel engines and heating applications. Requirements and test methods. European Committee for Standardization. 2020.
EN 14112: Fat and Oil derivatives - Fatty Acid Methyl Esters (FAME), Determination of oxidation stability (accelerated oxidation test). European Committee for Standardization, 2020 2020.
GALVAN, Diego et al. Kinetic study of the transesterification reaction by artificial neural networks and parametric particle swarm optimization. Fuel, v. 267, p. 117221, 2020.
GUO, Mengli et al. Highly active and recyclable CuO/ZnO as photocatalyst for transesterification of waste cooking oil to biodiesel and the kinetics. Fuel, v. 315, p. 123254, 2022.
HASSAN, Tafsirul et al. Opportunities and challenges for the application of biodiesel as automotive fuel in the 21st century. Biofuels, Bioproducts and Biorefining, v. 16, n. 5, p. 1353-1387, 2022.
KANNAN, M. et al. Extraction of Phenolic compounds and assessing antioxidant activity of Malvaviscus arboreus Cav flowers. Journal of Pharmacognosy and Phytochemistry, v. 7, n. 2, p. 1261-1263, 2018.
PASCOAL, Aislan CRF et al. Free Radical Scavenging Activity, Determination of Phenolic Compounds and HPLC-DAD/ESIMS Profile of Campomanesia Adamantium Leaves. Natural Product Communications, v. 6, n. 7, p. 1934578X1100600711, 2011.
SANT’ANNA, Liane Santariano et al. Chemical composition and hypotensive effect of Campomanesia xanthocarpa. Evidence-Based Complementary and Alternative Medicine, v. 2017, 2017.
DA SILVA, Juliana Kelly et al. Functional tea from a Brazilian berry: Overview of the bioactives compounds. LWT-Food Science and Technology, v. 76, p. 292-298, 2017.
SURAJ, C. K.; KRISHNASAMY, A; SUNDARARAJAN, T. Investigations on gradual and accelerated oxidative stability of karanja biodiesel and biodiesel–diesel blends. Energy & Fuels, v. 33, n. 9, p. 9196-9204, 2019.
YAAKOB, Z., NARAYANAN, B. N., & PADIKKAPARAMBIL, S. A review on the oxidation stability of biodiesel. Renewable and Sustainable Energy Reviews, v. 35, p. 136-153, 2014.
















