ÁREA
Química de Produtos Naturais
Autores
Cavalcante, J.D.N. (UFRN) ; Brito dos Santos, M.G. (UFRN) ; Silva Fidelis, J.D. (UFRN) ; Simões Silva, L.F. (UFRN) ; Souza, B.F. (UFRN) ; Oliveira, G.B. (UFRN) ; Costa, G.L.V. (UFRN) ; Soares do Bonfim, K. (UFRN) ; Costa Filho, J.D.B. (UFRN) ; Santana Souza, D.F. (UFRN)
RESUMO
Antocianinas são pigmentos naturais com elevada versatilidade, de modo que é necessário desenvolver técnicas que permitam recuperá-los com eficácia e baixo custo. Neste contexto, o presente estudo investigou a recuperação e purificação parcial de antocianinas em sistemas aquosos bifásicos polietilenoglicol/sal e etanol/sal. Bagas de mirtilo foram usadas como fonte de antocianinas e elas foram obtidas por maceração em meio aquoso. O desempenho de sistemas com 20% (m/m) solvente apresentaram maior sensibilidade à variação da concentração de sal. Sistemas com polietileno glicol (PEG 400) apresentaram maiores valores de recuperação e coeficiente de partição de antocianinas do que sistemas com etanol. O uso da maior dosagem de extrato (20%, m/m) garantiu valores de recuperação superiores a 90%
Palavras Chaves
Corante natural; Polietilenoglicol; Etanol
Introdução
Os componentes fenólicos ou polifenóis são importantes grupos metabólitos que atuam como antioxidantes presentes em grande parte dos alimentos, sendo encontrados em plantas, e contribuem para as características de cor, aroma e sabor, além de propriedades tecnológicas e funcionais (PEREIRA & ANGELIS- PEREIRA, 2014). O consumo adequado e rotineiro de alimentos ricos em compostos fenólicos como vegetais, frutas e bebidas, é frequentemente associado à prevenção de doenças cardiovasculares, degenerativas e câncer (TSAO, 2010). Os principais compostos fenólicos estão presentes em alimentos pertencentes à classe dos ácidos fenólicos, taninos e flavonoides, sendo esse último composto ligado à pigmentação (TSAO, 2010). As antocianinas são um subgrupo dos flavonoides responsáveis pelos pigmentos das cores azul, roxas e tonalidades de vermelho das flores, frutos e raízes de plantas. Elas têm importante uso industrial principalmente por serem pigmentos solúveis em água (MARÇO et al, 2008). As antocianinas se encontram em grande quantidade nas cascas de frutos comestíveis do tipo baga incluindo morangos, uvas, airela e, particularmente, o mirtilo. O mirtilo (Vaccinium myrtillus) é um fruto nativo de várias regiões da Europa e dos Estados Unidos, mas os países da América do Sul passaram a investir também no cultivo deste devido às suas características medicinais. De acordo com Hutabarat (2019), o rendimento de antocianinas a partir do mirtilo pode chegar a 16,4 mg/g, o que é várias vezes superior a extrações com outras fontes. Visando a obtenção das antocianinas, a estabilidade desse componente tem sido o principal foco dos estudos, pois, quando isoladas, são instáveis e podem sofrer degradação (ZARDO, 2014). Esse comportamento ocorre devido a presença de açúcares que reagem formando novos produtos, e outros fatores como o pH, a temperatura, a luz e a presença de oxigênio também podem influenciar a estabilidade e promover a degradação das antocianinas. Diante disso, faz-se necessário uma recuperação adequada e acessível desses compostos devido a sua solubilidade em solventes polares, com destaque para métodos baseados em metanol (SCHIOZER & BARATA, 2007). Contudo, este processo completo tem um custo consideravelmente alto e, além disso, para a indústria de alimentos o uso de metanol não é uma boa alternativa devido à sua toxicidade (NELSON et al., 2009). Para atender estas condições, vários estudos estão sendo feitos ao longo dos anos com sistemas aquosos bifásicos. Os processos com sistemas aquosos bifásicos se baseiam na separação por extração líquido-líquido e tem sido largamente utilizado para recuperação de biomoléculas. A formação dos sistemas aquosos bifásicos envolve a mistura de componentes como polímero/sal, polímero/polímero, líquidos iônicos/sal, álcool de baixa massa molecular/sal, dentre outros, sendo mais conhecidos polímero/sal e polímero/polímero (CARVALHO, 2022). Os sistemas polímero/sal e álcool /sal são alternativas atraentes para particionamento de antocianinas por oferecer elevada afinidade ao soluto, baixa toxicidade e rápida separação de fases (CARVALHO, 2022). Autores como Hua et al. (2013) e Tang et al. (2018) já mostraram êxito do particionamento de antocianinas para a fase rica em solvente (recuperação > 75%), porém esses e outros trabalhos negligenciaram efeitos de fatores da técnica. O ajuste fino das condições operacionais na extração em sistemas aquosos bifásicos é crítico para maximizar a separação de antocianinas e, por consequência, assegura melhores métricas econômicas. Assim, o presente trabalho propõe a recuperação e concentração de antocianinas de mirtilo (V. myrtillus) a partir da extração por sistemas aquosos bifásicos. Os sistemas selecionados foram polietileno glicol 400 (PEG 400)/sulfato de amônio e etanol/sulfato de amônio. O estudo envolveu a compreensão dos efeitos dos agentes formadores de fases, percentual de extrato e pH sobre a recuperação de antocianinas.
Material e métodos
Soluções estoques de sulfato de amônio (41% m/m), etanol (90% m/m) e PEG 400 (50% m/m) foram preparadas anteriormente e usadas para a confecção do diagrama de fases a temperatura ambiente (298 K). Os comportamentos dos sistemas etanol/sulfato de amônio e PEG 400/sulfato de amônio foram avaliados pelo método de titulação por ponto de nuvem, de acordo com Oliveira et al. (2020). A partição de antocianinas e açúcares foi realizada em tubos de centrífuga com a massa total dos sistemas aquosos bifásicos fixada em 5 g. Após medição na balança analítica, os tubos foram agitados em vórtex por 15 s, mantidos por 1 h em ambiente escuro e, finalmente, as fases foram coletadas. Neste estudo, os experimentos foram executados de modo univariado (com duplicata), usando as seguintes condições iniciais: percentual de extrato de 10% (m/m) e pH igual a 4.5. Para investigar os efeitos dos agentes formadores de fases sobre a eficácia da técnica, as composições dos sistemas foram alteradas de acordo com a Tabela 1. Em seguida, os efeitos do percentual de extrato e pH do sistema serão investigados. A codificação dos experimentos foi dada de acordo com as condições de trabalho. A codificação segue uma sequência de três caracteres. O primeiro caractere é uma letra referente ao tipo de agente; "E" para etanol e "P" para o polietilenoglicol. O segundo caractere é um número, referente à concentração do agente, "1" para 20%; "2" para 30% e "3" para 30% de agente em proporção massa de agente por massa total do sistema. O último caractere é referente à concentração de sulfato, "1" para 16%; "2" para 18%; "3" para 20% e "4" para 22% em massa. O desempenho da extração foi determinado a partir do cálculo de coeficiente de partição (K) e rendimento na fase topo (Y1), sendo expressos pelas equações 1 e 2. K=C_T/C_B (1) Y_1 (%)=(C_T×V_T)/(C_T×V_T+C_F×V_F ) (2) As siglas CT e CF são, em ordem, as concentrações de antocianinas na fase topo e fase de fundo, enquanto que VT e VF são os volumes das fases topo e fundo, respectivamente. As diferenças de desempenho foram avaliadas em teste de médias (teste de Tukey) usando o software Statistica 7.0. O método pH diferencial foi usado para quantificar antocianinas nos experimentos de extração, conforme descrito em Wu et al. (2014). Neste método, as amostras foram diluídas na proporção 1:4 (v/v) com soluções tampão 0,03 M cloreto de potássio (pH 1.0) e 0,4 M acetato de sódio (pH 4.5). Em seguida, as leituras foram realizadas em espectrofotômetro a 510 e 700 nm, usando água deionizada como branco. A concentração de antocianinas totais foi calculada através das seguintes equações: A=(A_526-A_700 )_(pH=1,0)-(A_526-A_700 )_(pH=4,5) (3) Antocianinas (g/L)=(A×M_W×Fator de diluição×1000)/(ε×L) (4) Onde A é diferença de absorbâncias, MW é a massa molecular da malvidin-3-O- glucoside (493.2 g/gmol), DF é o fator de diluição, ε é o fator de extinção de pigmentos naturais (28,000 cm.L/gmol) e L é o caminho óptico da cubeta.
Resultado e discussão
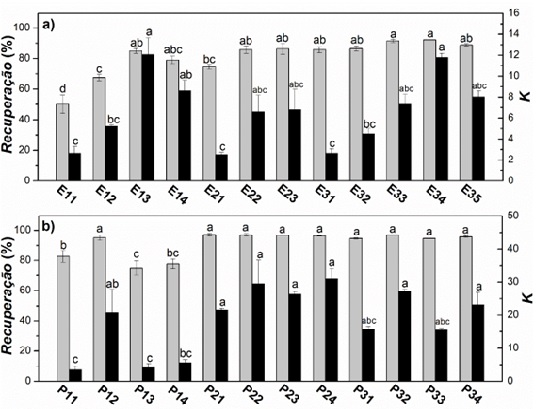
A Figura 1 apresenta os efeitos dos componentes formadores de fases sobre a
recuperação e coeficiente de partição das antocianinas. É possível constatar que
as antocianinas apresentaram maior preferência pelas fases topo, sejam elas
ricas em etanol ou PEG 400. Logo, os contaminantes devem migrar para a fase
fundo. Em estudo prévio, Hua et al. (2013) registraram que açúcares presentes no
mirtilo se deslocaram preferencialmente para a fase fundo, possibilitando
valores de remoção de até 66%. Os solventes usados no presente estudo oferecem
um ambiente adequado para antocianinas, em particular o PEG 400. O PEG apresenta
oxigênios éter e hidroxilas em suas extremidades, permitindo que ele estabeleça
múltiplas ligações de hidrogênio com solutos hidrofílicos, tais como a
antocianina (Nogueira et al., 2022).
Em geral, os sistemas com 20% (m/m) solvente foram mais susceptíveis a variação
de desempenho do que os sistemas com 25% e 30% (m/m) solvente. Por exemplo, nos
sistemas com 20% (m/m) etanol, a recuperação de antocianinas na fase topo
aumentou de 50.1% para 85.2% quando a concentração de sal passou de 18% para 22%
(m/m). Por sua vez, nos sistemas com 25% e 30% (m/m) etanol, os valores de
recuperação aparentaram ser indiferentes à variação da concentração de sal,
permanecendo no patamar de 86%-90%. Uma tendência semelhante foi registrada para
os sistemas PEG400/sulfato de amônio. Sob 20% (m/m) PEG 400, as respostas
recuperação e coeficiente de partição aumentaram com a passagem da concentração
de sal de 16% (condição P11) para 18% (condição P12) e, em maiores concentrações
de sal, eles declinaram. Em seguida, não houve diferenças significativas entre
as respostas dos sistemas com 25% e 30% (m/m) PEG 400.
De fato, nos sistemas com 30% (m/m) etanol, houve um aumento expressivo no
coeficiente de partição na comparação das condições E31 e E34, contudo vale
ressaltar que essa resposta é de importância secundária. O coeficiente de
partição tem propósito de indicar o grau de afinidade do soluto por uma das
fases, mas não tem o caráter prático da resposta recuperação. À respeito da
recuperação, nós acreditamos que o comportamento da resposta pode ser explicado
pelo aumento do volume da fase topo nas condições com 25% e 30% (m/m). Maiores
volumes de fase topo asseguraram quase o pleno deslocamento das antocianinas
para a fase topo, de modo que o cálculo de recuperação ficou insensíveis à
variação da concentração de sal. Outros autores também mostraram esse
comportamento na extração de antocianinas em sistemas aquosos bifásicos (Hua et
al., 2013; Tang et al., 2018). Diante dos resultados e priorizando o menor
consumo de insumos, os sistemas formados por 20% (m/m) etanol/22% (m/m) sulfato
de amônio (condição E13) e 20% (m/m)/18% (m/m) sulfato de amônio foram
selecionados para a etapa seguinte.
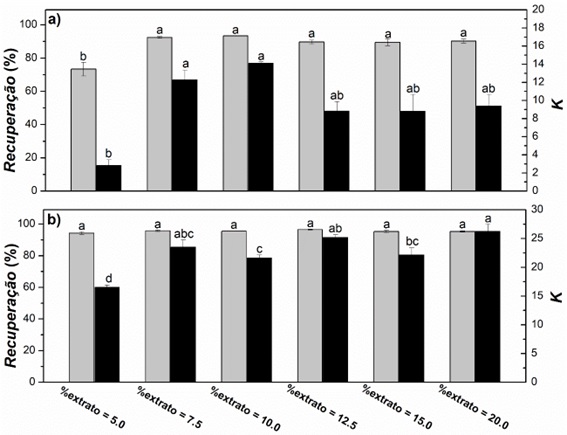
A Figura 2 apresenta os valores de recuperação e coeficiente de partição de
antocianinas sob diferentes dosagens de extrato de mirtilo. O aumento do
percentual de extrato está diretamente associado à produtividade do isolamento
da antocianina e, portanto, deve ser incentivada desde que não comprometa as
respostas de extração.
No presente estudo, maiores percentuais de extrato no ambiente foram benéficos.
O aumento do percentual de extrato de 5% para 7,5% aumentou os valores de
recuperação de antocianinas de 73,5% para 92,8%. Em maiores concentrações de
extrato, a recuperação de antocianina reduziu levemente para 90%, porém o teste
de média não registrou diferenças estatísticas. Nos sistemas com PEG 400, a
resposta recuperação foi indiferente à ampla variação do percentual de extrato.
Apenas o coeficiente de partição foi alterado com o percentual de extrato,
inclusive, com seu valor máximo (26,4) alcançado com 20% (m/m) extrato. Conforme
mencionado anteriormente, o extrato de mirtilo possivelmente apresentou baixa
quantidade de sólidos solúveis e, portanto, não afetaria nem a composição das
fases nem a recuperação na fase topo. Logo, o percentual de extrato de mirtilo
de 20% (m/m) foi levado aos experimentos seguintes.
A escolha do pH afeta diretamente a carga de superfície de solutos e, portanto,
pode comprometer a partição deles em experimentos de extração líquido-líquido
(Reis et al., 2015). Destaca-se também que nós evitamos operar em pH superiores
a 7,0, uma vez que haveria degradação das antocianinas. Contudo, de acordo com
estudos prévios, a variação de pH não afetou os resultados de recuperação de
antocianinas para ambos os sistemas aquosos bifásicos. Por sua vez, a variação
de pH impactou os coeficientes de partição. Os coeficientes de partição máximos
nos sistemas etanol/sal e polímero/sal foram obtidos com pH igual a 4,0 e 5,5,
respectivamente. Isso contrasta com a expectativa de que em menores valores de
pH as antocianinas estabeleceriam mais ligações de hidrogênio, uma vez que elas
apresentam pKa inferior a 3,5 (Claúdio et al., 2012). Em suma, visto que a
adição de base ou ácido é um esforço adicional e não afetou a recuperação de
antocianinas, é preferível operar sem ajuste de pH.
Conclusões
Os sistemas aquosos bifásicos compostos por etanol/sulfato de amônio e PEG 400/sulfato de amônio foram adequados para a extração e purificação parcial de antocianinas de extrato de mirtilo. Resultados promissores de recuperação foram alcançados em ambos os sistemas, chegando a superar 90%. Além de dispensar o ajuste de pH, a técnica usada permitiu aumentar a quantidade de extrato no sistema sem comprometer o seu desempenho. É interessante investigar em trabalhos futuros a integração da extração com sistemas baseados em etanol (solvente volátil) com outras técnicas de downstream processing de maior resolução, tais como a cromatografia de adsorção. Ainda assim, os resultados mostrados já projetam a extração em sistemas aquosos bifásicos como alternativa em potencial à meios convencionais para isolar pigmentos naturais.
Agradecimentos
Agradecemos ao suporte dado pelo Conselho de Desenvolvimento Científico e Tecnológico (CNPq) e à Universidade Federal do Rio Grande do Norte (UFRN) pelo apoio e suporte fornecidos para o desenvolvimento deste trabalho.
Referências
Carvalho, J. C. R. D. (2022). Recuperação e purificação de invertases de Saccharomyces cerevisiae usando sistema aquoso bifásico PEG 1500/sulfato de magnésio em microcanais (Master's thesis, Universidade Federal do Rio Grande do Norte).
Cláudio, A. F. M., Ferreira, A. M., Freire, C. S., Silvestre, A. J., Freire, M. G., & Coutinho, J. A. (2012). Optimization of the gallic acid extraction using ionic-liquid-based aqueous two-phase systems. Separation and Purification Technology, 97, 142-149.
Hua, Z., Yuesheng, D., Ge, X., Menglu, L., Liya, D., LiJia, A., & Zhilong, X. (2013). Extraction and purification of anthocyanins from the fruit residues of Vaccinium uliginosum Linn. J. Chromatogr. Sep. Tech, 4(02).
Hutabarat, R. P., Xiao, Y. D., Wu, H., Wang, J., Li, D. J., & Huang, W. Y. (2019). Identification of anthocyanins and optimization of their extraction from rabbiteye blueberry fruits in Nanjing. Journal of food quality, 2019.
Março, P. H., Poppi, R. J., & Scarminio, I. S.. (2008). Procedimentos analíticos para identificação de antocianinas presentes em extratos naturais. Química Nova, 31(5), 1218–1223. https://doi.org/10.1590/S0100-40422008000500051
Nelson HH, Alicia LM, M Lourdes GM, M Luisa EG, Francisco JH. (2009). Colour, pH stability and antioxidant activity of anthocyanin rutinosides isolated from tamarillo fruit (Solanum betaceum Cav). Food Chemistry, v.117, p. 88-93.
Nogueira, C. D. C., de Araújo Padilha, C. E., de Souza Filho, P. F., & dos Santos, E. S. (2022). Effects of the addition of poly (ethylene glycol) and non-ionic surfactants on pretreatment, enzymatic hydrolysis, and ethanol fermentation. BioEnergy Research, 1-16.
Oliveira Filho, M. A., Caldas, M. C. B., Vasconcelos, L. T. C. D. P., Ribeiro, V. T., Araujo, J. S. D., de Araújo Padilha, C. E., ... & dos Santos, E. S. (2020). Partitioning and recovery of an elongation factor (1-γ) of Leishmania infantum chagasi expressed in E. coli M15 with simultaneous endotoxin removal using aqueous two-phase system. Separation Science and Technology, 55(6), 1156-1166.
PEREIRA, Rafaela Corrêa; ANGELIS-PEREIRA, Michel Cardoso de. Compostos fenólicos na saúde humana: do alimento ao organismo. Lavras: Editora UFLA, 2014.
Reis, I. A., Campos, A. F., Santos, P. H., Santos, S. B., Soares, C. M., & Lima, Á. S. (2015). Potassium phosphate salts-based aqueous two-phase systems applied in the extraction of gallic acid from guava. Separation Science and Technology, 50(4), 520-528.
Schiozer, A. L.; Barata, L. E. S. (2013). Estabilidade de Corantes e Pigmentos de Origem Vegetal. Revista Fitos. 3(2), 6-24.
Tang, X., Wang, Y., Han, J., Wang, L., Li, C., & Ni, L. (2018). Separation, purification of anthocyanin and vitis linn polysaccharide from grape juice by the two‐step extraction and dialysis. Journal of Food Processing and Preservation, 42(1), e13344.
Tsao, Rong. "Chemistry and biochemistry of dietary polyphenols." Nutrients 2.12 (2010): 1231-1246.
Zardo, I. (2014). Extração e microencapsulação de compostos antociânicos do bagaço de mirtilo (Vaccinium corymbosum L.).
















