ÁREA
Química de Produtos Naturais
Autores
Pereira Pinheiro, C. (UNIFESP) ; Oliveira Santana Junior, A. (UNIFESP) ; Agostini de Moraes, M. (UNIFESP) ; Tadeu Lazzarotto Bresolin, I. (UNIFESP)
RESUMO
Na literatura científica não há estudos que analisam a influência da temperatura na adsorção de imunoglobulina G (IgG) pela fibroína.O objetivo deste estudo foi avaliar o comportamento da adsorção de IgG humana nas micropartículas de fibroína ao alterar a temperatura de 5 °C para 37 °C. Usando o processo de atomização, as micropartículas foram produzidas a partir de uma solução de fibroína. O diâmetro médio das micropartículas foi de 108,5 μm. A 25 °C, a capacidade de adsorção foi de 704,29 mg/g. A energia de Gibbs para 25 °C foi menor do que para 37 °C. A capacidade de adsorção encontrada neste estudo para adsorção de IgG por micropartículas de fibroína foi superior aos relatados na literatura para outros adsorventes biopoliméricos.
Palavras Chaves
Atomização; entropia; entalpia
Introdução
As imunoglobulinas são glicoproteínas que desempenham inúmeras funções importantes ao interagir com diferentes corpos celulares, sendo a principal a proteção, pois os anticorpos são secretados pelos linfócitos B em resposta à exposição a um antígeno. As imunoglobulinas de mamíferos são divididas em cinco classes com base em suas propriedades estruturais e biológicas: IgA, IgD, IgE, IgM e IgG, sendo esta última a mais abundante (ABBAS; LICHTMAN; PILLAI, 2015). A imunoglobulina G desempenha importante papel na defesa imunológica contra patógenos. Está envolvido em diversos tratamentos, por exemplo, no tratamento de imunodeficiências congênitas ou adquiridas, onde o paciente pode ter deficiência de IgG ou alguma subclasse de IgG (KEMPF et al, 2007). No Brasil a produção de IgG purificada, nas doses exigidas, é baixa, tornando-se necessária sua importação. A IgG é obtida por meio do fracionamento do plasma humano por precipitação com etanol, baseado no método clássico de Cohn et al, (1946) combinado com processos cromatográficos baseados em adsorção. A técnica de adsorção, utilizada na cromatografia de troca iônica, é amplamente utilizada para obtenção de IgG, pois muitas proteínas podem ter uma carga superficial derivada de seus aminoácidos. Além disso, o pH do meio influência a carga superficial das proteínas, fornecendo um meio simples de regular as propriedades adsortivas dos anticorpos. Além disso, a temperatura tem forte influência na capacidade de adsorção (NFOR et al, 2008). A fibroína de seda pode ser usada como uma matriz de troca iônica. A fibroína da seda é um polímero natural obtido dos casulos do bicho-da-seda Bombyx mori e das teias de aranha Nephila clavipes (MANDAL et al, 2009). A fibroína é composta por duas cadeias, uma com alta massa molecular de aproximadamente 325 kDa e outra com baixa massa molecular de aproximadamente 25 kDa (ALTMAN et al, 2003). A sericina, que também está presente no casulo, tem a função de unir os fios de fibroína e servir de proteção para o casulo (WENK et al, 2010; ALTMAN et al, 2003). A fibroína é uma matriz anfotérica que troca íons, e o pH do meio pode controlar a passagem de íons (Chen et al. 1994), ou seja, a fibroína é uma matriz que depende do pH (KAPOOR e KUNDU 2016). Filmes de fibroína foram usados por Wongpanit e Rujiravanit (2012) para adsorver corantes catiônicos e aniônicos. Embora o ponto de carga zero da fibroína esteja entre o pH 3,8 e 4,5 (dependendo do método utilizado para análise), os filmes foram capazes de adsorver ambos os corantes. Nitayaphat e Jintakosol (2022) usaram fibroína obtida por gotejamento em um banho de metanol para adsorver Ag+1. A fibroína possui grupos funcionais como amino (-NH2) e carboxila (-COOH) que podem se ligar a metais. Apesar da fibroína apresentar alta capacidade para adsorção de corantes e metais, não há estudos na literatura que avaliem a adsorção de IgG pela fibroína. Assim, verificar a influência da temperatura da adsorção de IgG em micropartículas de fibroína foi o foco deste trabalho. Com os resultados obtidos neste estudo, será possível estudar novos casos de aplicação de micropartículas tendo em conta o meio em que são inseridas, e o aperfeiçoamento de técnicas de purificação de IgG que possam ser aplicadas na área farmacêutica.
Material e métodos
Os casulos do bicho-da-seda da espécie Bombyx mori foram fornecidos pela Bratac (Londrina, Brasil). IgG de alta pureza foi obtido da Octapharma (Áustria). Outros reagentes químicos são de grau analítico. A solução de fibroína foi preparada primeiramente removendo a sericina. Em um banho com 600 mL de solução aquosa de Na2CO3 (1 g/L) para cada 50 g de casulo por 90 minutos à 85°C. Em seguida a fibroína sem sericina foi lavada com água destilada. Após, a fibroína foi seca em temperatura ambiente por 24 horas. Os fios foram triturados. Para cada 10 g de fibroína, foram adicionados 100 mL de solução ternária de CaCl2, CH3CH2OH e H2O na proporção molar de 1:2:8, respectivamente, e a suspensão obtida foi mantida a 85 °C por 90 minutos. A solução salina de fibroína a 10% (p/v) foi dialisada em água destilada por 3 dias, a 10 °C, na proporção volumétrica de 1:15 (fibroína:água). As micropartículas de fibroína foram preparadas por atomização, utilizando etanol como coagulante. O sistema de atomização é composto por um bico atomizador com diâmetro de 0,5 mm (Labmaq, Brasil), uma bomba peristáltica TE- BP-01 Mini (Tecnal, Brasil) e um compressor modelo OP8,1/30II (Pressão, Brasil). O bico atomizador foi posicionado 14 cm acima da solução coagulante sob agitação. A solução de fibroína de seda foi bombeada a uma vazão de 0,045 L/h com pressão de ar comprimido de 1 bar. Posteriormente, as micropartículas foram mantidas em repouso por 30 minutos e depois agitadas por 10 minutos. Adsorção foi realizada utilizando o tampão MOPS (pH 8), 30 rpm, com 0,4 mL de suspensão (25% v v-1) de micropartículas de fibroína, 25 mg/mL de IgG e a temperatura foi variada entre 5 °C e 37 °C. Foi utilizado um rotador de tubo do tipo revólver (Thermo Scientific, EUA). Após 1 h os tubos contendo 2 mL no total foram centrifugados por 5 minutos (2300 rpm). A quantificação de IgG foi realizada pela leitura da absorbância a 280 nm em um espectrofotômetro UV-VIS modelo UV-1280 (Thermo Scientific, EUA). A capacidade de adsorção foi obtida pela Equação 1. O modelo de Langmuir- Freundlich (Equação 2) foi ajustado aos dados experimentais usando o método iterativo de Levenberg-Marquardt usando o software Origin® (Microcal, EUA). Os parâmetros termodinâmicos foram calculados pelas equações 3 e 4.
Resultado e discussão
A maior capacidade de adsorção foi obtida para o tampão MOPS em pH 8,- (704,29
mg/g) à temperatura de 25 °C.
Em pH 8,0, a fibroína tem uma carga negativa e a IgG, uma carga neutra. Adsorção
depende dos grupos hidrofóbicos e não dos grupos hidrofílicos. Wongpanit e
Rujiravanit (2012) também conseguiram adsorver um adsorvato com a mesma carga
superficial da fibroína, pois a maioria dos aminoácidos da fibroína não
apresentam carga. Assim, a fibroína pode adsorver adsorvatos que possuem a mesma
carga. A fibroína é composta por mais grupos hidrofóbicos do que grupos
hidrofílicos, sendo que os grupos hidrofílicos são os principais responsáveis
pela variação da carga (NITAYAPHAT e JINTAKOSOL 2020).
O trabalho de Mourão et al, (2019) utilizando criogéis monolíticos de
poliacrilamida-alginato para a purificação de IgG de soro humano, necessitaram
de 8 horas para adsorver 36,12 ± 3,63 mg/g. Marcuz et al, (2021) necessitaram de
8 horas para adsorver 91,75 ± 7,92 mg/g de IgG com ortofosfotirosina imobilizada
em criogéis de poliacrilamida-alginato-epoxi. Ambos os valores são muito
inferiores a qe obtido neste trabalho. Shinku et al, (2023) adsorveram IgG com
Phenyl Sepharose 6 Fast Flow High Sub e Phenyl Sepharose 6 Fast Flow Low Sub, a
maior capacidade de adsorção foi de 56,30 ± 6,50 mg/mL para pH 7,4. Além disso,
Xu et al, (2020) precisou de apenas 30 minutos para adsorver 495,8 mg/g de IgG
utilizando ácido 4-carboxifenilborônico modificado. Vale ressaltar que as
micropartículas de fibroína utilizadas neste trabalho para adsorção de IgG são
compostas por um polímero natural (ALTMAN et al, 2003), obtido de fonte
renovável, é biodegradável (ROCKWOOD et al, 2011) e no momento não existem
estudos que avaliam sua aplicabilidade como matriz para adsorção de IgG humana.
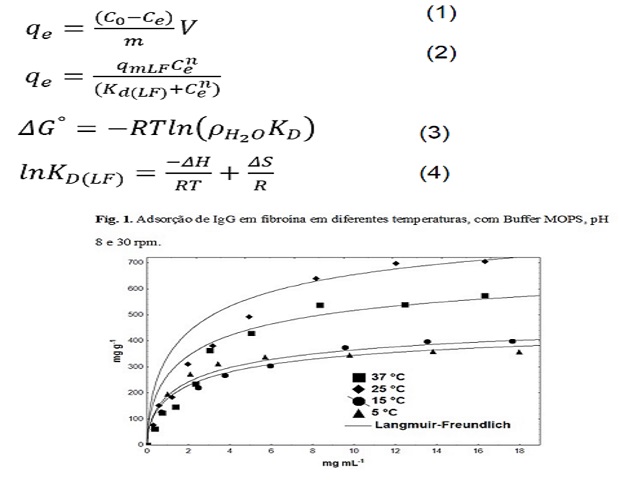
A Fig. 1 apresenta os dados de adsorção de IgG pela fibroína em diferentes
temperaturas, com o tampão MOPS, pH 8,0. Como pode ser observado, a capacidade
de adsorção aumentou de 5 °C para 25 °C, mas diminuiu de 25 °C para 37 °C.
Geralmente, o aumento da temperatura diminui a capacidade de adsorção quando
adsorção é física, indicando que a adsorção de IgG por fibroína é física
(fisissorção) e não química (quimissorção).
A redução da capacidade de adsorção a 37 °C, provavelmente, deve-se ao fato de a
adsorção ser física (fisissorção) e não química (quimissorção). Além disso, com
o aumento da temperatura até 65 °C, a fração de α-hélices da IgG aumenta,
enquanto a fração de folhas β dá IgG diminui (VERMEER e NORDE 2000).
Passaro et al, (2019) também obtiveram redução na capacidade de adsorção de IgG
com o aumento da temperatura, utilizando Epóxi Quitosana/Alginato como
adsorvente e com Reativo Verde Imobilizado, para pH 7,6. Para 5 °C obtiveram 400
mg/g, mas para 37 °C apenas 200 mg/g. Desnaturação de IgG é induzida pelo calor.
Analisando a Tabela 1, o modelo de Langmuir-Freundlich foi mais bem ajustado
para temperatura de 25 °C. Todos os resultados apresentaram R2 maior que 0,98.
Para todas as temperaturas 0 < n < 1, ou seja, a adsorção de uma molécula não
favoreceu a adsorção de outra molécula, apresentando cooperatividade negativa.
Para o comportamento termodinâmico, a variação da energia livre de Gibbs foi
negativa para todas as temperaturas, conforme Tabela 2, indicando que o processo
foi espontâneo. O aumento da temperatura favoreceu a adsorção até 25 °C, pois os
valores de ΔG diminuíram com o aumento da temperatura. No entanto, ΔG para 25 °C
foi menor do que para 37 °C, com isso, a capacidade de adsorção para 25 °C foi
maior do que para 37 °C. O valor positivo de ΔS indicou um aumento na desordem
do sistema na interface sólido-líquido após a adsorção. O valor positivo de ΔH
está associado à solvatação das moléculas de IgG devido ao solvente, portanto, a
energia necessária para vencer a solvatação foi maior que a energia liberada
pela ligação entre o adsorvente e o adsorvato.
Equações usadas e figura 1 - Adsorção de IgG em \r\nfibroína em diferentes temperaturas, com Buffer \r\nMOPS, pH 8 e 30 rpm.

Parâmetros do ajuste do modelo de Langmuir-\r\nFreundlich e parâmetros termodinâmicos da adsorção.
Conclusões
Utilizando o tampão MOPS em pH 8,0, 25 °C e 30 rpm, foi possível obter uma capacidade de adsorção de 704,29 mg/g. Além disso, a capacidade de adsorção obtida neste trabalho é maior que a obtida na literatura para outros adsorventes. Além disso, a adsorção ocorreu devido à presença de grupos hidrofóbicos da fibroína. O aumento da temperatura de 4 °C para 25 °C aumentou a capacidade de adsorção. A variação da energia livre de Gibbs foi negativa para todas as temperaturas. Portanto, com os resultados promissores obtidos durante o trabalho, será possível estudar novas aplicações de micropartículas de fibroína e aprimorar as técnicas de purificação de IgG.
Agradecimentos
Os autores agradecem o apoio financeiro recebido do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq/Brasil) e da Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP/Brasil) (2022/05336-6).
Referências
Abbas, A. K.; Lichtman, A. H.; Pillai, S. Imunologia Celular e Molecular. 8. ed. [S. l.]: Saunders Elsevier, 2015. E-book.
Altman, G. H.; Diaz, F.; Jakuba, C.; Calabro, T.; Horan, R. L.; Chen, J.; Kaplan, D. L. Silk-based biomaterials. Biomaterials, n° 24, 401-416, 2003
Chen, J.; Minoura, N.; Tanioka, A. Transport of pharmaceuticals through silk fibroin membrane. Polymer, n° 35, 2853-2856, 1994
Cohn, E. J.; Strong, L. E.; Hughes, W.; Mulford, D. J.; Ashworth, J. N.; Melin, M. E.; Taylor, H. L. Preparation and Properties of Serum and Plasma Proteins. IV. A System for the Separation into Fractions of the Protein and Lipoprotein Components of Biological Tissues and Fluids. American Chemical Society, n° 68, 459–475, 1946
Kapoor, S.; Kundu, S. C. Silk protein-based hydrogels: Promising advanced materials for biomedical applications. Acta Biomaterialia, n° 31, 17-32, 2016
Kempf, C.; Stucki, M.; Boschetti, N. Pathogen inactivation and removal procedures used in the production of intravenous immunoglobulins. Biologicals, n° 35, 35-42, 2007
Mandal, B. B.; Kundu, S. C. Cell proliferation and migration in silk fibroin 3D scaffolds. Biomaterials, n° 30, 2956-2965, 2009
Marcuz, C.; Mourão, C. A.; Haupt, K.; Bueno, S. M. A. Performance of phospho-L-tyrosine immobilized onto alginate/polyacrylamide-based cryogels: Effect of ligand coupling on human IgG adsorption and Fab fragments separation. Journal of Chromatography B, n° 1165, 122530, 2021
Mourão, C. A.; Marcuz, C.; Haupt, K.; Bueno, S. M. A. Polyacrylamide-alginate (PAAm-Alg) and phospho-L-tyrosine-linked PAAm-Alg monolithic cryogels: Purification of IgG from human serum. Journal of Chromatography B, n° 1129, 121783, 2019
Nfor, B. K.; Ahamed, T.; van Dedem, G. W.; van der Wielen, L. A.; van de Sandt, E. J.; Eppink, M. H.; Ottens, M. Design strategies for integrated protein purification processes: challenges, progress and outlook. Bioseparation, n° 83, 124-132, 2008
Nitayaphat, W.; Jintakosol, T. Efficient removal of cationic and anionic dyes from aqueous solutions using regenerated silk fibroin beads. Asian Journal of Chemistry, n° 32, 1623-1629, 2020
Nitayaphat, W.; Jintakosol, T. Adsorption of Ag (I) from aqueous solutions using regenerated silk fibroin adsorbent beads. Journal of Natural Fibers, n° 19, 3365-3377, 2022
Passaro, A. C. M.; Mozetic, T. M.; Schmitz, J. E.; da Silva Jr, I. J.; Martins, T. D.; Bresolin, I. T. L. Human immunoglobulin G adsorption in epoxy chitosan/alginate adsorbents: evaluation of isotherms by artificial neural networks. Chemical Product and Process Modeling, n° 14, 20190077, 2019
Rockwood, D. N.; Preda, R. C.; Yücel, T.; Wang, X.; Lovett, M. L.; Kaplan, D. L. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. Nature Protocols, n° 6, 1612–1631, 2011
Shinku, C. A.; Martins, T. D.; Bresolin, I. T.; Bresolin, I. R. Human immunoglobulin G adsorption in hydrophobic ligands: equilibrium data, isotherm modelling and prediction using artificial neural networks. Chemical Papers, n° 77, 1213–1229, 2023
Vermeer, A. W.; Norde, W. The thermal stability of immunoglobulin: unfolding and aggregation of a multi-domain protein. Biophysical Journal, n° 78, 394-404, 2000
Wenk, E.; Merkle, H. P.; Meinel, L. Silk fibroin as a vehicle for drug delivery applications. Journal of Controlled Release, n° 150, 128-141, 2011
Wongpanit, P.; Rujiravanit, R. Combinatorial effects of charge characteristics and hydrophobicity of silk fibroin on the sorption and release of charged dyes. Journal of Biomaterials Science, n° 23, 1199-1215, 2012
Xu, W.; Cao, J. F.; Zhang, Y. Y.; Shu, Y.; Wang, J. H. Boronic acid modified polyoxometalate-alginate hybrid for the isolation of glycoproteins at neutral environment. Talanta, n° 210, 120620, 2020
















