ÁREA
Química Ambiental
Autores
Sabino, L. (UFRN) ; Barbosa Segundo, I. (UFRN) ; Araujo, D. (UFRN) ; Martinez-huitle, C. (UFRN)
RESUMO
Os compostos químicos presentes nos protetores solares, como os filtros UV orgânicos, podem ter efeitos adversos nos ecossistemas aquáticos. Por isso, faz-se necessário o tratamento adequado de efluentes que possuem esse tipo de contaminação. Este trabalho apresenta um tratamento eletroquímico para água de piscina contaminada com protetor solar comercial, usando diamante dopado com boro (BDD) como ânodo, aço inoxidável como cátodo em um reator em fluxo. A eficácia do processo foi avaliada principalmente pela análise da remoção da demanda química de oxigênio (DQO) e consumo de energia. Utilizando uma densidade de corrente de 10 mA/cm², foi possível obter uma remoção de carga orgânica de 53%, ou seja, o tratamento é satisfatório ao que se propõe.
Palavras Chaves
OXIDAÇÃO ELETROQUÍMICA; PROTETOR SOLAR; BDD
Introdução
Os protetores solares geralmente contêm uma mistura de ingredientes químicos e físicos para proteger a pele dos raios UV prejudiciais do sol. A persistência dos filtros químicos de protetores solares na água após a aplicação na pele torna-se uma preocupação, principalmente quando se trata da proteção dos ecossistemas aquáticos (GIOKAS et al., 2005) (SHARIFAN; KLEIN; MORSE, 2016). Alguns filtros químicos podem ser lixiviados da pele para a água durante atividades aquáticas, e isso pode afetar negativamente o ambiente e os seres humanos (SHARIFAN; KLEIN; MORSE, 2016). Alguns desses componentes possuem particularidades preocupantes em relação à saúde, como por exemplo, interferir no sistema endócrino, devido à sua semelhança estrutural com hormônios naturais (ZHOU et al., 2020). Os processos eletroquímicos oxidativos avançados (PEOAs) são ferramentas muito úteis no tratamento de efluentes contaminados, especialmente quando se trata da degradação dos compostos orgânicos presentes nesses produtos. Alguns desses processos são: oxidação eletroquímica, eletrofloculação, eletro-fenton, entre outros. A oxidação eletroquímica (OE) tem como principal característica gerar espécies altamente oxidantes, como os radicais hidroxila (OH.), que atacam e degradam os poluentes orgânicos, transformando-os em produtos menos tóxicos ou inofensivos. A OE é eficaz na remoção de compostos orgânicos persistentes e poluentes emergentes (MARTÍNEZ-HUITLE et al., 2023).
Material e métodos
Os experimentos de OE foram realizados em uma planta em escala de laboratório, empregando um fluxo eletroquímico e célula acoplada a um tanque de armazenamento de 2 litros de capacidade. A Figura 1 mostra o diagrama de montagem experimental. A célula eletroquímica consiste em uma placa circular de aço inoxidável como cátodo e um BDD como o ânodo (fornecido pela Metaken, Alemanha), ambos com superfície ativa de 69,4cm2, separados por uma distância de 1,7 cm e com apenas um lado exposto à solução. Para cada experimento, 1,2 litros de água destilada ou água de piscina pública, previamente contaminada com 0,4g de protetor solar comercial, foram colocados no tanque reservatório, juntamente com o eletrólito suporte (NaCl DINAMICA- apenas para as soluções com água destilada), com concentração de 0,01M que foi recirculado através da célula do compartimento de reação usando uma bomba peristáltica com uma constante de vazão de aproximadamente 162 L h-1 , à temperatura ambiente. As eletrólises foram realizadas sob condições galvanostáticas aplicando 10 mAcm-2 de uma fonte MINIPA MPL-3305M. Os experimentos foram conduzidos por 180 min e as amostras foram coletadas em intervalos específicos. A diminuição da DQO foi avaliada pelo método fotométrico usando um fotômetro multiparâmetro HANNA HI modelo 83099 após duas horas de digestão da amostra a 150°C em um termorreator (HANNA modelo HI 839800). As condições de pH foram monitoradas usando um medidor de pH HANNA da Nova Instruments.
Resultado e discussão
Icialmente foi realizado um teste com o tratamento de água destilada com a
quantidade mínima de NaCl adotada(0,01M)até a densidade de corrente máxima
possível(36,3 mAcm-2)e depois, outro teste com a densidade de corrente de 10
mAcm-2 com a mesma concentração de 0,01M do eletrólito. A degradação da carga
orgânica presente na água foi um pouco mais rápida utilizando uma maior
densidade de corrente(Figura 2A),mas ao final dos 180 minutos a degradação é
quase a mesma, sendo a degradação com a densidade máxima apenas 7% a mais que a
degradação com a densidade de 10 mAcm-2.Um fator a ser ponderado para explicar o
comportamento anterior é a composição da solução ao longo do tratamento, podendo
favorecer a formação de outras espécies oxidantes a partir do eletrólito
suporte, como o cloro ativo.O acréscimo na densidade de corrente favorece
algumas reações indesejadas,como a oxidação dos cloretos;cujo foco não é a
degradação da matéria orgânica (GANIYU;ZHOU;MARTÍNEZ-HUITLE,2018) . Por isso, a
diferença na degradação entre as densidades corrente utilizadas não são tão
significativas, mesmo que uma seja quase 4 vezes maior que a
outra.Posteriormente,foi realizado o tratamento da água de piscina sem a adição
de eletrólito.Foi adotada a mesma condição de densidade de corrente(10 mAcm-2).
A degradação da matéria orgânica na água de piscina é cerca de 21% menor que na
água destilada com a mesma densidade de corrente(Figura 2A),isso se deve ao fato
de que na água real há uma maior quantidade de matéria orgânica fora o protetor
solar adicionado, aumentando também o tempo de degradação.Por outro lado,o
consumo energético no experimento utilizando água de piscina é cerca de 2 vezes
menor(Figura 2B),pois o acréscimo de sais à solução e o consequente aumento da
salinidade(VIEIRA et al.,2023)
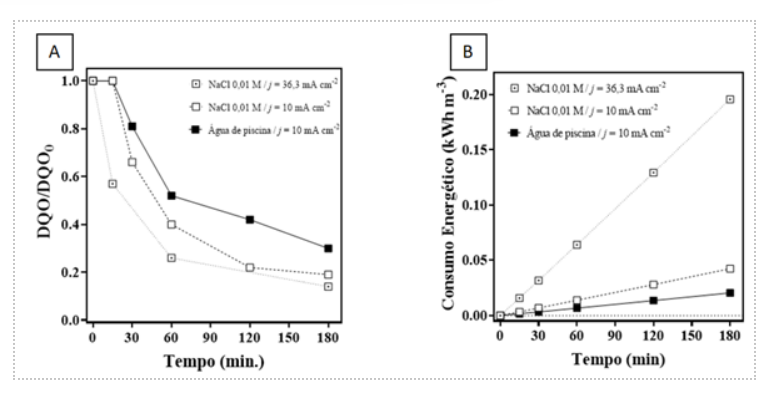
Figura 2A: Remoção de DQO e figura 2B: consumo \r\nenergético; ambos ao longo dos 180 min de \r\nexperimento, em água de piscina e em água destilada.
Conclusões
Ainda que o estudo esteja em fase inicial e com resultados preliminares, percebe- se grande potencial do tratamento eletroquímico abordado, uma nova perspectiva para o tratamento de água de piscina, a fim de que, ao ser descartada, a água possa voltar ao meio ambiente causando o menor impacto possível. A opção por não adicionar eletrólito suporte na solução com água de piscina favorece ainda mais a economia do processo, uma vez que as piscinas já são tratadas com cloro. Faz-se necessário complementar os estudos acerca desse tratamento levando em consideração outros parâmetros.
Agradecimentos
O presente trabalho foi realizado com o apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001
Referências
GANIYU, S. O.; ZHOU, M.; MARTÍNEZ-HUITLE, C. A. Heterogeneous electro-Fenton and photoelectro-Fenton processes: A critical review of fundamental principles and application for water/wastewater treatment. Applied Catalysis B: Environmental, v. 235, p. 103–129, 5 nov. 2018.
GIOKAS, D. L. et al. Determination of UV-filter residues in bathing waters by liquid chromatography UV-diode array and gas chromatography–mass spectrometry after micelle mediated extraction-solvent back extraction. Journal of Chromatography A, v. 1077, n. 1, p. 19–27, 3 jun. 2005.
MARTÍNEZ-HUITLE, C. A. et al. A critical review on latest innovations and future challenges of electrochemical technology for the abatement of organics in water. Applied Catalysis B: Environmental, v. 328, p. 122430, 5 jul. 2023.
SHARIFAN, H.; KLEIN, D.; MORSE, A. N. UV filters are an environmental threat in the Gulf of Mexico: a case study of Texas coastal zones. Oceanologia, v. 58, n. 4, p. 327–335, 1 out. 2016.
VIEIRA, G. DE F. et al. Electro-oxidation of wastewater from a beauty salon: The influence of electrolyte type in the removal of organic load and energy consumption. Process Safety and Environmental Protection, v. 177, p. 1260–1271, 1 set. 2023.
ZHOU, X. et al. Assessment of water contamination and health risk of endocrine disrupting chemicals in outdoor and indoor swimming pools. Science of The Total Environment, v. 704, p. 135277, 20 fev. 2020.
















