ÁREA
Química Ambiental
Autores
Lima, R.S. (UFU) ; Figueira, B.A.M. (IFPA) ; Canobre, S.C. (UFU)
RESUMO
Na indústria é utilizado corantes sintéticos denominados azocorantes. Esses corantes sendo oralmente administrados ou entrando em contato com a corrente sanguínea, têm grande potencial para causarem câncer. Então, há necessidade do desenvolvimento de métodos de remoção desses azocorantes em águas contaminadas. Portanto, o objetivo deste trabalho foi sintetizar e caracterizar o hidróxido triplo lamelar (HTL)[Co-Al-Fe-Cl]. Os testes de remoção foram realizados com uma solução de corante de 10 mg L-1, volume de 50 mL com diferentes massas do HTL (10, 15 e 20 mg). A remoção do AM ocorreu rapidamente nos primeiros minutos da adsorção, e posteriormente mais lentamente até atingir o equilíbrio, apresentando uma capacidade adsortiva de 22,68 mgg-1 para 20 mg de HTL.
Palavras Chaves
Azocorante; Alaranjado de metila; Hidróxido triplo lamelar
Introdução
Atualmente, vários tipos de corantes são utilizados para o processo de tingimento têxtil, dentre os mais utilizados estão os azocorantes, classe química comercial mais importante de corantes orgânicos, tendo como principal característica a presença de um ou mais grupos azo (-N=N-), os quais formam pontes entre dois ou mais anéis aromáticos, geralmente associados com grupos auxocromos (-OH ou -NH-) (Guimarães, 2010). Esses constituem 70% da produção total de corantes, devido à simplicidade de sua síntese (Leal, 2011). Dentre os azos está o alaranjado de metila (AM), tem como nomenclatura IUPAC: Sal sódico do ácido 4-dimetilaminaazo benzeno-4-sulfônico; fórmula molecular C14H14N3NaO3S Obeide et al., (2013); massa molar 327,33 g mol-1 Henrique (2022); absorção máxima 460 a 470 nm (Asranudin et al., 2022); pKa 3,46 Silva (2020) e solubilidade em água 5,2 g L-1 a 20°C Mahjoubi et al., (2017). Chowdhury et al. (2023), sintetizaram o HTL do tipo [Ni-Al-Fe] por um método de hidrólise hidrotérmica de ureia e o aplicaram na proporção de 1:1:1 para adsorção do corante vermelho congo, nas seguintes condições: volume de 20 mL, massa de adsorvente de 1,5 g L-1 e pH 6 ± 0,5, obtendo uma adsorção máxima de 57,47 mg g-1 do corante em um tempo de 20 min. Nazir et al. (2022), utilizaram o HTL composto por [Ni-Zn-Al], sintetizado pelo método hidrotérmico, e aplicaram na adsorção do alaranjado de metila em meio aquoso, em pH 6. A capacidade máxima de adsorção obtida utilizando a equação de Langmuir foi de 105,26 mg g-1. Após o 4º ciclo de regeneração, o HTL [Ni-Zn-Al] apresentou uma capacidade adsortiva de 28,61 mg g-1. Os HDLs podem ser obtidos sinteticamente, em laboratório, ou ocorrer naturalmente. Alguns trabalhos reportam a síntese de HDLs com mais de dois cátions na sua estrutura (Bharali, D. et al., 2017; Georgetti F. 2018; Miao J. et al., 2021; Nascimento, R.S et al., 2022, entre outros). Apresentam aplicações tecnológicas e ambientais, de acordo com suas propriedades, como: composição, cristalinidade, estabilidade térmica e outras propriedades físico-químicas (Nazir et al., 2022). Entre as aplicações dos HDLs destaca-se o uso como adsorvente de pesticidas em efluentes (Calisto, 2020), metais pesados (Aquino, 2021), corantes (Chume, 2020; Lemes, 2018) e fármacos (Pacheco et al., 2019; Silva, 2021). O método de adsorção é um processo em que moléculas da fase gasosa ou de um líquido se ligam em uma superfície sólida. Este método é bastante eficiente e versátil para remoção de corantes, devido à grande variedade de adsorventes e por apresentarem boa seletividade (Auta e Hameed, 2013). Com base na revisão bibliográfica, não foram encontrados trabalhos utilizando Hidróxidos Triplos Lamelares do tipo [Co-Al-Fe-Cl], na adsorção do corante alaranjado de metila. Diante disso, o presente trabalho tem como objetivo sintetizar o HTL [Co-Al-Fe-Cl] pelo método de co-precipitação a pH constante, 8,0 ± 0,5, visando sua aplicação como adsorvente do corante alaranjado de metila.
Material e métodos
Materiais: O HTL foi sintetizado a partir dos seguintes reagentes: Cloreto de Cobalto Hexahidratado CoCl2∙6H2O, 100 % puro, marca Cinética; Cloreto de Alumínio Hexahidratado AlCl3∙6H2O, 95% puro, marca Cinética; Cloreto de Ferro Hexahidratado FeCl3∙6H2O, 97% puro, marca Biotec; Hidróxido de Sódio NaOH, 98% puro, marca Dinâmica; Cloreto de Sódio NaCl, 99% puro, marca Isofra; Ácido Clorídrico HCl, 37% puro, marca Neon; Água Deionizada H2O; Alaranjado de Metila C14H14N3NaO3S, P.A marca Vetec. Sínteses do hidróxido triplo lamelar [Co-Al-Fe-Cl]: A síntese do HTL [Co-Al-Fe-Cl], ocorreu pelo método de coprecipitação a pH constante 8 ± 0,5. Uma solução de 500 mL contendo 2 mol de CoCl2∙6H2O, 0,5 mol de AlCl3∙6H2O e 0,5 mol de FeCl3∙6H2O, contendo os reagente cátions (Co+2, Al+3 e Fe+3 com razão molar 2 de divalente : 1 trivalente), foi adicionada gota a gota a uma solução de NaCl (1,5 mol L-1) contendo o ânion a ser intercalado e mantendo-se o pH constante 8 ± 0,5 durante toda a síntese, por meio de uma solução alcalina de NaOH (1 mol L-1) e sob vigorosa agitação a temperatura ambiente. Após toda a solução de metais serem adicionadas na solução alcalina, a solução foi mantida sob agitação por 24 h e em repouso por 24 horas. Em seguida, o precipitado foi filtrado a vácuo, lavado e seco na estufa a 60 °C por 48 horas e macerado. O material final foi peneirado em um equipamento de análise granulométrica (malha 75 Tyler/Mesh) de abertura 200 nm, para padronizar o tamanho das partículas. Caracterização do HTL [Co-Al-Fe-Cl]: Utilizou-se as técnicas de caracterização química por Fluorescência de Raios-X (FRX); Difratômetro de Raio-X (DRX); espectroscopia de infravermelho com transformada de Fourier (FT-IR) e microscopia eletrônica de varredura (MEV). Determinação do pH do ponto de carga zero (pHPCZ) do HTL [Co-Al-Fe-Cl]: Utilizando 11 pontos de pH diferente neutralizou os pontos de pH inicial, mediu- se o pH final após 24 horas. Com os resultado plotou-se um gráfico para obter o PHPCZ. Quantificação do AM: Uma curva de calibração foi construída para quantificar o corante que não adsorveu no HTL, a partir da leitura da absorbância máxima no comprimento de onda de 464 nm no UV- visível. Obteve-se um comportamento linear para as concentrações de 2,5 mg L-1 a 15 mg L-1, com coeficiente de correlação (R2) de 0,9902. Equação da reta obtida na curva de calibração: Y=ABS = 0,0548 ∙ (concentração final do corante) + 0,1306 Ensaio de adsorção do AM com o HTL: Verificou-se a influência do tempo de contato no processo de adsorção do corante AM pelo HTL. Investigando os tempos de 5 a 160 min para a massa de 10 mg; 5 a 130 min para a massa de 15 mg e 5 a 60 min para a massa de 20 mg. Com os resultados do experimento calculou-se a porcentagem de remoção do corante alaranjado de metila e suas respectivas capacidades adsortiva.
Resultado e discussão
Resultados e discussão:
-Caracterização do HTL [Co-Al-Fe-Cl]
-Caracterização química por FRX: Na análise de FRX, foi possível verificar a
composição química do HTL. Com os resultados obtidos foi possível observar que o
composto predominante foi o Co (50%), Al (4,38%) e Fe (20,19%) Onde foi possível
verificar a proporção de 2 do metal diante pra 1 do metal
trivalente.
-Caracterização estrutural por DRX:
Na figura 1 analisando os difratogramas de raios para o HTL [Co-Al-Fe-Cl]
(coloração preta), observa-se a presença de picos de difração 2θ em torno de
11º, 23º, 34º, 39º, 46º, 57º e 60º correspondentes às reflexões (003), (006),
(012), (015), (018), (110) e (113) sendo indexados à simetria romboédrica, grupo
espacial R(-3)m, semelhantes à estrutura do tipo hidrotalcita de acordo com a
ficha cristalográfica (JCPDS N°.14-191), obtendo espaçamento basal 7,6397,
parâmetro (a) 2,3351 e parâmetro (c) 22,9191. Os picos de difração obtidos pelo
DRX do HTL [Co-Al-Fe-Cl] sintetizado foi semelhante ao HDL [Co-Al-Cl] (coloração
verde), sintetizado por Freitas (2017). Portanto, concluiu-se que o HTL [Co-Al-
Fe-Cl] sintetizado apresentou uma estrutura lamelar semelhante ao do HDL [Co-Al-
Cl] e de acordo com a ficha cristalográfica da hidrotalcita, sugerindo um êxito
na síntese pelo método de coprecipitação a pH constante 8,0 ± 0,5.
-Caracterização por FT-IR:
Os espectros do FT-IR do HTL [Co-Al-Fe-Cl](coloração preta) Figura 2 obtidos na
análise de espectroscopia apresentou bandas em 3340 cm-1 que correspondem às
vibrações dos grupos hidroxilas em camadas presentes na folha octaédrica
(Bhuvaneswari et al., 2021b), a banda em torno de 1625 cm-1 está relacionada a
água de hidratação entre as camadas (Shabanian et al., 2020). A banda em 1352
cm-1 corresponde ao estiramento assimétrico dos íons CO32-, que pode estar
relacionado à síntese não ter sido realizada em um sistema fechado e em
atmosfera inerte (Freitas, 2017). Os picos em torno de 400 cm-1 a 800 cm-1
são atribuídos a vibração de alongamento e flexão dos metais com oxigênio (M-O),
as vibrações Al-O em torno de 600 cm-1 a 800 cm-1 (Kang et al., 2022).
-Caracterização morfológica por Microscopia eletrônica de varredura:
Na Figura 3 as imagens de MEV do HTL [Co-Al-Fe-Cl] mostraram uma morfologia
relativamente compacta, do tipo placas constituídas de aglomerados de partículas
com tamanhos irregulares, semelhante à morfologia obtida para o HDL [Co-Al-Cl]
obtido por (Calisto, 2019; Silva 2019).
-Determinação do pH do ponto de carga zero do HTL:
O pHPCZ é o valor de pH em que a adsorção de íons (H+ e OH-) é igual. Para um pH
< pHPCZ, a superfície do HTL está protonada (resultando em uma carga positiva),
e para pH > pHPCZ, a superfície está desprotonada (resultando em uma carga
negativa) (PECO, 2020). Verificou-se que o pKa do corante alaranjado de metila é
3,46, portanto em valores de pH > 3,46 o corante está ionizado prevalecendo a
sua forma aniônica (PREVIDELLO et al., 2006). Então, tendo o pHPCZ do HTL 8,13
Figura 4 os testes de adsorção foram feitos em pH 7,0 ± 0,5. O pH sendo neutro
favorece o tratamento em unidades de tratamento de efluentes pois economiza com
reagentes e tempo para a correção de pH e também no lançamento do efluente no
meio ambiente pois de acordo com a resolução CONAMA N° 430 de 2011, a faixa de
pH considerada ideal para lançamento de efluentes é de 5,00 a 9,00.
-Tempo de Contato entre o corante e o HTL
Com os resultados obtidos para os valores das massas de adsorvente analisadas 10
mg, 15 mg e 20 mg, Figuras 5, 6 e 7 respectivamente, a uma concentração de 10 mg
L-1 do corante, observou-se que a capacidade adsortiva aumentou rapidamente nos
primeiros minutos à medida que aumentou a massa de HTL. Logo após tornou-se mais
lento e quase inalterado indicando que o equilíbrio foi alcançado, para a massa
de 10 mg foi necessário 60 minutos para se obter uma capacidade adsortiva de
20,20 mg g-1, com 15 mg obteve-se uma capacidade adsortiva de 23,33 mg g-1 em 70
minutos quando a adsorção tendeu ao equilíbrio, enquanto que para a massa de 20
mg obteve-se 22,68 mg g-1 em 40 minutos. Portanto, notou-se um menor tempo de
contato menor (para atingir a capacidade adsortiva no equilíbrio) para a massa
de 20 mg de HTL no processo de adsorção do AM (40 minutos). Isto significa que
quando o adsorbato é colocado em contato com o adsorvente, as moléculas ou íons
tendem a fluir do meio aquoso para a superfície do adsorvente até que a
concentração de soluto na fase líquida (Ce) permaneça constante. Nesse estágio é
dito que o sistema atingiu o estado de equilíbrio e a capacidade de adsorção do
adsorvente (qe) é determinada (Nascimento et al., 2014).
-Análise de FT-IR do HTL [Co-Al-Fe-Cl] + AM
Após o processo de adsorção foram feitas análises de FT-IR tanto para o AM
Figura 8 quanto para o HTL + AM Figura 9. Nos espectros vibracionais do corante
observou-se uma banda em 1601 cm-1 atribuída a ligação –C=C–, ligações N=N é
observada em 1519 cm-1, a banda em 1362 cm-1 relacionou-se as ligações (C–C e
C=C dos anéis). Em 1117 cm-1 bandas atribuídas as ligações (C–N), no comprimento
de onda 1031 cm-1 atribuiu-se ao estiramento simétrico SO3, no comprimento de
819 cm-1 são as ligações (C–CH dos anéis) e as bandas nos comprimentos de 692
cm-1 e 617 cm-1 é atribuída as ligações (C–H do anéis) (Marangoni 2009, apud
Zimmermann, 2014). Na espectros obtido do HTL + AM observou-se o aparecimento
de bandas características do corante, banda em 1601 cm-1 que está atribuída a
ligação –C=C–, uma banda em 1117 cm-1 atribuída as ligações (C–N) e uma outra em
1031 cm-1 que é atribuída ao estiramento simétrico (SO3-). Portanto, pode-se
inferir que o corante foi adsorvido pelo HTL provando sua eficácia na adsorção.
-Análise de microscopia eletrônica de varredura do HTL [Co-Al-Fe-Cl] + AM
Nas imagens da morfologia do HTL [Co-Al-Fe-Cl] + AM (após o ensaio de
adsorção) Figura 10, comparando com as imagens feitas antes da adsorção, foi
possível notar um aumento na formação de partículas aglomeradas, não havendo
mudanças significativas na morfologia.
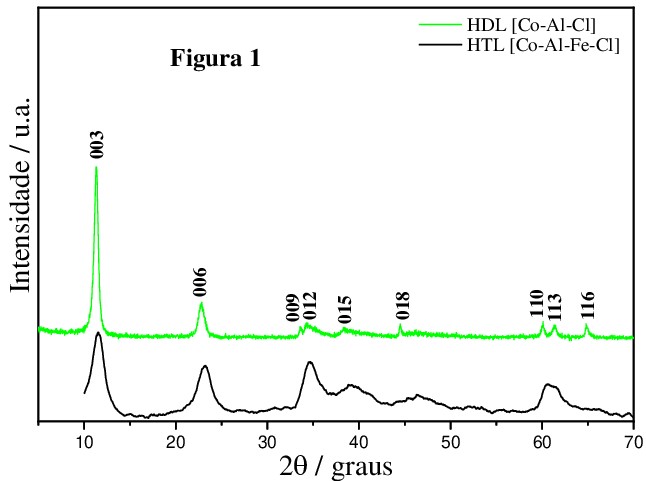
Difratograma de raios x do HTL [Co-Al-Fe-Cl] \r\n(coloração preta), com o DRX do HDL [Co-Al-Cl] \r\n(coloração verde) sintetizado por Freitas (2017).
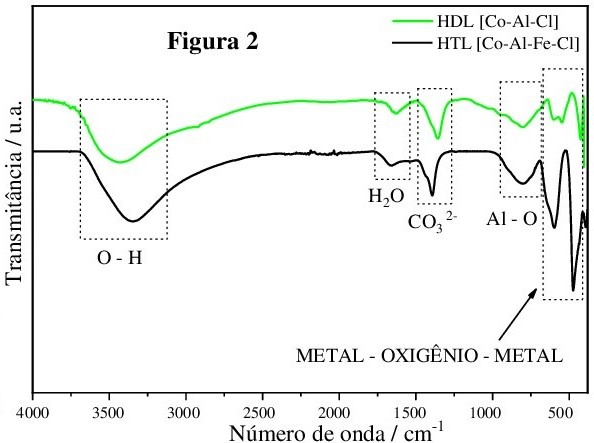
Espectros do HTL Co-Al-Fe-Cl] (coloração preta) \r\njuntamente com o FT-IR do HDL [Co-Al-Cl] (coloração \r\nverde) sintetizado por Freitas (2017).

Morfologia do HTL [Co-Al-Fe-Cl], (A) ampliação de 10 \r\nmil vezes E (B) ampliação de 30 mil vezes
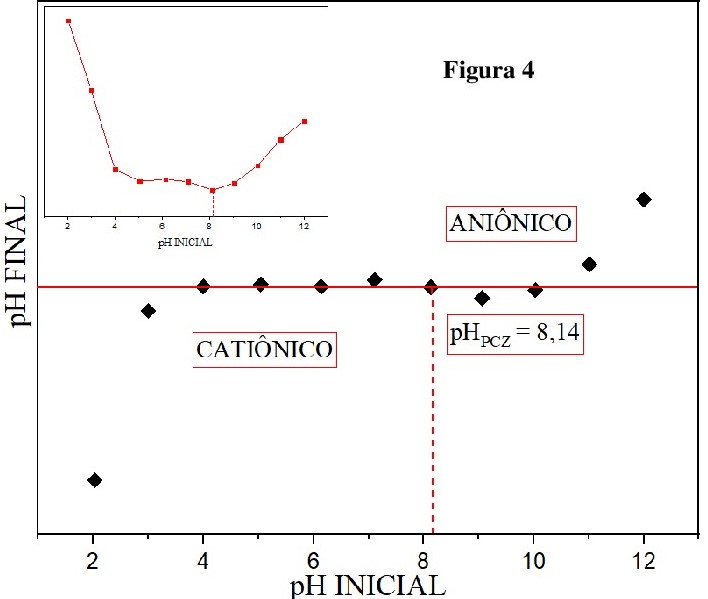
Valores de pH inicial versus pH final para definição \r\ndo pH do ponto de carga zero para o HTL [Co-Al-Fe-\r\nCl].
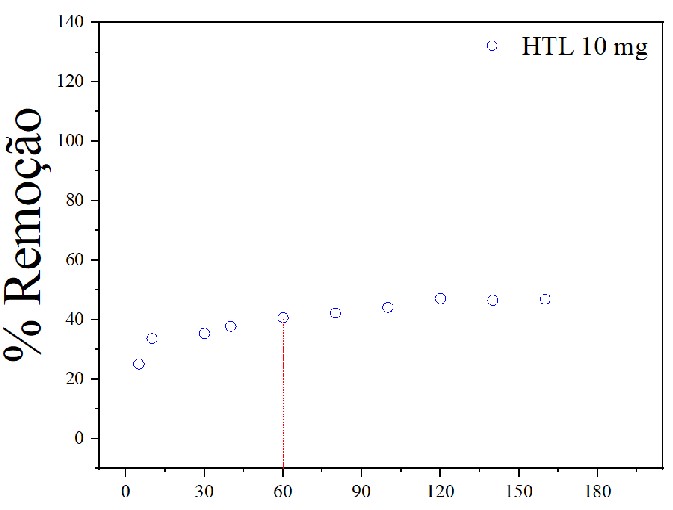
Gráfico de porcentagem de remoção com massa de HTL \r\nde 10 mg
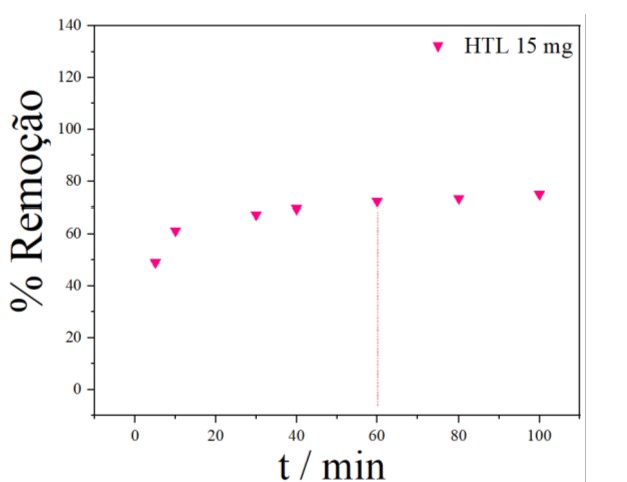
Gráfico de porcentagem de remoção com massa de HTL \r\nde 15 mg
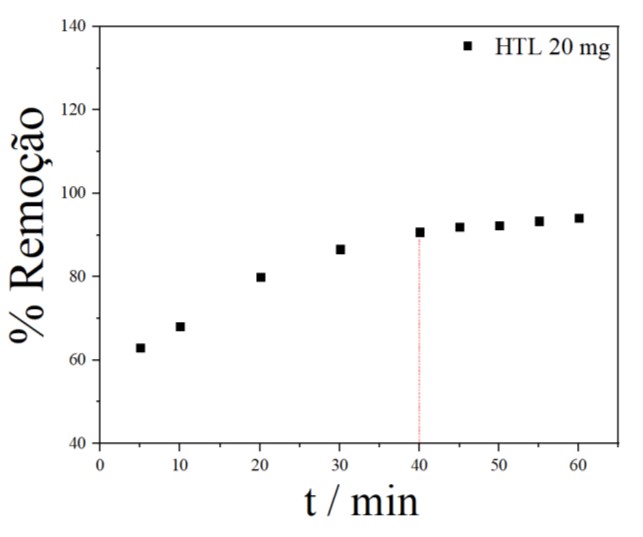
Gráfico de porcentagem de remoção com massa de HTL \r\nde 20 mg
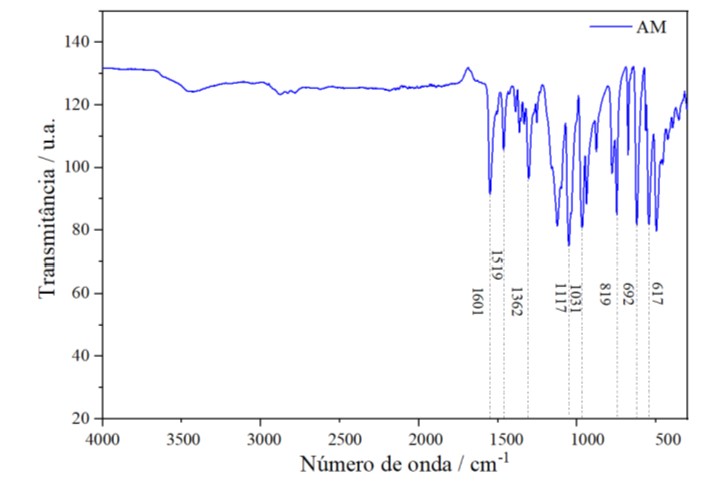
Espectroscopia da região do infravermelho do corante
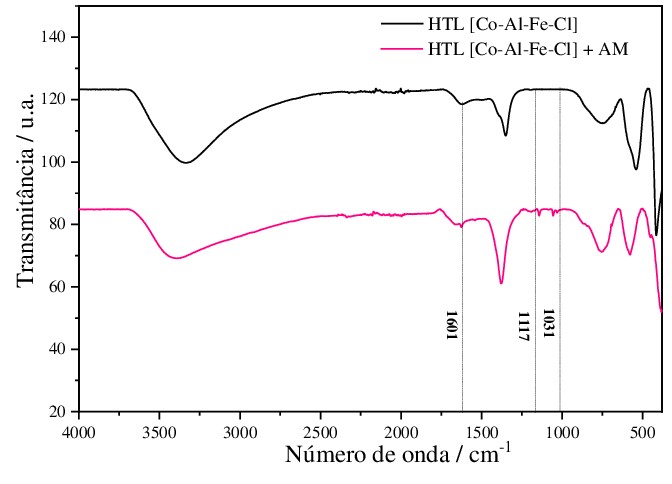
Espectroscopia da região do infravemelho do HTL + AM

Microscopia eletrônica de varredura após adsorção
Conclusões
O HTL [Co-Al-Fe-Cl] sintetizado pelo método de coprecipitação a pH constante 8,0 ± 0,5 apresentou picos de difração bem definidos e sendo indexados à simetria romboédrica, grupo espacial R(-3)m, semelhantes à estrutura do tipo hidrotalcita (JCPDS N°14-191). A morfologia do HTL apresentou placas constituídas de partículas aglomeradas com tamanhos irregulares. O pH do ponto de carga zero pHPCZ para o HTL foi de 8,13, então, valores abaixo do pHPCZ do HTL (forma catiônica) e acima do pKa do corante (forma aniônica) favorece a adsorção. Diante disso, os testes de contato foram feitos com concentração do corante de 10 mg L-1, pH 7,0 ± 0,5, temperatura ambiente a 100 rpm e massas de 10 mg (em 60 minutos, 40,71%, de remoção e capacidade adsortiva 20,20 mg g-1, 15 mg (em 70 minutos, 69,64% de remoção e capacidade adsortiva 23,33 mg g-1 e 20 mg (em 40 minutos, 90,71% de remoção e capacidade adsortiva 22,68 mg g-1) do adsorvente. No FT-IR após a adsorção observou-se o aparecimento de bandas características do corante, podendo comprovar que o corante foi adsorvido pelo HTL provando sua eficácia na adsorção. No MEV após adsorção notou-se apenas um aumento na formação de partículas aglomeradas, não havendo mudanças significativas na morfologia. Esses resultados sugerem que o HTL é um material promissor como adsorvente do alaranjado de metila em águas contaminadas.
Agradecimentos
Agradeço a Universidade Federal de Uberlândia, a minha orientadora Sheila Canobre e meu Coorientador Bruno Figueira.
Referências
AQUINO, Ramon Vinícius Santos de. Uso de hidróxidos duplos lamelares como adsorventes para a remoção de pb2+ de soluções aquosas sintéticas. Dissertação (Mestrado) – Universidade Federal de Pernambuco, Programa de Pós Graduação em Engenharia Química, Recife, 2021.
ASRANUDIN, PURNOMO, A. S.; PRASETYOKO, D.; BAHRUJI, H.; HOLILAH. Single-step synthesis and modification of CTAB-hectorite for efficient adsorption of methyl orange dye, Materials Chemistry and Physics, v. 291, 126749, ISSN 0254-0584, 2022. DOI: https://doi.org/10.1016/j.matchemphys.2022.126749
AUTA, M.; HAMEED, B. H. Coalesced chitosan activated carbon composite for batchand fixed-bed adsorption of cationic and anionic dyes. Colloids Surf. B Bioint-erfaces, v. 105, p. 199–206, ISSN 0927-7765, 2013. DOI: https://doi.org/10.1016/j.colsurfb.2012.12.021
BHARALI, D.; DEKA, R. C. Preferential adsorption of various anionic and cationic dyes from aqueous solution over ternary CuMgAl layered double hydroxide, Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 525, pg. 64-76, ISSN 0927-7757, 2017. DOI: https://doi.org/10.1016/j.colsurfa.2017.04.060
BHUVANESWARI, K.; PALANISAMY, G.; SIVASHANMUGAN K.; PAZHANIVEL, T.; MAIYALAGAN, T. ZnO nanoparticles decorated multiwall carbon nanotube assisted ZnMgAl layered triple hydroxide hybrid photocatalyst for visible light-driven organic pollutants removal, Journal of Environmental Chemical Engineering, v. 9, Issue 1, 104909, ISSN 2213-3437, 2021. DOI: https://doi.org/10.1016/j.jece.2020.104909
Brasil. Resolução CONAMA nº 430, de 13 de maio de 2011. Publicada no Diário Oficial nº 92 em 16 de maio de 2011. Composição e classificação dos esgotos sanitários. Disponível em: https://conexaoagua.mpf.mp.br/arquivos/legislacao/resolucoes/resolucao-conama-430-2011.pdf. Acesso em: 24 de agosto de 2023.
CALISTO, J. S.; PACHECO, I. S.; FREITAS, LEONARDO L.; SANTANA, L. K.; FAGUNDES, W. S.; AMARAL, FÁBIO A.; CANOBRE, S. C. Adsorption kinetic and thermodynamic studies of the 2, 4 – dichlorophenoxyacetate (2,4-D) by the [Co–Al–Cl] layered double hydroxide, Heliyon, v. 5, Issue 12, e 02553, ISSN 2405-8440, 2019. DOI: https://doi.org/10.1016/j.heliyon.2019.e02553
CALISTO, Josiane de Souza. Adsorção dos herbicidas 2,4-diclorofenoxiacetato de sódio (2,4 – D) em Hidróxidos Duplos Lamelares [Co-Al-Cl]. 2020. 75f. Dissertação (Mestrado em Qualidade Ambiental) – Universidade Federal de Uberlândia, Uberlândia – MG. 2020.
CHOWDHURY, M. F.; Kim, C. M.; Jang, A. High-efficient and rapid removal of anionic and cationic dyes using a facile synthesized sole adsorbent NiAlFe-layered triple hydroxide (LTH), Chemosphere, v. 332, 138878, ISSN 0045-6535, 2023. DOI: https://doi.org/10.1016/j.chemosphere.2023.138878
CHUME, Vitorino Fernando. Uso de Hidrotalcitas convencionais e modificada com Norbixina na remoção dos corantes têxteis vermelho reativo 141 e azul reativo 160 de soluções aquosas. Dissertação (Mestrado) – Universidade Federal de Ouro Preto, Programa de Pós graduação em Engenharia Ambiental, Ouro Preto – MG. 2020.
FREITAS, Leonardo Luís de. Síntese de Hidróxidos Duplos Lamelares (HDLs) para adsorção de herbicida e obtenção de HDL a partir do material catódico de baterias exauridas para aplicação como eletrodo. Dissertação (Pós-Graduação em Química) – Universidades Federal de Uberlândia, Uberlândia – MG, 2017.
GEORGETTI, FERNANDO. Síntese de compostos tipo hidrotalcita Ni/Mg/Al e Co/Mg/Al como precursões na formação de óxidos mistos e suas aplicações na reforma a vapor do acetol. Dissertação (Pós-Graduação em Química) – Universidade de São Paulo, Instituto de Química de São Carlos, São Carlos – SP, 2018.
GUIMARÃES, Fredson Santos. Preparação de pigmentos híbridos a partir de corantes azo e compostos do tipo hidrotalcita. 122f. Dissertação (Pós-Graduação em Química) – Universidade Federal da Bahia, Salvador – BA, 2010.
HAMAD, H. A.; NAGEH, H.; EL-BERY, H. M.; KASRY, A.; CARRASCO-MARÍN, F.; OMAR M., ELHADY, A. M.; SOLIMAN, M.; EL-REMAILY, M. A. A. Unveiling the exceptional synergism-induced design of Co-Mg-Al layered triple hydroxides (LTHs) for boosting catalytic activity toward the green synthesis of indol-3-yl derivatives under mild conditions, Journal of Colloid and Interface Science, v. 599, pg. 227-244, ISSN 0021-9797, 2021. DOI: https://doi.org/10.1016/j.jcis.2021.04.083
HENRIQUE, DIOGO CARLOS. Produção de CaAl/HDL a partir de resíduo calcinado de concha de Mytella falcata para remoção dos corantes azul de metileno e alaranjado de metila. Tese (Doutorado) – Universidade Federal de Alagoas, Programa de Pós-graduação em materiais, Maceió – Al, 2022.
KANG, J.; CINTRON-COLON, F.; KIM, H.,;KIM, J.; VARGA, T.; DU, Y.; QAFOKU, O.; UM, W.; LEVITSKAIA T. G. Removal of iodine (I− and IO3−) from aqueous solutions using CoAl and NiAl layered double hydroxides, Chemical Engineering Journal, v. 430, Part 1, 132788, ISSN 1385-8947, 2022. DOI: https://doi.org/10.1016/j.cej.2021.132788
LEAL, Cláudia Sofia Mendes. Solubilidade de corantes azo. Dissertação (Mestrado) - Curso de Química Industrial, Universidade da Beira Interior, Covilhã – POR, 2011.
LEMES, Lorranny Oliveira. Estudo da remoção de azocorantes por hidróxidos duplos lamelares. Dissertação (Mestrado) – Universidade Estadual de Goiás, Programa de Pós Graduação em Ciencias Moleculares, Anápolis – GO, 2018.
MAHJOUBI, F. Z.; KHALIDI, A.; ABDENNOURI, M.; BARKA, N. Zn-Al layered double hydroxides intercalated with carbonate, nitrate, chloride and sulphate ions: Synthesis, characterization and dye removal properties. Journal for Science of Taibah University, v.1, n.1, p.90-100, ISSN 1658-3655, 2017. DOI: https://doi.org/10.1016/j.jtusci.2015.10.007
MIAO, J.; ZHAO, X.; ZHANG, YU-XIU.; LEI, ZHONG-LI.; LIU, ZHI-HONG. Preparation of hollow hierarchical porous CoMgAl-borate LDH ball-flower and its calcinated product with extraordinary adsorption capacity for Congo red and methyl orange, Applied Clay Science, v. 207, 106093, ISSN 0169-1317, 2021. DOI: https://doi.org/10.1016/j.clay.2021.106093
NASCIMENTO, R.S.; Corrêa, J.A.M.; Figueira, B.A.M.; Pinheiro, P.A.; Silva, J.H.; P.T.C. Freire; Quaranta, S. From mining waste to environmetal remediation: a nanoadsorbent from Amazon bauxite tailings for the removal of erythrosine B dye, Applied Clay Science, v. 222, 106482, ISSN 0169-1317, 2022. DOI: https://doi.org/10.1016/j.clay.2022.106482
NASCIMENTO, R. F. et al. Adsorção: aspectos teóricos e aplicações ambientais. Fortaleza: imprensa universitária, 2014.
NAZIR, M. A.; NAJAM, T.; JABEEN, S.; WATTOO, M. A.; BASHIR, M. S.; SHAH, S. S. A.; REHMAN, A. Facile synthesis of Tri-metallic layered double hydroxides (NiZnAl-LDHs): Adsorption of Rhodamine-B and methyl orange from water, Inorganic Chemistry Communications, v.145, 110008, ISSN 1387-7003, 2022. DOI: https://doi.org/10.1016/j.inoche.2022.110008
OBEID, L.; BÉE, A.; TALBOT, D.; JAAFAR, S. B.; DUPUIS, V.; ABRAMSON, S.; CABUIL, V.; WELSCHBILLIG, M. Chitosan/maghemite composite: A magsorbent for the adsorption of methyl orange. Journal of Colloid and Interface Science, v. 410, p.52-58, 2013. DOI: https://doi.org/10.1016/j.jcis.2013.07.057
PACHECO, I. S.; AMARAL, F. A.; CANOBRE, S. C.; Uso de argilas aniônicas para remoção do contaminante emergente diclofenaco:estudo cinético. Brazilian Journal of Development, v. 5, p. 3796-3802, 2019.
PECO HUESA, A. Eliminación de contaminantes emergentes del agua mediante adsorción sobre materiais de carbón activados. Graduação em Química. Facultad de Ciencias experimentales, Universidad de Jaén España, 2020.
PREVIDELLO, B. A. F.; CARVALHO, F. R.; TESSARO, A. L.; SOUZA, V. R.; HIOKA, N. O pKa de indicadores ácido-base e os efeitos de sistemas coloidais. Química Nova, v. 29, n. 3, p.600-606, 2006.
REGALBUTO, J. R.; ROBLES, J.; The engineering of Pt/Carbon Catalyst Preparation, Universityof Illinois: Chicago, 2004.
SHABANIAN, M.; HAJIBEYGI, M.; RAEISI, A. 2 - FTIR characterization of layered double hydroxides and modified layered double hydroxides, Editor(s): Sabu Thomas, Saju Daniel, In Woodhead Publishing Series in Composites Science and Engineering, Layered Double Hydroxide Polymer Nanocomposites, Woodhead Publishing, p. 77-101, ISBN 9780081022610, 2020. DOI: https://doi.org/10.1016/B978-0-08-101903-0.00002-7
SILVA, C. X. J. Estudo dos parâmetros cinéticos e termodinâmicos da adsorção do dihidrogenofosfato pelo HDL [Co-Al-Cl] em águas. Dissertação (Trabalho de co¬¬nclusão de curso em Química) – Universidade Federal de Uberlândia, Instituto de Química, Uberlândia – MG. 2019.
SILVA, L. P. A. Síntese e caracterização de novos polímeros conjugados derivados de tiofeno-pirrol-tiofeno (SNS) ligados aos corantes azo alaranjado de metila e vermelho de metila. Dissertação (Mestrado em Química) – Universidade Federal de Alagoas, Instituto de Química e Biotecnologia, Maceió – AL. 2020.
SILVA, Simone Eulália Gomes da. Remoção de fármacos via adsorção utilizando hidróxidos duplos lamelares: uma análise bibliométrica. Monografia (Trabalho de Conclusão de Curso em Engenharia Química) – Universidade Federal de Alagoas, Centro de Tecnologia, Maceió – AL. 2021.
ZIMMERMANN, A. Compósitos de polietileno de alta densidade contendo hidroxissais e hidróxidos duplos lamelares intercalados com ânions cloreto e corantes azo. Tese (Doutorado) – Universidade Federal do Paraná, Setor de tecnologia, Curitiba – PR. 2014.
















