ÁREA
Química Ambiental
Autores
Bauer, L.C. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Lima, T.S.M. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Silva, D.L. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Nascimento, I.S. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Santana, N.B. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Bonomo, R.C.F. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA)
RESUMO
Uma importante estratégia para utilização e valorização dos resíduos agroindustriais é a fermentação em estado sólido, processo onde podem ser produzidos diferentes compostos ativos. Dessa forma, o objetivo deste trabalho foi verificar a viabilidade da casca do café arábica como substrato para produção da enzima lacase utilizando Aspergillus Níger sp. Para isso, foi montado um planejamento unifatorial para avaliar como o tempo influencia o conteúdo de proteína e a atividade de lacase no extrato enzimático bruto produzido após 1 até 10 dias de fermentação. Os resultados demonstraram que a casca de café pode ser utilizada como substrato para a produção de lacase por A. Níger, tendo valores máximos para proteína em torno de 7 dias e para atividade de lacase com 8 dias de fermentação.
Palavras Chaves
FES; resíduo agroindustrial; fungo
Introdução
O Brasil é o segundo maior produtor e exportador de café, onde abarca uma produção anual de aproximadamente 54,74 milhões de sacas de grãos de café arábica Coffea arábica e conilon - Coffea canephora, ficando atrás somente dos Estados Unidos. Em 2023, a companhia nacional de abastecimento fez um levantamento de áreas totais destinadas ao plantio das duas espécies mais produzidas no país e foi visto que o total abrange um terreno de aproximadamente 1,87 milhão de hectares (CONAB, 2023). Deste montante gerado na produção, 90% do grão produzido é descascado pela técnica denominada – seca, onde, depois de limpos e lavados, os grãos serão separados das cascas, as quais não entram na máquina de moagem (GOUVEA et al., 2009). Sabe-se que, a casca compõe 50% da biomassa do grão seco, gerando anualmente um volume exacerbado de resíduos sólidos no país, gerando instabilidades para o meio ambiente (CONAB, 2023). Dentro deste contexto, a fermentação em estado sólido surge como uma auxiliadora no descarte eficiente das indústrias cafeeiras do país, onde essas cascas que seriam descartadas e consequentemente gerariam impactos ambientais, passam então, a ter um destino positivo, além de agregar com o desenvolvimento tecnológico do país (AITA et al., 2019). Entende-se então, por fermentação em estado sólido (FES): Processo pelo ocorre o crescimento microbiano sem água livre no meio, utilizando resíduos sólidos, possuem características de alta eficiência contra contaminações e possuem baixo custo de manutenção, além disso, é extremamente usada na biotecnologia, com o intuito da produção de bioprodutos, tais como: enzimas e proteínas, por meio de microrganismos, utilizando substratos que na maioria das vezes seriam descartados no meio ambiente, como: cascas de café, cacau e coco, dentre uma ampla faixa de outros resíduos que se tem disponível na natureza. Ressalta-se que, a escolha do resíduo que será utilizado deve estar ligada ao tipo de bioproduto de interesse e ao microrganismo que vai se utilizar neste processo (SANTOS et al., 2020). As enzimas são um tipo de proteínas amplamente produzidas por meio de fermentações, inclusive por FES, apresentam alta seletividade, são muito utilizadas como catalisadores em diferentes processos industriais, além de apresentar atividade em diferentes faixas de temperatura, pH e pressão (PRASAD & ROY, 2018). A pesquisa frente à utilização de enzimas está aumentando a um nível global, ao mesmo tempo, percebe-se a necessidade por processos facilitadores dessa produção e que sejam economicamente viáveis. Estima-se que em 2024 o mercado das enzimas chegue na casa dos US$ 10,5 bilhões, onde a maior parte é e será produzida por meio de microrganismos, tais como os fungos do gênero Aspergillus spp. (PAPADAKI et al., 2020). Percebe-se então o valor que esta tecnologia promissora tem, sendo a mesma aplicada em diferentes indústrias, como: ambiental, alimentos, farmacêuticas, químicas, além de atuarem em inúmeras atividades da biotecnologia. A lacase é uma enzima produzida em sua maioria por fungos e no meio extracelular (BUENO et al., 2009). As lacases fazem parte do grupo das enzimas oxidativas e atuam oxidando diferentes compostos fenólicos. Elas podem ser encontradas em plantas e insetos, e também, ser produzidas por bactérias e fungos (JANUSZ et al., 2020). Atualmente, a lacase é uma excelente aliada da indústria, na indústria de celulose é aplicada em diferentes etapas do processo, para deslignificação da polpa e branqueamento do papel; na área de alimentos, é utilizada na clarificação e estabilização de bebidas e na produção de emulsões; na indústria farmacêutica, no âmbito de síntese e modificação de compostos químicos; e na preservação ambiental, onde tem aplicação na biorremedição de diferentes efluentes e águas residuais, com destaque para indústria têxtil e de tintas. (FALADE et al., 2017; RODRÍGUEZ-COUTO et al., 2018; KUMAR & CHANDRA, 2020). Assim, o objetivo deste trabalho foi verificar a viabilidade da casca do café arábica para produção de lacase por meio da fermentação em estado sólido utilizando Aspergillus Níger sp. como microrganismo produtor.
Material e métodos
Microrganismo, Resíduo e Reagentes A cepa do fungo Aspergillus Niger Sp. (ATCC 1004) foi adquirida pela Vigilância Sanitária, Coleção de Microrganismos de Referência (FIOCRUZ, Rio de Janeiro, Brasil) e acondicionada em sílica a 5 ± 1°C até o momento do experimento. A casca de café do tipo Arábica foi doada por uma empresa local da cidade de Itapetinga, Bahia. Os demais materiais eram reagentes de grau analítico: PDA (ágar batata dextrose), álcool etílico, ácido fosfórico e tampão McIlvaine da Synth; Azul de Coomassie G250, ABTS (2,2 azino-bis ácido 3–etilbenzotiazolina-6- sulfônico), BSA (albumina sérica bovina) e Tween 80 da Sigma Aldrich. Preparação do Substrato A casca de café foi previamente seca em estufa a 60 ºC por 24 h. Depois de seca, a casca foi triturada em moinho de facas até granulometria de 2 mm e acondicionada até sua utilização. A composição centesimal da casca moída foi determinada, em triplicata, seguindo as Normas do Instituto Adolfo Lutz (IAL, 2008). Condições de Cultivo, Obtenção do Inóculo e FES Para a fermentação, o fungo foi ativado em meio sólido PDA por 7 dias a 30 ± 1°C e a suspensão de esporos foi obtida por extração em solução aquosa de Tween 80 a 0,01%, sendo sua concentração obtida em câmara de Neubauer e expressa em nºesporos/mLsolução. A FES foi realizada em batelada. Erlenmeyers de 125 mL contendo 5g de resíduo foram utilizados como biorreatores. Os recipientes foram previamente autoclavados e, após o resfriamento, o meio foi inoculado com 107 esporos/gcasca de café e hidratado com água estéril suficiente para atingir umidade de 70%. A incubação foi realizada em duplicata, em estufa com temperatura controlada a 30 ± 1ºC por um tempo determinado (1 a 10 dias). Obtenção do Extrato Enzimático Bruto (EEB) O EEB foi obtido segundo metodologia proposta por Gombert et al (1999). Após cada intervalo de 24h de fermentação, foram adicionados 20 mL de água destilada estéril ao fermentado e a suspensão permaneceu sob agitação por 20 min. Após a mistura, o EEB foi obtido por filtração seguida de centrifugação a 4 ± 1ºC e 6000 rpm por 15 min. O sobrenadante foi coletado e congelado para análises posteriores. Conteúdo de Proteína (PB) e atividade de lacase livre (ALL) no EEB O conteúdo de PB e a ALL de cada EEB foram determinados em duplicata. A quantidade de proteína foi obtida segundo o método proposto por Bradford (1976), utilizando BSA como padrão, sendo os resultados expressos em mgproteína/gcasca de café. A ALL foi determinada conforme descrito por Barbosa et al. (1996), utilizando-se como substrato o ABTS. Neste método, uma unidade de ALL é expressa como o nº de μmols de substrato oxidado por minuto por L de EEB (U/LEEB). Análise Estatística Os dados obtidos neste estudo foram expressos como média e desvio padrão e submetidos à ANOVA e teste de regressão por meio do software SAS. A adequação dos modelos foi avaliada pelo coeficiente de determinação (R²), nível de significância dos parâmetros do modelo (p<0,05)
Resultado e discussão
Caracterização do Substrato para FES
Os resíduos agroindustriais são uma importante fonte de compostos úteis. O
Brasil, por sua tradição agrícola e pecuária, é um grande produtor de resíduos,
que muitas vezes são subutilizados ou até mesmo descartados no meio ambiente. A
transformação sustentável desses resíduos pode agregar valor a esses materiais,
aumentando a produção de bioprodutos, como biomassa microbiana, metabólitos
e/ou enzimas para usos em diferentes áreas socioeconômicas e industriais
(CHILAKAMARRY et al., 2022).
A seleção de um suporte adequado para executar os processos de FES é essencial,
uma vez que o sucesso do processo depende disso, sendo que os fatores mais
importantes a se considerar são o tamanho de partícula e porosidade do material,
pois facilitam o acesso aos nutrientes e a difusão do oxigênio, e também, a
composição química do mesmo (MUSSATTO et al., 2012; CHILAKAMARRY et al., 2022).
Substratos naturais, ou não inertes, funcionam como local de fixação e também
como fonte de nutrientes (açúcares, fibras, proteínas, lipídios e minerais)
(RALPH, 1976) para o desenvolvimento microbiano e sua utilização implica uma
redução considerável nos custos de produção, uma vez que nem sempre necessitam
de adjuvantes para o processo, além de muitas vezes, representarem também um
ganho ecológico grande, pois são utilizados os resíduos agroindustriais
(MUSSATTO et al., 2012; CUADRADO-OSÓRIO et al., 2022).
A característica mais importante para que um resíduo seja utilizado como
substrato para a produção de lacase por FES é que ele seja rico em compostos
lignocelulósicos, especialmente a lignina, considerado um indutor ideal para que
os fungos, principais microrganismos usados na FES, metabolizem a enzima durante
seu crescimento (RODRÍGEZ-COUTO, 2018). Neste aspecto, a casca de café mostra-se
uma fonte promissora para produção de lacase, como pode ser observado em sua
composição centesimal apresentada na Tabela 1.
A casca de café apresentou alto teor de lignina (22,06% ± 0,47), comparável com
o de outros substratos já utilizados como suportes para produção de lacase por
FES, como por exemplo, farelo de cevada (21,4%), espiga de milho (20,3%) e palha
de aveia (18,0%) (RODRÍGEZ-COUTO, 2018; VELÁSQUEZ-QUINTERO et al., 2022), além
de também ser rico em polissacarídeos como a celulose e a hemicelulose, que
atuam como fonte de carbono para as atividades metabólicas dos microrganismos
(KRISHNA, 2008; VELÁSQUEZ-QUINTERO et al., 2022). González et al. (2013)
mostraram o potencial da casca de café como substrato para a produção de lacase,
a sua utilização como suporte em cultura semi-sólida de Trametes pubescense
permitiu obter uma quantidade importante de lacase,o que segundo os autores, foi
favorecida pelos compostos fenólicos, como os taninos, presentes na casca de
café, não necessitando de suplementação, o que foi considerado como uma vantagem
econômica para o processo.
FES, Conteúdo de Proteína e Atividade de Lacase Livre no EEB
A lacase têm sido estudada desde o século XIX, quando foi descoberta na laca da
árvore japonesa Toxicodendron vernicifluum de onde seu nome derivou (YOSHIDA,
1883). Atualmente, sabe-se que as enzimas da classe das lacases estão amplamente
distribuídas na natureza, em plantas, insetos, bactérias e fungos (BALDRIAN,
2006).
Comercialmente, as lacases fúngicas são as mais interessantes, uma vez que são
predominantemente enzimas extracelulares, o que facilita a sua ação e atividade,
além de possibilitar uma recuperação e separação mais fácil para seu amplo campo
de aplicação biotecnológica (RANGELOV & NICELL, 2015).
Entre os fungos, as lacases são particularmente abundantes nos fungos da
podridão branca, que são os únicos organismos conhecidos capazes de decompor
todos os componentes lignocelulósicos e por isso, são os microrganismos mais
estudados para este propósito (ARORA & SHARMA, 2010; RODRÍGUEZ-COUTO et al.,
2018; DONG et al., 2023). Entretanto, outras espécies de fungos têm sido
avaliadas quanto a sua capacidade de produção de lacase, como Aspergillus sp.,
Aspergillus oryzae (DONG et al., 2023).
A FES realizada por A. níger utilizando resíduo de casca de café e água como
meio de cultura resultou na produção de EEB com diferentes conteúdos de proteína
e atividade de lacase livre, variando de acordo com o tempo de fermentação, como
pode ser observado nos resultados resumidos nas Figuras 1, A e B.
Apesar de ter se observado a produção de proteínas e ALL para todos os tempos de
FES estudados, a maior quantidade de PB e maior atividade foram alcançadas nos
tempos 6,6 e 8,1 dias de fermentação, respectivamente. Essas variações podem ser
explicadas pela dinâmica de metabolismo dos fungos, onde inicialmente há o
consumo dos nutrientes disponíveis no resíduo, seguida de uma fase onde há
necessidade da excreção de enzimas e outros metabólitos para hidrólise de
componentes mais complexos (celulose, hemicelulose e lignina), e por isso, um
aumento dos valores observados.
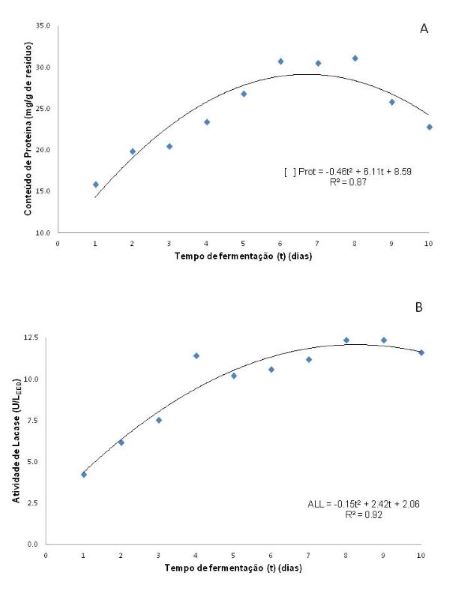
Conteúdo de proteína bruta (A) e atividade de lacase \r\nlivre (B) nos EEB ao longo do tempo de fermentação \r\n(1 a 10 dias).
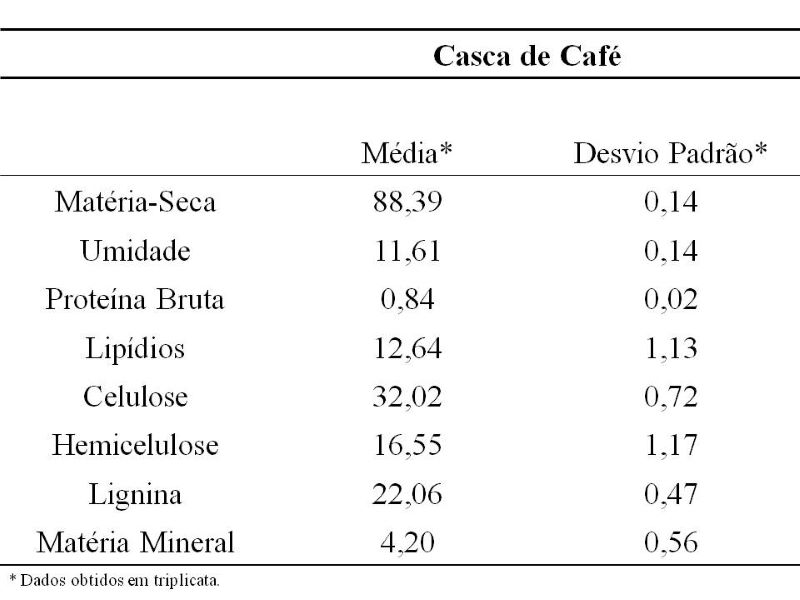
Tabela 1. Composição química (%) da casca de café do \r\ntipo Arábica usada como substrato de suporte para a \r\nprodução de lacase por A. Níger Sp. via FES.
Conclusões
A partir do estudo realizado foi possível obter lacase de Aspergillus Níger ATCC 1004 por fermentação em estado sólido utilizando a casca do café como resíduo e única fonte de nutrientes e energia, o que demonstra a alta viabilidade para utilização deste resíduo para a produção da enzima.
Agradecimentos
Os autores gostariam de agradecer à Universidade Estadual do Sudoeste da Bahia e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior pela concessão de bolsas que permitem a dedicação exclusiva para a pesquisa.
Referências
AITA, B. C.; SPANNEMBERG, S. S.; SCHMALTZ, S.; ZABOT, G. L.; TRES, M. V.; KUHN, R. C.; MAZUTTI, M. A. Production of cell-wall degrading enzymes by solid-state fermentation using agroindustrial residues as substrates. Journal of Environmental Chemical Engineering, 7, 103193, 2019.
ARORA, D. S.; SHARMA, R. K. Ligninolytic fungal laccases and their biotechnological applications. Applied Biochemistry and Biotechnology, 160, 2010.
BALDRIAN, P. Fungal laccases: occurrence and properties. FEMS Microbiology Reviews., 30, 215–242, 2006.
BARBOSA, A. M.; DEKKER, R. F. H.; HARDY, G. E. Veratryl alcohol as an inducer of laccase by an ascomycete, Botryosphaeria sp., when screened on the polymeric dye Poly R-478. Letters in Applied Microbiology, 23, 93–96, 1996.
BRADFORD, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Analytical Biochemistry, 72, 1976.
BUENO, C. J.; FISCHER, I. H.; ROSA, D. D.; FURTADO, E. L. Produção de enzimas extracelulares por Fusarium solani de maracujazeiro amarelo. Tropical Plant Pathology, 34, 2009.
CONAB - Companhia Nacional de Abastecimento. Levantamento CONAB da safra de café. 2023. Disponível em: https://www.conab.gov.br/info-agro/safras/cafe/boletim-da-safra-de-cafe
CHILAKAMARRY, C. R.; SAKINAH, A. M. M.; ZULARISAM, A. W.; SIROHI, R.; KHILJI, I. A.; AHMAD, N.; PANDEY, A. Advances in solid-state fermentation for bioconversion of agricultural wastes to value-added products: Opportunities and challenges. Bioresource Technology, 343, 2022.
CUADRADO-OSORIO, P. D.; RAMÍREZ-MEJÍA, J. M.; MEJÍA-AVELLANEDA, L. F.; MESA, L.; BAUTISTA, E. J. Agro-industrial residues for microbial bioproducts: A key booster for bioeconomy. Bioresource Technology Reports, 20, 2022.
DONG, C. D.; TIWARI, A.; ANISHA, G. S.; CHEN, C. W.; SINGH, A.; HALDAR, D.; PATEL, A. K.; SINGHANIA, R. R. Laccase: A potential biocatalyst for pollutant degradation. Environmental Pollution, 319, 2023.
FALADE, A. O.; NWODO, U. U.; IWERIEBOR, B. C.; GREEN, E.; MABINYA, L. V.; OKOH, A. I. Lignin peroxidase functionalities and prospective applications. MicrobiologyOpen, 6, 2017.
GOUVEA, B. M.; TORRES, C.; FRANCA, A. S.; OLIVEIRA, L. S.; OLIVEIRA, E. S. Feasibility of ethanol production from coffee husks. Biotechnology Letters, 31, 2009.
GOMBERT, A. K.; PINTO, A. L.; CASTILHO, L. R.; FREIRE, D. M. G. Lipase production by Penicillium restrictum in solid-state fermentation using babassu oil cake as substrate. Process Biochemistry, 1999. doi:10.1016/S0032-9592(99)00036-9.
GONZALEZ, J. C.; MEDINA, S. C.; RODRIGUEZ, A.; OSMA, J. F.; ALMÉCIGA-DÍAZ, C. J.; SÁNCHEZ, O. S. Production of Trametes pubescens Laccase under Submerged and Semi-Solid Culture Conditions on Agro-Industrial Wastes, PLoS ONE, 8, 2013.
IAL, Instituto Adolfo Lutz. Métodos físico-químicos para análise de alimentos. Coord.: Zenebon, O.; Pascuet, N. S.; Tiglea, P. São Paulo: Instituto Adolfo Lutz, 2008, 1020p.
JANUSZ, G.; PAWLIK, A.; ŚWIDERSKA-BUREK, U.; POLAK, J.; SULEJ, J.; JAROSZ-WILKOŁAZKA, A.; PASZCZYŃSKI, A. Laccase Properties, Physiological Functions, and Evolution. International Journal of Molecular Sciences, 21, 2020.
KUMAR, A.; CHANDRA, R. Ligninolytic enzymes and its mechanisms for degradation of lignocellulosic waste in environment. Heliyon, 6, 2020.
KRISHNA, C. Solid-State Fermentation Systems—An Overview. Critical Reviews in Biotechnology, 25, 1-30, 2005.
MUSSATTO, S. I.; BALLESTEROS, L. F.; MARTINS, S.; TEIXEIRA, J. A. Use of agro-industrial wastes in solid-state fermentation processes, in: K.-Y. Show, G. Xinxin (Eds.), Industrial Waste, InTech, Croatia, 2012.
PAPADAKI, E.; KONTOGIANNOPOULOS, K. N.; ASSIMOPOULOU, A. N.; MANTZOURIDOU, F. T. Feasibility of multi-hydrolytic enzymes production from optimized grape pomace residues and wheat bran mixture using Aspergillus niger in an integrated citric acid-enzymes production process. Bioresource Technology, 309, 2020.
PRASAD, S. & ROY, I. Converting enzymes into tools of industrial importance. Recent Patents in Biotechnology, 12, 2018.
RALPH, B. J. Solid substrate fermentations. Food Technology Australia, 28, 1976.
RANGELOV, S.; NICELL, J. A. A model of the transient kinetics of laccase-catalyzed oxidation of phenol at micromolar concentrations. Biochemical Engineering Journal, 99, 2015.
RODRÍGUEZ-COUTO, S. Solid-State Fermentation for Laccases Production and Their Applications. In: Pandey, A.; Larroche, C.; Soccol, C. R. Current Developments in Biotechnology and Bioengineering, Elsevier, 2018.
SANTOS, A. F. A.; ANDRADE, V. D.; CARDOSO, B. A.; SILVA, O. S.; OLIVEIRA, R. L.; PORTO, A. L. F.; PORTO, T. S.; PORTO, C. S. Bioprospecção de enzimas produzidas por Aspergillus tamarii URM 4634, isolado do solo da Caatinga, por fermentação em estado sólido / Bioprospecting of enzymes produced by Aspergillus tamarii URM 4634, isolated from Caatinga soil, by solid state fermentation. Brazilian Journal of Development, 6, 2020.
VELÁSQUEZ-QUINTERO, C.; MERINO-RESTREPO, A.; HORMAZA-ANAGUANO, A. Production, extraction, and quantification of laccase obtained from an optimized solid-state fermentation of corncob with white-rot fungi, Journal of Cleaner Production, 370, 2022.
YOSHIDA, H. Chemistry of lacquer (Urushi). Part 1. Journal of Chemical Society, 43, 1883.
















