ÁREA
Química Ambiental
Autores
Silva, M.R.L. (UFRN) ; Câmara, A.B.F. (UFRN) ; Moura, H.O.M.A. (UFRN) ; Pereira, A.V.S. (UFRN) ; Sousa, P.C. (UFRN) ; Sousa, J.N. (UFRN) ; Bertolino, L.C. (CETEM) ; Rodríguez-castellón, E. (UNIVERSIDAD DE MÁLAGA) ; de Carvalho, L.S. (UFRN)
RESUMO
O argilomineral haloisita pode ser aplicado em diversas áreas da indústria devido a sua morfologia tubular. Uma dessas aplicações é a adsorção de fármacos em efluentes aquosos. Neste trabalho, foram realizadas caracterizações dos adsorventes a partir da aplicação de técnicas como FRX, DRX, XPS, MEV, HRTEM e a adsorção/dessorção de N2. O planejamento experimental foi realizado para avaliar a atividade da haloisita na adsorção da tetraciclina, prevendo assim uma otimização do processo de adsorção. Obtendo a capacidade máxima de adsorção calculada a partir da isoterma de equilíbrio de Langmuir de 9,63mg.g-1, com porcentagem de remoção de 98%. A HAL apresentou elevada eficiência como material adsorvente para a remoção da tetraciclina, destacando-se por ser um material natural e de baixo custo.
Palavras Chaves
Planejamento Experimental; Haloisita; Adsorção
Introdução
A inserção dos resíduos farmacêuticos à classe dos Contaminantes de Preocupação Emergentes (CPEs), devido ao aumento da concentração dessas substâncias nos efluentes aquáticos (Farto et al., 2021), tem impulsionado o estudo de novos materiais adsorventes que apresentem uma remoção mais eficiente desses compostos, causando um menor impacto ambiental. A maioria dos antibióticos consumidos não são completamente metabolizados no organismo animal, sendo eliminados nas fezes e na urina (Regitano, 2010). O antibiótico tetraciclina é um composto de difícil degradação devido a sua característica recalcitrante e é facilmente encontrado em ambientes aquáticos podendo ser solubilizadas em meios ácidos, básicos, na presença de solventes orgânicos apolares e álcoois (Maia et al., 2009). A adsorção é um processo simples e amplamente utilizado graças ao seu baixo custo, eficiência e facilidade de implementação. O emprego de adsorventes naturais, como os argilominerais, vêm apresentando resultados satisfatórios nos últimos anos (Luo et al., 2011). A haloisita é um argilomineral aluminossilicato, com fórmula estrutural Al2(OH)4Si2O5.nH2O, pertencente ao grupo do caulim, com a estrutura dioctaédrica 1:1. Os estudos de suas aplicações são inseridos em vários campos de pesquisas podendo ser em utilizadas de forma natural e/ou modificadas (Janacek et al., 2018). Geralmente as morfologias dos microcristais de haloisita ocorre na forma de nanotubos ocos, em diferentes faixas de comprimentos (Santos et al., 2009). Estudos comprovam uma melhor remoção de contaminantes usando processos adsortivos com a haloisita modificada, por tratamento com ácido, pois há aumento da área de contato devido a lixiviação de alguns metais presentes na superfície do material (Zhang et al.,2021, Sadjadi et al., 2019). Dessa forma, este trabalho tem como objetivo a avaliação dos modelos matemáticos de equilíbrio e cinética para investigar a remoção do fármaco tetraciclina através de um processo de adsorção com um adsorvente de baixo custo, o argilomineral haloisita. Além disso, o material na sua forma natural e modificada com ácido, foi caracterizado por fluorescência de raios X (FRX), difração de raios X (DRX), microscopia eletrônica de varredura (MEV), microscopia eletrônica de transmissão (TEM), espectroscopia de fotoelétrons excitados por raios X (XPS) e o adsorção/dessorção de N2.
Material e métodos
Obtenção e preparo da haloisita – O argilomineral, utilizado neste trabalho, foi fornecido pelo Centro de Tecnologia Mineral (CETEM/RJ). Despois da extração, as amostras foram secas em estufa durante 24 horas a 60 ºC e submetidas a um processo de britagem. As amostras foram divididas e moídas em 106 µm através do moinho vibratório de anéis a 700 RPM por 30 segundo. Por fim, para resultar em partículas menores que 10 µm, foi utilizado o moinho McCrone por 10 minutos com água destilada. A HAL foi submetido à classificação granulométrica úmida utilizando peneiras 44 µm a 60 ºC 24 horas e destorroadas antes de serem submetidas à classificação por suspensão em 2 µm pera separação da fração argila. Tratamento Ácido - O argilomineral tratado com ácido (HAL-A) foi obtido a partir da mistura da haloisita natural (HAL-N) com uma solução de ácido clorídrico 2,5 mol.L-1, proporção 1:15, sob agitação durante 4 h à 70°C. A fim de, separar os íons Cl- da solução e obter um pH neutro da halosita, foi realizada a filtração e lavagem da mistura com água destilada. O material sólido foi seco na estufa durante 12 h à temperatura de 80°C. Caracterização da haloisita - O material foi caracterizado pelas análises de difração de raios X (DRX) (Bruker - D2Phaser; CuKα, λ=1,54Å) e fluorescência de raios X (FRX) (Bruker S2 Ranger). A microscopia eletrônica de varredura (MEV) foi obtida através do equipamento Carl Zeiss modelo Auriga com um detector do tipo Xflash 410M (Bruker). O método de adsorção/dessorção de N2 a 77K foi realizado pelo o equipamento Micromeritics, ASAP 2420. Os resultados da espectroscopia de fotoelétrons excitados por raios X (XPS), foram obtidos utilizando um espectrômetro Physical Electronics PHI5700 (Minneapolis, EUA) com radiação não monocromática Al-Kα (95,2W, 15 kV, 1486 eV) e um detector multicanal. Planejamento Experimental - O planejamento experimental do tipo D-optimal foi realizado a partir da utilização do software DesignExpert, para analisar estatisticamente a relação entre o adsorvente e o adsorvato com variações no tempo de análise, concentração do ácido empregado para tratamento e massa do adsorvente. Adsorção do fármaco - Os experimentos de adsorção da tetraciclina foram realizados em temperatura ambiente, utilizando 25 mL das soluções do antibiótico tetraciclina, com concentrações entre 40 a 500 mg/L e 0,3 g do material adsorvente. Para o estudo cinético, o tempo estudado foi de 1 min até 25 h, sob agitação à 150 rpm. A fim de separar o material adsorvido da mistura, foi utilizada a centrifugação durante 10 min à 3000 rpm. A absorbância da solução remanescente foi medida em espectrofotômetro UV-Vis (Shimadzu 1800) no comprimento de onda de 276 nm para obtenção da concentração final do fármaco. Dados de equilíbrio e cinética de adsorção da tetraciclina foram obtidos a partir da utilização de modelos matemáticos. Os ajustes dos modelos foram realizados com as ferramentas de Excel e Origin 2019b.
Resultado e discussão
Os difratogramas de raios X apresentaram os picos característicos da HAL em 2θ =
21,4° e 27,8°, como pode ser comprovado com a carta cristalográfica 0018093,
comprovando a presença desse argilomineral na amostra. Os principais picos podem
ser observados mesmo após o tratamento ácido, embora com menor intensidade. Na
Figura 1(a) estão apresentados os resultados das isotermas de adsorção/dessorção
de N2 da HAL-N e HAL-A. Conforme a União Internacional de Química Pura e
Aplicada (IUPAC), as isotermas podem ser consideradas como do tipo IV com
histerese H3 que são típicas de sólidos mesoporosos, com a presença de
microporos (Kanani-Jazi et al., 2021).
A análise de FRX permitiu quantificar a composição dos óxidos presentes na
haloisita natural, sendo este material composto principalmente de 57,15% dos
óxidos de silício (SiO2), 28,79% de alumínio (Al2O3), 7,21% de potássio (K2O) e
2,8% de sódio (Na2O).
A análise XPS. Figura (b), é realizada para identificar os componentes
superficiais do argilomineral, este resultado confirma que a haloisita é
composta por Al, Si e O que são elementos básicos deste argilomineral.
As microscopias obtidas por MEV, Figura 1(c), em diferentes ampliações mostram
um grande percentual maciço recoberto com uma estrutura semelhante a agulhas
aglomeradas, que são consequência do possível agrupamento de nanotubos de
haloisita.
A micrografia obtida por TEM, contida na Figura 1(d), apresentam os nanotubos do
material com tamanhos e formas diferentes, e variações de tamanhos entre 60 e
600 nm de comprimento.
O planejamento experimental do tipo D-optimal, foi realizado a partir de
variações na massa do adsorvente, no tempo de análise e na concentração do ácido
empregado para tratamento. A partir da análise dos resultados obtidos, as
melhores condições para a adsorção do fármaco tetraciclina foram obtidas a
partir do uso da HAL tratada com ácido 1 mol.L-1, e a maior massa estudada e
tempo de 40 min, conforme apresentado na superfície de resposta da Figura 2 (F =
528,71, p < 0,0001). Com isso o processo de adsorção para os estudos de cinética
e isoterma foi otimizado com o tempo de 1 h, com massa do adsorvente de 0,5 g e
tratamento com HCl 1 mol.L-1.
Durante o estudo cinético, o modelo que melhor se ajustou aos dados
experimentais foi o de pseudo-segunda ordem, determinado com o coeficiente
próximo a 1 (R2 = 0,999). Além disso, esse modelo apresentou uma pequena
diferença ao se comparar os qe experimental (12,30 mg.g-1) e calculados (12,24
mg.g-1), sugerindo uma etapa de quimissorção como etapa determinante na taxa de
adsorção do fármaco tetraciclina (Câmara et al., 2019). O estudo de adsorção com
a HAL-A (qe = 12,24 mg.g-1) apresentou um aumento na quantidade adsorvida do
fármaco quando comparado ao obtido para a HAL-N (qe =3,84 mg.g-1), com o aumento
percentual de remoção do fármaco de 92% no período de 24h, para 97% em 1h,
respectivamente.
Os cálculos das isotermas de equilíbrio, apresentaram melhor ajuste ao modelo de
Langmuir (R2 = 0,9909), o que confirma o mecanismo de quimissorção, apresentando
um mecanismo de adsorção em monocamada na superfície do adsorvente com um número
finito de sítios. A capacidade de adsorção da monocamada de Langmuir (Qm)
aumentou de 2,12 para 9,63 mg.g-1 para a remoção de tetraciclina com a
utilização da HAL-A, mesmo utilizando um tempo muito inferior ao trabalhado na
adsorção com a HAL-N. Os resultados para o modelo de Freundlich indicam um
processo de adsorção favorável em sistemas heterogêneos ou adsorção multicamadas
e apresentam ajuste para HAL-A, com R2 > 0,9420, comprovado pelos valores de 1<
n < 10 (n =3,33).
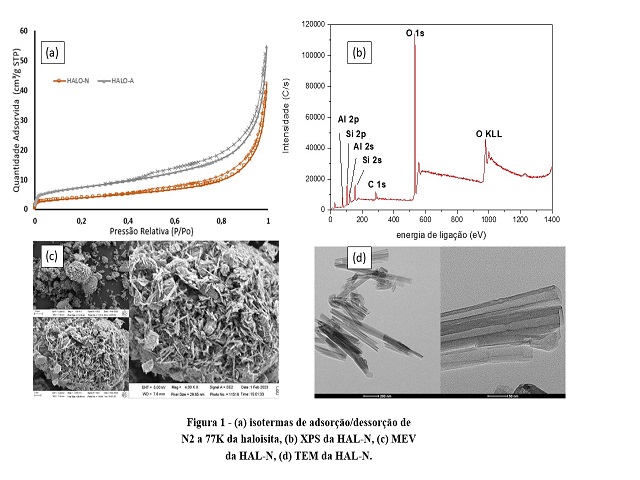
(a)Isotermas de adsorção e dessorção de N2 a 77k da \r\nhaloisita,(b) XPS da HAL-N, (c) MEV da HAL-N e (d) \r\nTEM da HAL-N.
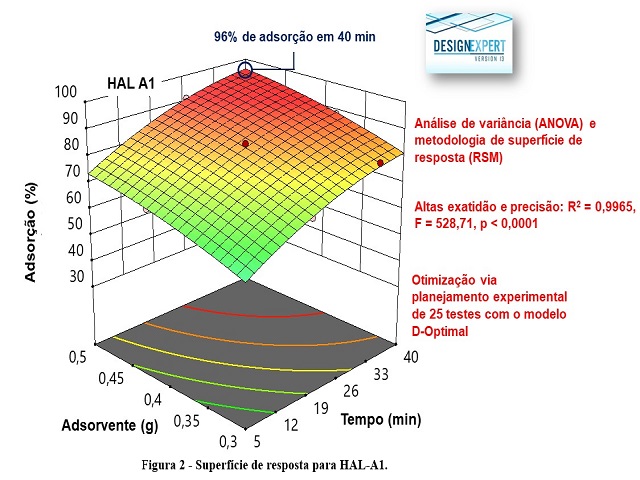
Superfície de resposta da HAL-A1.
Conclusões
Foi possível comprovar a utilização da haloisita como material adsorvente para remover o antibiótico tetraciclina em meio aquoso. As análises de caracterização das amostras mostraram que a composição e estrutura desse material são favoráveis ao processo de adsorção de fármacos. Os resultados de adsorção se mostraram promissores, com a diminuição do tempo do processo de 24 h para 1 h, e aumento da capacidade de adsorção de 92% para 98%, respectivamente. HAL se destaca como um material ambientalmente amigável e abundante na natureza.
Agradecimentos
Os autores deste trabalho agradecem o suporte do LABTEN/UFRN, do PPGQ/UFRN, do IQ/UFRN e da Universidad de Málaga. Este estudo foi parcialmente financiado pela CAPES – Código de Financiamento 001.
Referências
FARTO, C. D., JÚNIOR, G. B. A., SENA, R. F., ROSENHAIM, R. Gestão de Água da América Latina, 18, 1, 2021.
REGITANO, J. B., LEAL, R. M. P. Bras. Ciênc. Solo 34, 3, 2010.
MAIA, P. P., RATH, S., REYES, F. G. R. Segurança Alimentar e Nutricional, 16, 49, 2009.
LUO, P., ZHANG, J., ZHANG, B., WANG, J., ZHAO, Y., LIU, J. Chemical Engineering, 50, 10246, 2011.
JANACEK, D., KVITEK, L., KARLIKOVA, M., POSPISKOVA, K., SAFARIK, I. Applied Clay Science, 162,10, 2018.
SANTOS, P. S., TOLEDO, S. P., SANTOS, H. S. Cerâmica Industrial, 14, 1, 2009.
ZHANG, W., WANG, L., SU, Y., LIU, Z., DU, C. Applied Surface Science, 566, 150708, 2021.
SADJADI, S., M. MALMIR, M. M. HERAVI. Applied Clay Science, 168, 184, 2019.
KANANI-JAZI, M. H., AKBARI, S. Chemical Engineering 9, 3, 105214, 2021.
CÂMARA, A. B. F., SALES, R. V., JÚNIOR, C. V. S., SOUZA, M. A. F., LONGE, C., CHIANCA, T. M., POSSA, R. D., BERTOLINO, L. C., CARVALHO, L. S. Adsorption, 26, 2019.
















