ÁREA
Química Ambiental
Autores
Marinho, K.L.L. (UFOPA) ; Couto, N.A.F. (IFPA) ; Araújo, C.F. (UFPA) ; Santos, P.H.C. (UFPA) ; Barreto, I.A.R. (UFPA) ; Figueira, B.A.M. (UFPA/CANAN)
RESUMO
Peneiras moleculares compreendem um grupo de materiais com estruturas em túnel com diversidade em abertura destes tuneis, sendo que suas propriedades físico-química são dependentes da sua composição química e estrutura. Neste trabalho, apresenta- se um estudo de síntese hidrotermal de peneira molecular de oxido de Mn com estrutura OMS-2. A caracterização foi feita por difração de raios-X e análise termal (TG/DTA). Os resultados mostraram que rejeitos constituídos por todorokita, birnessita, criptomelana foram transformados com sucesso em OMS-2 após os processos químicos abordados neste trabalho. O material obtido mostrou elevada estabilidade térmica, mostrando assim, que um resíduo industrial pode ser convertido em um interessante material de valor agregado.
Palavras Chaves
Síntese; Peneira molecular; K-OMS-2
Introdução
Peneira molecular com estrutura OMS-2 trata-se de um óxido de manganês com estrutura em túnel sendo vastamente encontrada na natureza na forma do mineral hollandita. Sua estrutura consiste em duplas sequências de octaedros MnO[6] ligados na aresta/vértices, interligados com duplos octaedros MnO[6] em sequência, formando assim túneis 2x2 paralelos ao eixo b. Na preparação de compostos análogos à estrutura hollandita, a literatura descreve uma diversidade de métodos, como por exemplo: a) o método refluxo (Chen et al., 2002); b) método do estado sólido com alta temperatura-alta pressão (Kesson, 1983); c) e o método sol-gel (Hong et al., 2003). Há possibilidades da inserção de outros cátions metálicos nos túneis por troca iônica (Kijima et al., 2005) ou por inserção na estrutura durante a síntese (Deguzman et al., 1994). Com base nas suas propriedades de troca iônica, adsorção e catálise, hollandita pode ser um interessante sequestrador de metais, tais como: K[+], Rb[+], Ba[2+] e Pb[2+] (Feng et al., 1995), Mn[2+], Co[2+], Cu[2+], Hg[2+], Cd[2+], Zn[2+], Ni[2+] (Tsuji e Tanaka, 2001), além da degradação de fenol, oxidação de tolueno, acetato de etila e etanol, formaldeído, e outros compostos orgânicos voláteis (Zhang e Suib, 1999). Neste trabalho, investigou-se a possibilidade de transformação de rejeitos de Mn da Amazônia em produto de valor agregado com estrutura OMS-2.
Material e métodos
Para a obtenção de OMS-2, utilizou-se o método de lixiviação ácida acompanhada de tratamento hidrotermal. Incialmente, os rejeitos de Mn foram aquecidos em elevada temperatura e depois lixiviados com solução de ácido sulfúrico com variação de 4 a 8 mol/L, a 90°C/24 h. O material sólido resultante foi exaustivamente lavado, secado e caracterizado. Para a caracterização por DRX, usou-se um difratômetro de bancada D2Phaser (Bruker), com goniômetro de varredura vertical e um tubo de cobre (CuKa = 1.5406 Å) de 400 W de potência, com uma geometria de Bragg Brentano no modo contínuo, velocidade de varredura de 0,25° /min, tendo como sistema de detecção um detector rápido modelo LynxEye. A tensão foi de 30 kV e 10mA, respectivamente. As curvas TG-DTA de OMS-2 foram obtidas em termoanalisador da NETZSCH STA 449 F3 Jupiter, com razão de aquecimento de 10°C/min, na faixa de temperatura de 25 a 1000°C.
Resultado e discussão
O padrão DRX dos rejeitos e produtos sintéticos é mostrado na Fig. 1. Na Fig.
1a, o difratograma dos rejeitos indica a presença de minerais de Mn com
estrutura em camada, como litioforita e birnessita, assim como estruturas em
túnel como todorokita, nsutita, criptomelana e pirolusita. Adicionalmente,
outras fases além de óxidos de Mn foram identificadas: caulinita, hematita,
anatásio e gibbsita. Para os estudos de lixiviação ácida (Fig. 1b), os
resultados indicaram que o produto obtido entre os rejeitos aquecido e
lixiviados com 4 e 6 mol/L de H[2]SO[4] apresentou picos característicos de
OMS-2 a 12,56; 18; 28; 37,74; 41 e 50° 2 theta, que são referentes à estrutura
em túnel com sistema tetragonal (PDF 006-0547). A presença dos picos 16, 26, 33
e 35° 2 theta revela que há presença de impurezas nestas concentrações. Porém,
conforme pode ser verificado, em concentrações maiores (6 e 8 mol/L) de solução
ácida, observa-se a presença única dos picos de OMS-2 indicando que todo o
material de partida foi convertido na estrutura em túnel. A baixa definição e
alargamento dos picos sugere que a estrutura OMS-2 está desordenada. O
comportamento termal de OMS-2 também foi investigado e apresentado na Fig. 2.
Três eventos termais foram identificados e uma perda total de massa de 15 %. O
primeiro evento com um pico endotérmico a 632°C foi identificado e pode ser
assinalado, refere-se à perda de oxigênio do retículo e redução parcial de Mn
(IV) para Mn (III). O segundo pico endotérmico próximo a 930°C com perda de
massa de 2,5 % se refere à decomposição de OMS-2 e conversão em Mn2O3. Enquanto
a última perda de massa (~3 %) acompanhada de pico endotérmico a 993°C se refere
à decomposição termal de Mn[3]O[4] (YANG et al. 2004, SCHURZ et al., 2009).
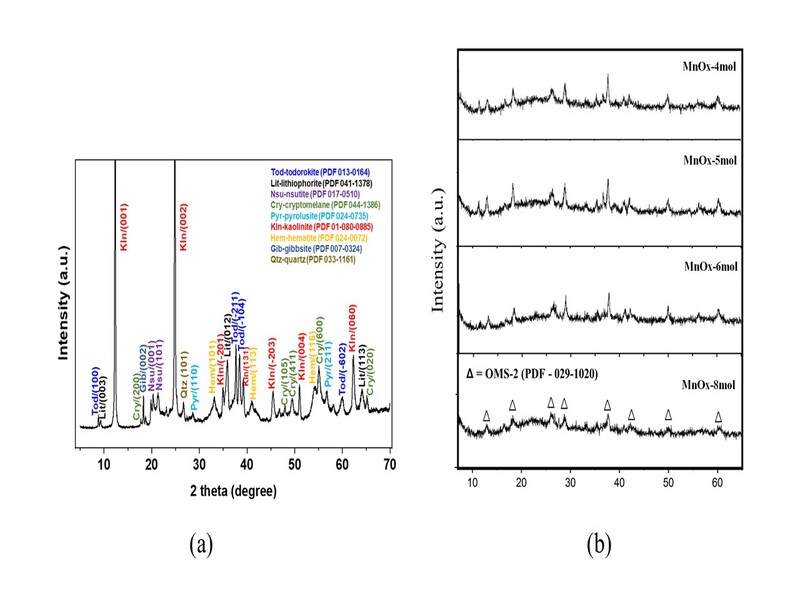
Padrão DRX dos rejeitos (a) e produtos lixiviados \r\ncom H2SO4 (b)
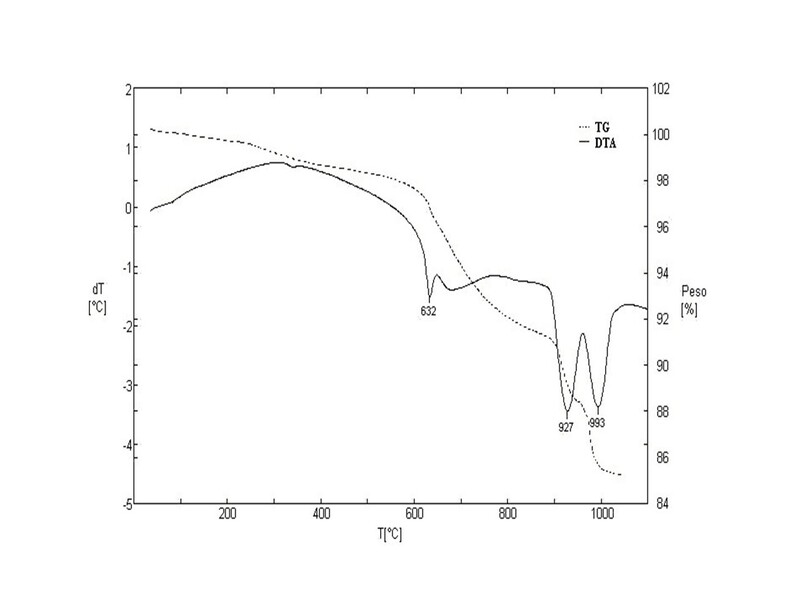
Curvas TG-DTA de OMS-2 obtida dos rejeitos de Mn
Conclusões
Rejeitos de óxidos de Mn da Amazônia foram convertidos com sucesso em peneira molecular com estrutura OMS-2 sob lixiviação acida acompanhada de tratamento hidrotermal. O material obtido se mostrou com cristalinidade e elevada estabilidade térmica, mostrando assim que um subproduto industrial pode ser material de partida de baixo custo para produção de produto de valor agregado.
Agradecimentos
Os autores agradecem o suporte técnico do Centro de Tecnologias Estratégicas do Nordeste, LAMIGA (UFPA), Companhia Vale e CNPQ.
Referências
CHEN, X. et al. Characterization of Manganese Oxide Octahedral Molecular Sieve (M-OMS-2) Materials. Chem.Mater., v.14, p. 940-948, 2002.
KESSON, S. E. The immobilization of cesium in synroc hollandite, Radioact. Waste Manage. Nucl. Fuel Cycle, v. 4, p.53 - 72, 1983.
HONG, X. et al. Sol–gel synthesis and characterization of mesoporous manganese oxide, Mater. Res. Bull., v. 38, p. 1695-1703, 2003.
KIJIMA, N.; TAKASHI, Y.; AKIMOTO, J.; AWAKA, J.; Lithium ion insertion and extraction reactions with hollandite-type manganese dioxide free from any stabilizing cations in its tunnel cavity. Journal of solid state chemistry, v. 178, p. 2741–2750, 2005.
DEGUZMAN, R. N.; SHEN, Y-F.; NET, E. J.; SUIB, S. L.; O’YOUNG, C. L.; Synthesis and characterization of octahedral molecular sieves (OMS – 2) having the hollandite structure. Chem. Mat., v.6, p.815 - 821, 1994.
FENG, Q.; KANOH, H.; MIYAI, Y.; OOI, K.; Alkali metals ions insertion/extractions reactions with hollandite-type manganese oxide in the aqueous phase, Chem. Mat., v. 7, p. 148-153, 1995.
TSUJI, M.; TANAKA, Y.; Spectroscopy study of a cryptomelane-type manganic acid exchanged by divalente transitions-metal cations, Chem. Mat. Res., v. 16., p. 108-114, 2001.
ZHANG, Q.; SUIB, S. L.; Transformation of Cryptomelane-Type Manganese Oxides to Oxygen Deficient Systems by Microwave-Induced Oxygen Evolution, Chem. Mat.; v. 11, p. 1306-1311, 1999.
YANG, X.; MAKITA, Y.; LIU, Z-H.; SAKANE, K.; OOI, K.; Structural Characterization of Self-Assembled MnO2Nanosheets from Birnessite Manganese Oxide Single Crystals, Chem. Mat., v. 16, p. 5581-5588, 2004.
SCHURZ, F.; BAUCHERT, J.; MERKER, T.; GLÄSER, R.; Octahedral molecular sieves of the type k-oms-2 with different particle sizes and morphologies: impact on the catalytic properties in the aerobic partial oxidation of benzyl alcohol, Applied Catalysis A: General, v. 355, p. 42–49, 2009.
















