ÁREA
Química Ambiental
Autores
Viana, L.G.M. (UFPA) ; Santos, J.C.P. (UFPA) ; Costa, J.S.B. (IFPA) ; Brito, C.E.C. (UFPA) ; Hildebrando, E.A. (UFPA)
RESUMO
O objetivo foi avaliar a capacidade adsortiva do corante azul de metileno (AM) por micas sintéticas produzidas a partir do rejeito de caulim amazônico. Os materiais adsorventes foram produzidos por síntese hidrotermal, variando o tempo e temperatura. Para caracterização foi realizada a difração de raios X, após isso foram calculadas as isotermas de adsorção utilizando os modelos de Langmuir e Freundlich para avaliar o mecanismo de adsorção e identificar as soluções com melhor adequação em concentrações de 100 a 300mg/L de corante AM. Após as análises, identificou-se que as amostras responderam satisfatoriamente ao objetivo, baseando-se no coeficiente de correlação (R²) se concluiu que as amostras se adequaram para ambos os modelos, com capacidade máxima de adsorção de 72,46mg/g.
Palavras Chaves
ISOTERMAS; ADSORÇÃO; REJEITO DE CAULIM
Introdução
O processo de adsorção tem sido objeto de estudo para os cientistas desde o começo do século, pois apresentam importância tecnológica e biológica, além de funcionabilidade em práticas na indústria e na proteção ambiental sendo uma ferramenta útil em diversos setores (ROCHA, 2019). Segundo Souza (1999), adsorção é definida como um processo no qual as moléculas presentes em um fluido, liquido ou gás acumulam-se espontaneamente sobre uma superfície sólida. O fenômeno acontece pelo resultado de forças que não se encontram de maneira balanceada na superfície sólida e acabam atraindo as moléculas do fluido em interação por um tempo finito. A adsorção é um processo que tem ligação direta com alguns fatores, como a natureza do adsorvente, do adsorvato e das condições operacionais. O adsorvente possuí características de área superficial, tamanho do poro, densidade, grupos funcionais presentes na superfície e hidrofobicidade do material. Enquanto o adsorvato depende de fatores como polaridade, tamanho da molécula, solubilidade e acidez ou basicidade. As condições operacionais englobam primordialmente a temperatura, pH, e natureza do solvente (ROCHA, 2019). Muito embora o carvão ativado ser atualmente muito utilizado em escala industrial para remoção de corantes de solução aquosa (MATOS, 2016), segundo TSAI (2009), o mesmo apresenta algumas desvantagens, pois ele é inflamável e difícil de ser recuperado. Além disso, impurezas minerais e grupos funcionais contendo oxigênio naturalmente presentes no carvão ativado podem torná-lo fracamente hidrofílico, resultando em afinidade fraca para a adsorção de corantes catiônicos ou aniônicos da solução aquosa. Sendo assim, uma boa alternativa de utilização por conter boa propriedade adsortiva são os materiais micáceos (ROCHA, 2019), que são aluminossilicatos pertencentes à subclasse dos filossicatos. Possuem unidade estrutural básica do tipo lamelar em que duas camadas tetraédricas de sílica cercam uma camada octaédrica de alumina, configurando um arranjo 2:1 (LUZ, 2008). A mica natural pode ser frequentemente encontrada na natureza, no entanto, existem impurezas que limitam significativamente sua eficiência para determinadas aplicações industriais, assim, cabe a obtenção de micas sintéticas para abrandar essas barreiras (BRITO, 2019), visto que há um possível controle da quantidade das substituições isomórficas nos sólidos sintetizados que induzem automaticamente na pureza e composição, e portanto o surgimento de novas aplicações em uma vasta diversidade de produtos da indústria moderna (ROCHA, 2019). Devido a isso acompanhado do grande volume de rejeito produzido durante o processo de beneficiamento do caulim, resulta no interesse de pesquisadores em reutilizar esse rejeito como matéria-prima na síntese de materiais micáceos. Portanto, o objetivo deste trabalho é averiguar as propriedades adsortivas de micas sintéticas desenvolvidas a partir do resíduo do beneficiamento de caulim mediante de síntese hidrotérmica. Para tal fim, foi utilizado o corante azul de metileno, que segundo Aygun et al. (2003) e Karaca et al. (2004), é o corante mais utilizado devido consideração de ser um composto modelo para estudos da remoção de corantes orgânicos em meio aquoso
Material e métodos
Materiais para Ensaio: As amostras do presente trabalho foram sintetizadas hidrotermicamente em autoclaves feitos de aço inoxidável, utilizando como referência o trabalho de Brito (2018). O gel de síntese foi composto a partir de uma proporção molar de rejeito de caulim, sulfato de manganês, hidróxido de potássio e água, usada como meio de reação. As autoclaves foram submetidas a temperaturas de 150 ºC e 160 ºC, sendo mantidas em uma estufa por 24 e 48 horas, respectivamente, sendo assim, temos: Amostra A, Mica sintetizada a partir do rejeito de cauim durante 24h a 150º, Amostra B, Mica sintetizada a partir do rejeito de cauim durante 24h a 160º, Amostra C, Mica sintetizada a partir do rejeito de caulim durante 48h a 150º e Amostra D, Mica sintetizada a partir do rejeito de cauim durante 48h a 160º.Ensaio de adsorção: A partir de uma solução estoque de azul de metileno de concentração 1000 mg.L-1, foram preparadas soluções de diferentes concentrações (100, 200, 300 mg.L-1) através de diluição. Para cada amostra, 10 mL do referido corante foram medidos e transferidos para um recipiente juntamente com uma fração de 100 mg dos materiais A, B, C e D, assegurando que cada amostra fosse homogeneamente misturada com cada concentração de azul de metileno. As amostras foram inicialmente agitadas e permaneceram por 24 horas em repouso para atingir o equilíbrio; após este período, a eficiência de remoção do corante foi avaliada visualmente e documentada por meio de imagens. Posteriormente, amostras dos sobrenadantes foram coletadas para análise espectrofotométrica, com o objetivo de identificar a concentração de equilíbrio do azul de metileno na solução após o processo de adsorção.Isoterma de adsorção segundo modelo de Langmuir: Os dados experimentais das amostras foram aplicados na equação (1)Ce/qe=1/qmax.Ce. (1/Kl.qmax) para encontrar a capacidade máxima de adsorção através de qmax. Entre as propriedades essenciais da isoterma de Langmuir, o fator de separação (RL) é importante para avaliar o estágio de desenvolvimento do processo de adsorção, pois determina favorabilidade ou desfavorabilidade de um processo de adsorção, uma vez que, quando o RL apresenta valores entre 0 e 1 caracteriza-se uma adsorção favorável, diferentemente, quando RL é maior que 1, reflete uma maior afinidade do adsorvato com a fase líquida em comparação com a fase sólida, denotando uma adsorção desfavorável (LEANDRO-SILVA, 2020). O valor de RL adimensional foi obtido através da equação (2)RL=1/(1+(Kl.Ce)).Isoterma de adsorção segundo modelo de Freundlich:Os dados experimentais das amostras foram aplicados na equação (3) para encontrar sua equação da reta, assim, ajustando a isoterma segundo o modelo de Freundlich.(3)logCe=logKf+ (1/n.logCe). As isotermas da Figura 2 foram plotadas a partir do Origin Pro 8.
Resultado e discussão
Análise de Difração de raios X: na Figura 1A, é possível observar na análise
mineralógica por difração de raios X do rejeito de caulim “in natura” a presença
de picos característicos do argilomineral caulinita (Al2.O3), sendo o
constituinte principal apresentado no difratograma com os picos em 2θ = 12,45°
(7,11 Å), 20,42º (4,35 Å) e 24,96º (3,57 Ǻ). Segundo Hildebrando et al. (2012),
o rejeito de caulim tem como componente majoritário a fase mineralógica
caulinita, juntamente com minerais acessórios tais como quartzo (SiO2) e
anatásio (TiO2). Ainda na análise de difratograma na Figura 1B, referente a
amostra D, produto da síntese realizada a 160 ºC durante 48 horas, observou-se
picos cristalográficos com características de minerais do tipo 2:1, com indícios
da existência de materiais micáceos evidenciados pelas posições em
aproximadamente 2Ɵ = 8,7º (10,2 Å), 26,4º (3,4 Å), 33,5º (2,6 Å) e 59,1º (1,5
Å).
Os parâmetros dos modelos de Langmuir foram determinados a partir da Equação 1,
onde obtiveram-se os valores de qmax: Amostra A = 43,37 mg.g-1,
Amostra B = 72,46 mg.g-1, Amostra C = 52,35 mg.g-1 e
Amostra D = 47,84 mg.g-1.
Os modelos de isotermas investigadas no estudo mostraram que as relações
de adsorção de Azul de metileno para todas as Amostras correspondem às equações
de Langmuir e Freundlich, destacando a Amostra B que apresentou uma melhor
adaptação, concordando com trabalho de GHOSH & BHATTACHARYYA (2002). A partir
disso juntamente com o valor RL encontrado a partir da equação (1), conclui-se
que as amostras tem comportamento favorável para a isoterma de Langmuir, uma vez
que, segundo GHOSH & BHATTACHARYYA (2002), a adsorção favorável é indicada
quando 0 < RL < 1. Além disso, adaptação a Freundlich indica que houve adsorção
em multicamada, desta forma apontando para uma superfície heterogênea do
material adsorvente (CIOLA, 1981; MCKAY, 1996). Devido isso, as amostras
apresentaram valores notáveis para qmáx (quantidade máxima adsorvida). De forma
decrescente, a classificação é a seguinte: Amostra B > Amostra C > Amostra D >
Amostra A.
Com base nos coeficientes de correlação (R2) obtidos através dos gráficos, as
amostras que apresentaram os melhores resultados para o modelo de
Langmuir foram: Amostra B e Amostra C, enquanto que para o modelo de Freundlich
as amostras que mais se adequaram foram Amostra B e Amostra A.
É relevante levar em consideração que a equação de Freundlich não é capaz de
prever dados de equilíbrio de adsorção quando se operam com intervalos de
concentrações excessivamente altas. Além disso, essa equação não se converte à
expressão de adsorção linear quando se lida com concentrações muito baixas. No
entanto, em geral, os estudos frequentemente situam-se numa faixa de
concentração moderada, tornando-a útil para a adaptação de dados (COONEY, 1999).
Comparando os dados obtidos neste trabalho com os valores de capacidade de
adsorção para diferentes materiais encontrados na literatura, pode-se citar
Caulinita pura: 15,55 mg.g-1 (GHOSH & BHATTACHARYYA, 2002), Caulinita
intercalada: 59,97 mg.g-1 (OLIVEIRA, 2012), Montmorilonita AlPILC:
21,00 mg.g-1
(GUSEK et al.,2005), Amostra B: 72,46 mg.g-1 (este trabalho).
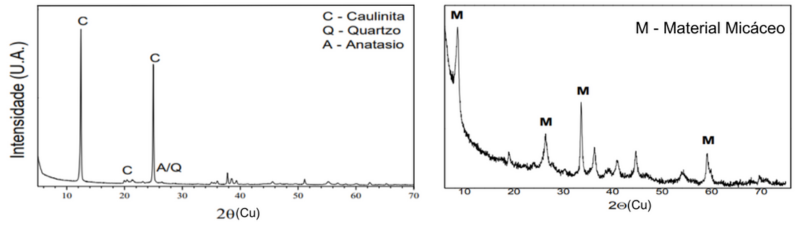
Figura 01 – (a) Difração de raios X do rejeito de \r\ncaulim “in natura”; (b) Difratograma da amostra D
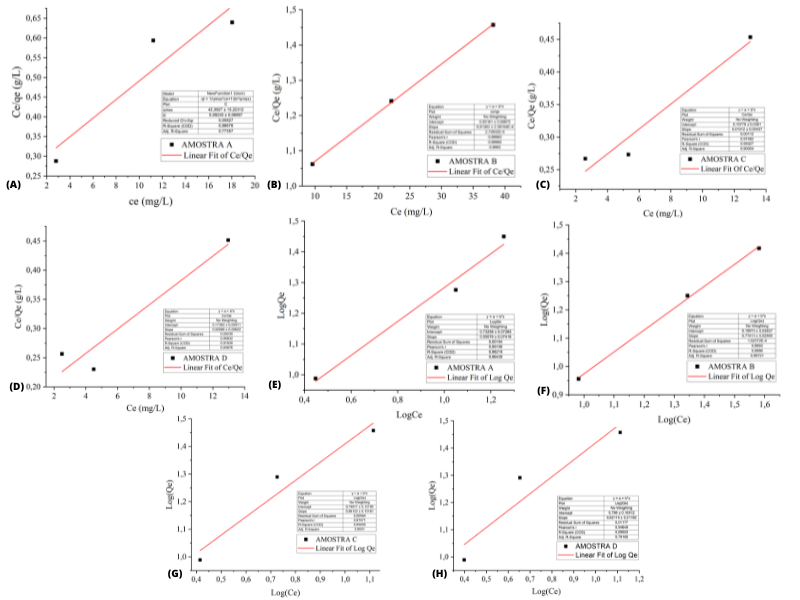
Isotermas de adsorção do corante (AM): (a) – (d); \r\nModelo de Langmuir; (e) - (h); Modelo de Freundlich
Conclusões
Os materiais micáceos obtidos a partir de rejeito de caulim demonstraram possuir uma propriedade adsortiva relevante, atingindo uma capacidade adsortiva de 72,46 mg.g-1 conforme mostrado pelo modelo de Langmuir. Os modelos de isotermas analisadas no estudo revelaram que as relações de adsorção de Azul de metileno nas amostras correspondem às equações de Langmuir e Freundlich, com uma adsorção favorável para adsorção em monocamadas no início do processo seguindo para uma adsorção em múltiplas camadas, muito provavelmente devido a estrutura heterogênea dos materiais adsorventes, uma vez que se tratam de filossicatos e os mesmos possuem espaços entre suas camadas.
Agradecimentos
Referências
AYGUN A., Yenisoy-Karakas S., Duman I. 2003. Production of granular activated carbon from fruit stones and nutshells and evaluation of their physical, Chemical and adsorption properties. Microporous and Mesoporous Materials., 66: 189-195
BRITO C. E. C. Síntese e Caracterização de Argilominerais Micáceos a partir de Rejeito do Processamento do Caulim. Trabalho de Conclusão de Curso (Bacharelado em Engenharia de Materiais) – Campus Universitário de Ananindeua, Universidade Federal do Pará, Ananindeua, 2019.
BRITO, C.E.C; DIAZ, F.R.V; NEVES, R.F; HILDEBRANDO, E.A. AVALIAÇÃO DE UM REJEITO CAULINÍTICO VISANDO SUA APLICAÇÃO COMO MATÉRIA PRIMA NA SÍNTESE DE NANOCARGAS MINERAIS. Congresso Brasileiro de Química - CBQ, SÃO LUÍS / MA, 6 nov. 2018.
CIOLA, R. Fundamentos da catálise. São Paulo: Moderna, 1981
COONEY, D. O. Adsorption Design for Wastewater Treatment. Florida: CRC Press, 1999.
GHOSH, Dipa; BHATTACHARYYA, Krishna G. Adsorption of methylene blue on kaolinite. Applied clay science, v. 20, n. 6, p. 295-300, 2002.
KARACA S. Gürses A., Bayrak R. 2004. Effect of some pre-treatments on the adsorption of methylene blue by Balkaya lignite. Energy Conversion and Management., 45 1693-1704.
LANGMUIR, I. The dissociation of hydrogen into atoms. III. The mechanism of the reaction. Journal of the American Chemical 238 Society, v. 38, n. 6, p. 1145-1156, jun. 1916
LEANDRO-SILVA, Emerson et al. Aplicação dos modelos de Langmuir e Freundlich no estudo da casca de banana como bioadsorvente de cobre (II) em meio aquoso. Matéria (Rio de Janeiro), v. 25, p. e-12656, 2020.
LUZ A., CAMPOS A., CARVALHO E., BERTOLINO L. Rochas e minerais Industriais: usos e especificações. 2.Ed. Rio de Janeiro: CETEM/MCT, 2008.
MATOS, Cintia da Silva. Estudo da capacidade adsortiva do rejeito de caulim visando a aplicação na remoção de contaminantes orgânico em meio aquoso. 2019. Orientador: Edemarino Araujo Hildebrando. 59 f. Trabalho de Conclusão de Curso (Bacharelado em Engenharia de Materiais) – Campus Universitário de Ananindeua, Universidade Federal do Pará, Ananindeua, 2018.
MCKAY, G. Use of adsorbents for the removal of pollutants from wastewaters. Boca Raton: CRC Press, 1996.
OLIVEIRA, Silze. Adsorção do Corante Azul de Metileno em Caulinita Natural e Intercalada com Acetato de Potássio Provenientes da Região de Bom Jardim de Goiás – GO. 2012. 62f. Dissertação (Pós graduação em Geociências) – Universidade Federal de Mato Grosso, Cuiabá, 2012.
ROCHA, J. B. Avaliação das Propriedades de Adsorção de Materiais Micáceos Sintetizados a partir de Caulim Flint. Orientador: Edemarino Araujo Hildebrando. 2019. 61 f. Trabalho de Conclusão de Curso (Bacharelado em Engenharia de Materiais) – Campus Universitário de Ananindeua, Universidade Federal do Pará, Ananindeua, 2019.
SOUZA, E. Introdução à cinética química. Belo Horizonte: Instituto de Ciências Exatas e Tecnológicas, Departamento de Química, UFMG, 1999.
TSAI, Wen-Tien; HSIEN, Kuo-Jong; HSU, Hsin-Chieh. Adsorption of organic compounds from aqueous solution onto the synthesized zeolite. Journal of hazardous materials, v. 166, n. 2-3, p. 635-641, 2009.
















