ÁREA
Química Ambiental
Autores
Mendonça, T.N.T.F.M. (UFERSA) ; Pessoa, C.R. (UFERSA) ; Araújo, J.P.L. (UFERSA) ; Silva, F.W.M. (UFERSA) ; Pimentel, P.M. (UFERSA)
RESUMO
Este trabalho tem por objetivo o estudo termodinâmico da adsorção de paracetamol em solução aquosa em carvão ativado comercial (CAC). Inicialmente, foram determinadas experimentalmente isotermas de equilíbrio de adsorção em quatro diferentes temperaturas. No estudo termodinâmico, o modelo de Langmuir foi ajustado as isotermas. Em seguida, partindo da constante do modelo de Langmuir (KL) e da curva de lnKeqx1/T, foram obtidos os parâmetros termodinâmicos. Observou-se que as variações ∆G° foram próximas em cada temperatura e de natureza espontânea com variação de entalpia padrão de -3,15kJ/mol. Estes resultados mostram que o processo de adsorção de paracetamol em CAC é espontâneo e exotérmico e que a temperatura tem pouca influência na capacidade de adsorção do adsorvente estudado.
Palavras Chaves
ADSORÇÃO; PARACETAMOL; CARVÃO ATIVADO
Introdução
A constante evolução da medicina e o crescimento industrial tem causado um aumento gradativo no consumo de fármacos, causando impactos ambientais negativos devido ao descaso antropogênico com o descarte de resíduos que afetam tanto o ecossistema quanto a saúde e a qualidade de vida dos seres humanos (LIMA et al., 2017; TAMBOSI, 2008). Conhecidos como micropuluentes, os fármacos são detectados nos corpos d'águas superficiais, efluentes de estações de tratamento de esgoto e água, entre outros. Estes contaminantes podem alterar a qualidade da água de abastecimento de água potável, causando significativos efeitos adversos, além de possuírem pequena biodegradabilidade no meio ambiente, contribuindo, assim, para o aumento da prevalência ambiental e para o impacto sobre os organismos aquáticos e terrestres (LIMA et al., 2017).Os processos convencionais de tratamentos de águas são ineficientes para remoção desses micropoluentes, sendo necessário adicionar técnicas mais avançadas ao tratamento. Diversos estudos sobre essas técnicas têm mostrado eficiência na remoção dos fármacos, sendo elas a tecnologia de biorreatores com membranas, processos oxidativos avançados e adsorção em carvão ativado. Este último pode eliminar vários compostos farmacêuticos poluentes, pois a existência do grupo amida ou os anéis benzênicos na sua estrutura possibilita a adsorção por carvões ativados, devido à sua combinação única de uma rede porosa altamente desenvolvida (TAMBOSI, 2008). No Brasil, os anti-inflamatórios não-esteroidais são medicamentos que não necessitam de prescrições médicas para ser obtidos e compõem diversos medicamentos a venda, distinguindo assim esta classe de medicamentos como a mais prescrita por médicos e dentistas e, logo, uma das mais consumidas. Nesta ampla classe existem: ácido acetilsalicílico, cetoprofeno, fenoprofeno, flurbiprofeno, ácido tiaprofenico, carprofeno, loxoprofeno, indometacina, ibuprofeno, diclofenaco e acetaminofeno (paracetamol) (KRAMER et al, 2015). Ao longo do tempo tem sido intensificado a presença desses compostos nas águas e solos devido ao descarte indevido de medicamentos vencidos, da excreção de metabólitos que não são eliminados no processo de tratamento de esgotos, do uso em indústrias, escoamento de águas agrícolas e pecuárias, aterros sanitários, fossas sépticas e atividade doméstica. Esses contaminantes na água têm o potencial de causar significativos efeitos adversos no ecossistema, pois induzem a formação de mutações que resultam na resistência de antibióticos em bactérias, causam toxicidade aguda e crônica, bioconcentração em cadeias alimentares e efeitos endócrinos (NAVES; BARBOSA; LACERDA, 2022). Entre os microcontaminantes encontrados em recursos hídricos, o paracetamol merece atenção. Por ser um medicamento analgésico e antipirético, é muito utilizado para combater febre e dores leves e moderadas (CONRADO, 2019). Com isso, esse fármaco é bastante descartado no meio ambiente, o que pode acarretar, em longo prazo, problemas mais graves ao ecossistema e aos seres humanos, até mesmo diminuir os limites toxicológicos permitidos devido ao aumento da resistência nas bactérias. Vários processos podem ser incluídos na remoção de fármacos, tais como fitotratamento, coagulação, radiação gama, osmose reversa. No entanto, estes processos não são amplamente utilizados devido aos custos de implantação e operação de tais sistemas. Consequentemente, existe a necessidade crescente de processos alternativos no tratamento de águas residuárias para remoção de fármacos que podem ser úteis como etapas de pré ou pós-tratamento do processo final, tal como a adsorção em carvão ativado, devido seu baixo custo e ter mostrado eficiência no processo. Em Snyder et al. (2007), é reportado que tanto o carvão ativado em pó quanto o carvão ativado granular são capazes de remover produtos farmacêuticos com eficiências de até 90% em estações de tratamento de água de abastecimento. Vários estudos reportam a adsorção de paracetamol em carvão ativado como promissora (CONRADO, 2019; FERREIRA, 2015; TAMBOSI, 2008). No entanto, poucos trabalhos refletem sobre a determinação de parâmetros termodinâmicos. Dessa forma, este trabalho tem como objetivo avaliar a adsorção de paracetamol em uma amostra de carvão ativado comercial. Para isso, será determinada a isoterma de adsorção e os parâmetros termodinâmicos da adsorção, como forma de avaliar a performance do carvão como material para a separação de paracetamol de soluções aquosas.
Material e métodos
Para realização desse estudo, foi utilizado como adsorvente uma amostra de carvão ativado comercial (CAC) nomeada de WV1050, produzida pela empresa Mead- Westvaco (EUA). O adsorvato utilizado foi o paracetamol sob forma pulverizada com pureza nominal de 100%, produzido pela Salutaris Farmácia. A metodologia empregada consistiu na determinação experimental de isotermas em diferentes temperaturas, determinação dos parâmetros do modelo de Langmuir e estimação dos parâmetros termodinâmicos. Isoterma de Adsorção Para a determinação das isotermas de adsorção, empregou-se a metodologia experimental descrita em Conrado (2019). Dados preliminares, como pH de solução e tempo de equilíbrio foram retirados de seu trabalho. As soluções aquosas foram preparadas com água deionizada ajustada para pH 2 (pH ideal), em diferentes concentrações (5, 10, 20, 30, 40, 50, 75, 100, 125, 150, 175, 200 mg/L). Previamente aos experimentos de determinação das isotermas de adsorção, o adsorvente passou por um processo de regeneração de três horas a 120 °C em estufa. Todos os experimentos foram realizados em duplicata. Foram pesadas amostras de 0,01g do adsorvente (CAC) para serem postas em contato com as soluções em erlenmeyer de 125 ml, sob agitação de 160 (rpm) por 12 horas. As concentrações foram medidas em espectrofotômetro UV-VIS, com comprimento de onda de 243 nm. Foram realizadas medições de isotermas em quatro temperaturas: 30, 40, 50 e 60 °C. Foram calculadas as quantidades de paracetamol adsorvidas e realizados ajustes com o modelo de Langmuir para cada etapa do experimento. Para mais detalhes acerca da metodologia deve-se consultar o trabalho de Conrado (2019). A quantidade de paracetamol removida em função da concentração foi calculada pela Equação 1. qads=((Co-Ce)V)/m (1) Onde, qads= quantidade adsorvida de paracetamol por unidade de massa de carbono ativado (mg/g); Co= concentração da solução inicial de paracetamol (mg/L); Ce= concentração da solução de paracetamol no equilíbrio (mg/L); V= volume da solução de paracetamol utilizada no experimento (L); m= massa da amostra de carbono ativado utilizado (g). Determinação dos parâmetros termodinâmicos Os parâmetros termodinâmicos foram estimados a partir das isotermas ajustadas pelo modelo de Langmuir. Usando a constante do modelo de Langmuir, foram estimados a variação da energia livre de Gibbs padrão (∆G°), a variação de entropia padrão (∆S°) e a variação de entalpia padrão (∆H°), que corresponde a entalpia de adsorção. Para mais detalhes acerca das equações utilizadas deve-se consultar o trabalho de Pessoa (2023). Dessa forma foi possível determinar esses valores e definir características, como a espontaneidade, se ocorreu liberação ou absorção de calor, o grau de desordem no sistema.
Resultado e discussão
Isotermas de Adsorção de Paracetamol
A Figura 1 a) mostra as isotermas de adsorção de paracetamol medidas a 30, 40,
50 e 60 °C no carvão ativado comercial WV1050. Em todo intervalo de concentração
de equilíbrio analisado, as isotermas mostraram um padrão em que as quantidades
adsorvidas foram semelhantes nas distintas temperaturas estudadas. Tal
comportamento expõe que a temperatura tem pouca influência sobre a capacidade de
adsorção.
A Figura 1 b) mostra que foi obtido altos valores de coeficiente de correlação
(R2>0,97) para os ajustes pelo modelo de Langmuir. Pode-se perceber
que a medida que a temperatura aumenta, diminui a interação entre o adsorvato e
adsorvente, demonstrado pela diminuição da constante de Langmuir. Observa-se que
a 30°C o KL foi igual a 0,18852 e a 40°C o KL foi igual a 0,18634,
apresentando uma variação apenas na terceira casa decimal. Já para 50°C, KL=
0,1759 e em 60°C, KL= 0,1694, exibiu uma redução da constante de interação na
segunda casa decimal.
Com essas observações constatou-se que as isotermas de adsorção apresentaram
variações mínimas na constante de Langmuir, o que sugere pouca influência da
temperatura no processo de adsorção, pois o KL é diretamente proporcional à
capacidade máxima de adsorção, o que confirma com os resultados mostrados
previamente na Figura 1 a).
Estudo Termodinâmico
Com base nas isotermas ajustadas, foi possível determinar os parâmetros
termodinâmicos e realizar o estudo em relação aos valores das variações padrões
da energia de Gibbs (∆G°), da entalpia (∆H°) e da entropia (∆S°).
Os valores de KL foram usados para estimar os parâmetros a partir da inclinação
e da interceptação da curva de ln(Keq)x1/T, conforme mostrado na Figura 2 a). A
constante de equilíbrio (Keq) para cada temperatura foi obtida através da
Equação 2.
Keq=(KL×MM×C°)/λ° (2)
Onde,
Keq = constante de equilíbrio termodinâmico;
KL= constante de interação adsorvato/adsorvente do modelo de Langmuir (L/g);
MM= massa molar do paracetamol (g/mol);
C°= concentração molar padrão 1 mol/L;
λ°= coeficiente de atividade padrão.
Os dados foram ajustados por um ajuste linear, exibindo um bom coeficiente de
correlação (~0,94), posto que, a = 380,15 e b = 9,0143 (coeficientes da equação
do 1° grau obtida pelo ajuste). Dessa forma, com a construção do gráfico e a
obtenção dos coeficientes pela equação, foi calculado a variação de entalpia
padrão (∆H°), a variação de entropia padrão (∆S°), a variação da energia livre
de Gibbs padrão (∆G°) em cada temperatura (Figura 2 b)), a partir das equações a
seguir.
ΔH°=-(a×R)/1000 (3)
ΔS°=-(b×R)/1000 (4)
ΔG°=-RTlnKeq (5)
Onde,
R= constante dos gases (8,314 J/mol. K);
T= temperatura (K);
Os parâmetros termodinâmicos foram estimados para aferir a viabilidade e
natureza do processo de adsorção. Os valores negativos de ∆G° indicam que o
processo de adsorção é de natureza espontânea.
O valor negativo obtido para ∆H° desponta que a interação no processo de
adsorção foi de natureza exotérmica, indicando que o processo libera
calor/energia. Este comportamento pode ser explicado pela distância entre a
superfície do sólido e a substância adsorvida serem muito próximas na adsorção
química, associada à formação de interações, neste caso, com o solvente.
Por fim, o valor positivo de ΔS° mostra que houve um aumento na aleatoriedade na
interface sólido-solução no processo de adsorção. Este aumento na desordem pode
ser atribuído à entropia translacional extra adquirida pelas moléculas de água,
que estavam previamente adsorvidas ou localizadas nas multicamadas ao redor da
superfície.
Um ponto a destacar é o fato de que cada sítio de adsorção pode ter
características próprias e, portanto, diferentes propriedades adsortivas, já que
raramente se tem uma superfície de sítios homogêneos. Como o próprio valor de KL
nessa metodologia é obtido por linearização dos dados da isoterma, isso mostra
que tanto ΔG° como ΔH° e ΔS° não são exatamente as verdadeiras funções
termodinâmicas no processo de adsorção, e sim valores médios.
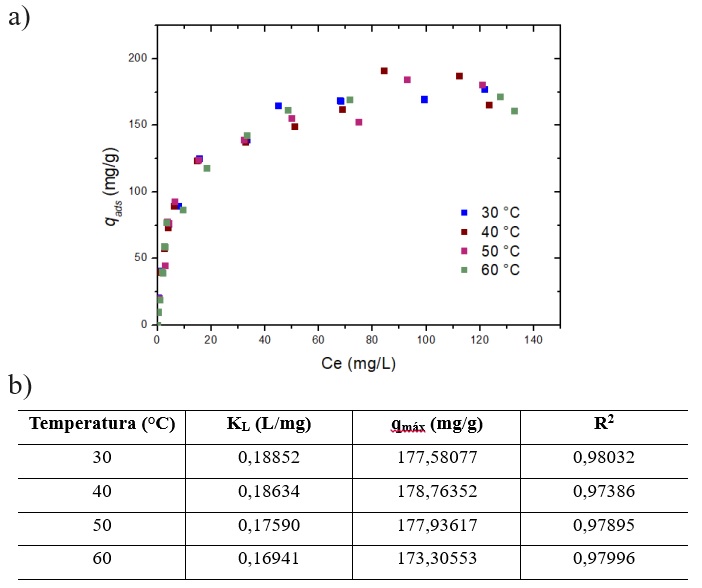
a) Isotermas de adsorção de Paracetamol em CAC em \r\ndiferentes temperaturas. b) Parâmetros obtidos dos \r\najustes das isotermas pelo modelo de Langmuir.
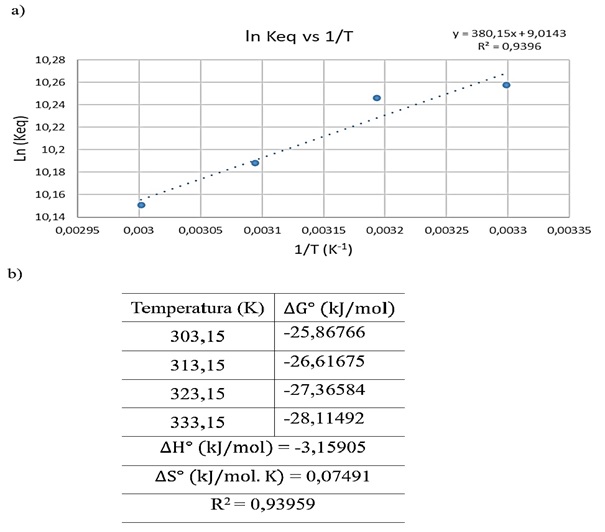
a) Interceptação da curva de ln(Keq)x1/T. b) \r\nParâmetros termodinâmicos para o processo de \r\nadsorção.
Conclusões
Adsorção em carvão ativado foi estudada para evidenciar sua eficácia na remoção do paracetamol em solução aquosa. Os resultados mostraram que o adsorvente tem potencial de adsorção para o intervalo de concentração analisado, com capacidades máximas de adsorção de até 178,7 mg de paracetamol/g de carvão ativado. Pode-se verificar a partir das isotermas medidas que, para o intervalo estudado (30 a 60 °C), a temperatura tem pouca influência sobre a quantidade adsorvida. Por sua vez, o modelo de Langmuir se ajustou bem a todas as isotermas, apresentando coeficiente de correlação em torno de 0,98. Os estudos termodinâmicos mostraram que o processo de adsorção aconteceu de forma espontânea, de natureza exotérmica e com aumento da aleatoriedade na interface sólido-líquido.
Agradecimentos
O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001, através do PPGCEM da UFERSA.
Referências
CARVALHO, S.C. Resíduos da indústria de beneficiamento de castanha de caju Anarcadium occidentale L. como adsorvente de cromo (VI) em solução aquosa. Mossoró-RN. UFERSA,2021. 33-35 p.
CONRADO, N.M. Remoção de paracetamol de solução aquosa em carbono ativado. Mossoró-RN: UFERSA, 2019. 1-11 p.
FERREIRA, R.C. Mecanismo de adsorção de paracetamol em carvões nacionais. Maringá-PR: UTFPR, 2015. 44-110 p.
KRAMER ET AL. Determinação de anti-inflamatórios na água e sedimento e suas relações com a qualidade da água na bacia do Alto Iguaçu, Curitiba-PR. RBRH
Revista Brasileira de Recursos Hídricos. VOLUME. 20 - Nº. 3 - JUL/SET – 2015 p. 657 - 667. DOI: 10.21168/rbrh.v20n3.p657-667. Disponível em: < https://www.abrhidro.org.br/SGCv3/publicacao.php?PUB=1&ID=182&SUMARIO=5095> Acesso em junho de 2022.
LIMA, D.R.S. et al., Pharmaceuticals and endocrine disrupting compounds in Brazilian waters: occurrence and removal techniques. Ouro Preto (MG): UFOP, 2017. Eng Sanit Ambient. 1-12 p. v.22 n.6
NASCIMENTO, R.F. et al. Adsorção: aspectos teóricos e aplicações ambientais. Fortaleza-CE: UFC, 2014. 73-86 p.
NAVES, J.T.R; BARBOSA, D.S; LACERDA, C.A. Emerging micropollutants of pharmaceutical origin in surface waters in BRICS: a review. Rondonópolis-MG: Research, Society and Development, 2022. 1-12 p. v. 11.
PESSOA, C. Adsorção de paracetamol em solução aquosa em carvão ativado: estudo termodinâmico. 2023. TCC (Graduação) - Curso de Bacharelado em Ciências e Tecnologia, Universidade Federal Rural do Semi-Árido (Ufersa), Mossoró-RN, 2023.
SILVA, F.N. Investigação da Seletividade e da Termodinâmica de Adsorção de Cr(VI) de Águas Residuárias por Nanoadsorventes Magnéticos do Tipo CoFe2O4-Fe2O3. Brasília-DF: FACULDADE UnB- PLANALTINA, 2018. 74-93 p.
SNYDER, S.,et al. Role of membranes and activated carbon in the removal of endocrine disruptors and pharmaceuticals. Desalination. v.202: p.156-181, 2007.
TAMBOSI, J.L. Remoção de fármacos e avaliação de seus produtos de degradação através de tecnologias avançadas de tratamento. Florianópolis(SC): UFSC, 2008. 74-110 p.
















