ÁREA
Química Ambiental
Autores
Gomes, R.K.M. (UFPE) ; Santana, R.M.R. (UFPE) ; Cavalcanti, V.O.M. (UFPE) ; Lucena, A.L.A. (UFPE) ; Duarte, M.M.M.B. (UFPE) ; Napoleão, D.C. (UFPE)
RESUMO
A pectina, polissacarídeo presente em vegetais, possui relevância industrial, sendo utilizada em diversas aplicações. Sua produção se dá convencionalmente usando método hidrotérmico. Esse método apresenta elevado desperdício de solvente, energia e tempo, de modo que a viabilidade de métodos alternativos (ultrassônico) vem sendo analisada. Este trabalho buscou extrair pectina da casca de maracujá via método ultrassônico. Para tal, realizou-se um estudo com planejamento fatorial. A pectina produzida foi caracterizada via FT-IR mostrou espectro conforme a literatura e seu grau de esterificação determinado por titulometria, indicando baixo teor de metoxila. Verificou-se que as condições ótimas foram 120 min, razão casca/solvente 1:20, 30°C e 200 W, com rendimento de 15,32%.
Palavras Chaves
Pectina; Ultrassom; Resíduos
Introdução
A pectina corresponde a polissacarídeos ácidos que estão presentes na lamela média e na parede celular primária e secundária do tecido vegetal. Essa tem modelo estrutural hipotético composto pelos domínios de homogalacturonan (65% da molécula), ramnogalacturonan I (20 – 35% da molécula), ramnogalacturonan II (cerca de 10% da molécula) e, em alguns casos, xilogalacturonan (MARENDA et al., 2019; MAO et al., 2019). O homogalacturonan, domínio em maior quantidade, possui como unidade fundamental o ácido d-galacturônico (produzido pela oxidação da d-galactose), de modo que pode ser descrito como um esqueleto linear de ácido α (1-4) -D -galacturônico (MAO et al. 2020). A estrutura da pectina está diretamente ligada às suas propriedades físico- químicas e, consequentemente, a suas aplicações (DAO et al. 2021). Dentre suas principais propriedades está o grau de esterificação (%GE), o qual pode ser definido como número total de grupos carboxila esterificados. Considerando essa propriedade, as pectinas podem ser subdivididas em alto metoxil (%GE > 50%) quando apresentam uma maior quantidade de grupos carboxila esterificados e baixo metoxil (%GE < 50%) quando esses grupos estão em menor quantidade (SANTOS et al. 2020). De grande relevância industrial, a pectina possui diversas aplicações que vão desde agente espessante e gelificante, estabilizador coloidal, texturizador e emulsificante na indústria alimentícia até sua utilização como agentes micro e nanoencapsulador para liberação de princípios ativos na indústria farmacêutica (MELLINAS et al., 2020). Vale destacar também que apesar de existirem poucos estudos avaliando sua utilização como coagulante para tratamento de efluentes, tais resultados mostram que seu emprego pode ser promissor (SIN et al., 2020). Este composto é comercializado como um pó de cor que varia entre branco e castanho claro e sua produção a partir de resíduos agrícolas de lignocelulose vem ganhando destaque, sendo mais comum sua extração a partir da laranja (ZOGHI et al., 2023). O uso da casca de maracujá também vem despertando interesse como matriz de extração, uma vez que contém uma grande quantidade de compostos bioativos e polissacarídeos e representa cerca de 60% do fruto (somando mesocarpo e epicarpo) (OLIVEIRA et al., 2016; DAO et al., 2021). A pectina é produzida industrialmente em um processo de 4 etapas: extração, purificação, precipitação e desesterificação, sendo o primeiro de grande relevância para se atingir altos rendimentos (DAO et al. 2021). A extração de pectina consiste em uma operação físico-química de hidrólise composta de várias etapas, o que leva à remoção dessa macromolécula dos tecidos vegetais (KUMAR et al. 2020). Vale também ressaltar que a estrutura real da pectina extraída depende não só das características da fonte vegetal utilizada, mas também do método de extração empregado (DRANCA et al. 2020). A produção desse polissacarídeo é comumente realizada via método convencional (método hidrotérmico) que consiste na extração sólido-líquido, em água acidificada e com temperaturas entre 80 e 100°C (CHEN et al., 2021). Vale ressaltar que, segundo Fakayode; Abobi (2018), fatores como pH, temperatura, solvente extrator, tempo de extração, taxa de agitação, razão solvente-massa, entre outras variáveis afetam a eficiência de extração. Entretanto, apesar das alternativas já empregadas para diminuição de seu impacto ambiental, o método convencional pode levar ao desperdício de grandes quantidades de solventes, energia e tempo (MARIĆ et al,. 2018; SENGAR et al., 2020). Neste contexto, a extração assistida por ultrassom é um método verde que emprega a energia acústica para obter diferentes compostos de matrizes vegetais, sendo a transferência de massa ocasionada pelo processo de cavitação acústica. Nele, há a formação de bolhas que sofrem colapso liberando grandes quantidades de energia para o meio, o que reduz, inclusive, o tempo de extração (SABATER et al., 2020). Segundo Oliveira et al. (2016), uma vez que a pectina se trata de um polissacarídeo solúvel, a cavitação e o rompimento celular causado pelas ondas de ultrassom podem facilitar a transferência de massa, aumentando o rendimento da extração. Vale salientar também que este método tende a acelerar o processo extrativo sem comprometer a estabilidade do produto, reduzindo perdas de energia (PATIENCE et al., 2021). Dado o que foi exposto anteriormente, o presente trabalho visou avaliar a eficiência do processo de extração de pectina da casca de maracujá utilizando o método com radiação ultrassônica. Além disso foi analisada a influência das variáveis descritas na literatura para a técnica de extração em estudo e otimizar as condições operacionais desse método de extração para posterior emprego como coagulante/floculante em estações de tratamento de efluentes.
Material e métodos
Extração da pectina Realizou-se a coleta e limpeza das cascas (albedo e flavedo/epicarpo) de maracujá provenientes do comércio local de Recife/PE. Esse material foi separado dos resíduos da fruta, lavado em água corrente, seco em estufa (SP Labor) a 80 ± 1°C, triturado com auxílio de um liquidificador (MONDIAL) e classificado em peneiras de Tyler. Em seguida, prosseguiu-se com a análise por meio da extração da pectina com banho ultrassônico (Eco-Sonics). Empregou-se um planejamento fatorial (PF) 2 4 com ponto central (análise em triplicata), tendo como variáveis: tempo de extração (t), razão casca/solvente (m:v) (C/S), temperatura (T) e potência do equipamento (P). Os níveis adotados como mínimo, central e máximo foram: 30, 75 e 120 min; 1:20, 1:35, 1:50; 30, 55 e 80°C e 140, 170 e 200 W, para as variáveis elencadas nesta ordem. Após a extração, o material foi resfriado, filtrado em tecido de Nylon (para remoção dos resíduos de casca) e ao conjunto foi adicionado etanol 96% (SANTA CRUZ) na proporção 1:1. Depois o material foi resfriado a 4 °C por 20 h. Logo após, a pectina produzida foi filtrada em tecido de Nylon, lavada com etanol 96% e seca, em estufa, a 50 ± 1 °C. Logo, foi realizado o cálculo do rendimento (R), segundo a Equação 1. R = (massa de pectina / massa de resíduo de casca) x 100 (1) Os resultados obtidos foram avaliados através do rendimento, empregando o software Statistica 10.0. Caracterização da pectina extraída Os materiais foram caracterizados via espectroscopia na região do infravermelho com transformada de Fourier (FT-IR). Os espectros de FT-IR foram obtidos utilizando a técnica de reflexão total atenuada (ATR), sendo empregado um espectrômetro de infravermelho (PerkinElmer). O intervalo de medição na faixa do infravermelho médio variou de 4000 a 400 cm -1, sendo os dados coletados com resolução de 4 cm -1 em 64 varreduras. Além disso, verificou-se o grau de esterificação (%GE) da pectina produzida através de um método adaptado do Food Chemical Codex (1981). Para isso, foram adicionados 2 mL de etanol PA (Dinâmica) e 100 mL de água destilada a um frasco de Erlenmeyer contendo 50 mg de pectina extraída e o conjunto foi colocado a 60 °C em um shaker sob agitação até dissolução do material. Após dissolvido, foram acrescidas 5 gotas de fenolftaleína ao frasco de Erlenmeyer, o conjunto foi titulado com NaOH 0,5 mol.L-1 e o volume gasto foi registrado (Vi). Posteriormente, à solução foram acrescidos 10 mL de NaOH 0,5 mol.L-1 e o conjunto foi agitado vigorosamente e depois deixado em descanso por 15 min. Terminado esse período, foram acrescentados 10 mL de HCl 0,5 mol.L-1 e prosseguiu com agitação até a solução ficar incolor. Por fim, adicionou-se 3 gotas de fenolftaleína ao frasco de Erlenmeyer e a solução foi novamente titulada com NaOH. O volume final foi registrado (Vf), permitindo o cálculo do %GE (Equação 2). %GE = (Vf / (Vf + Vi)) x 100 (2)
Resultado e discussão
Extração da pectina da casca de maracujá
Para avaliar a extração com banho ultrassônico foi utilizado um planejamento
fatorial 24 com ponto central médio conforme descrito no tópico anterior. Os
dados obtidos para extração de pectina da casca de maracujá foram tratados no
software Statistica 10.0, sendo gerada a Carta de Pareto e os gráficos de cubo
conforme apresentado na Figura 1.
A Figura 1 (A) mostra que os efeitos principais, bem como parte das interações
entre dois e três fatores se mostraram significativas para 95% de confiança.
Tendo isso em vista, os resultados foram avaliados a partir dos gráficos de cubo
apresentados nas Figuras 1 (B), 1 (C) e 1 (D), que indicaram um rendimento de
15,32% para o maior nível de tempo e potência (120 min e 200 W) e para o menor
nível de temperatura e razão casca solvente (30 °C e razão casca/solvente 1:20).
Também foi possível observar que a casca de maracujá propiciou um rendimento
superior a trabalhos da literatura que empregaram laranja como matriz do método
de extração por ultrassom, conforme descrito por Patience et al., 2021.
Esse fato está de acordo com o observado por Freitas et al. (2020), que
afirmam existir uma diferença no teor de pectina obtida à medida que são
utilizadas frutas diferentes, sendo possível observar cerca de 303 mg de pectina
por grama de casca de maracujá, enquanto para a laranja apenas 248 mg.
Vale ressaltar ainda que o rendimento obtido foi superior a trabalhos
encontrados na literatura que também empregaram método ultrassônico e maracujá,
como o que foi desenvolvido por Oliveira et al. (2016). Porém, esse valor
ainda se mostrou inferior ao descrito para o processo convencional, o qual
segundo Benassi et al. (2021), varia em uma faixa entre 2,5 e 30% para
condições de aquecimento entre 80 e 100 °C e tempos de extração variando entre
30 e 180 min.
Entretanto, comparando-se as condições de trabalho com as do processo de
extração convencional, foi obtida uma redução da temperatura ótima de extração
para 30 °C. Isso, segundo Adetunji et al. (2017), se deve ao fato da
radiação ultrassônica propiciar, na maioria dos casos, uma tendência à redução
do rendimento em temperaturas mais altas (a partir de 80 °C) devido aos
fenômenos de despolimerização e desesterificação da pectina. Além disso, o maior
rendimento de extração na menor razão casca/solvente que foi observado para o
maracujá, de acordo com Ke et al. (2020), pode ser associado ao alcance
do equilíbrio dinâmico entre o material sólido e a solução, o que faz com que o
aumento dessa razão não apresente aumento de eficiência.
Caracterização da pectina extraída
De modo a confirmar a identidade da pectina extraída foi realizada a análise de
FT-IR do material extraído. O espectro obtido está apresentado na Figura 2.
Ao avaliar o espectro da Figura 2, é possível verificar a presença de uma banda
em torno de 3346 cm-1, que está associada à vibração de estiramento do grupo
hidroxila (HOSSEINI et al. 2019). A banda observada em torno de 2937 cm-1
corresponde ao estiramento dos grupos CH (–CH, –CH2 e –CH3) das unidades de
ácido D-galacturônico (ASGARI et al. 2020). Segundo Moghaddam et
al. (2020), a banda por volta de 1715 cm -1 corresponde a
vibrações C=O de grupos metil-esterificado (COO–R), enquanto aquela verificada
em 1601 cm -1 corresponde à absorção das vibrações C=O de grupos
carboxila livres (COO–).
Asgari et al. (2020) afirmam ainda que as bandas observadas entre 1200 e
1450 cm-1 correspondem às vibrações de flexão do COH e alongamento de CO. De
acordo com Demir et al. (2020), a faixa espectral entre 1200 e 950 cm
-1 está relacionado à região de impressão digital dos carboidratos
que são específicos para cada polissacarídeo. No caso da pectina, é encontrado o
ácido D-galacturônico. Vale salientar também que a banda em torno de 1225 cm
-1 está relacionada à ligação C-C da estrutura do anel da pectina
(MOGHADDAM et al. 2020). Além disso, as bandas entre 625 e 640 cm
-1 correspondem a vibrações de deformação C-C de menor frequência do
anel pectina esquelético (SENGAR et al. 2020).
Em relação ao grau de esterificação foi obtido um valor de 34,13% para a pectina
extraída. Este resultado indica que se trata de uma pectina com baixo teor de
metoxila (%GE < 50%). Segundo Freitas et al. (2020), vale ressaltar que a
redução da temperatura de extração pode ser responsável por um maior grau de
esterificação do que seria obtido via método convencional, uma vez que este
parâmetro tem uma influência redutora do %GE.
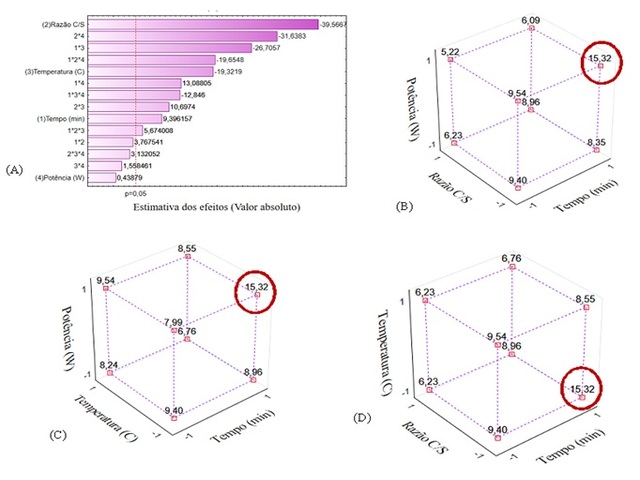
(A) Carta de Pareto; Cubo de resposta da interação: \r\n(B) t, C/S e P; (C) t, T e P; (D) t, C/S e T. (Erro \r\nresidual: 0,027, 95% de confiança).
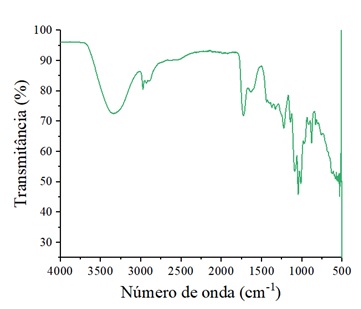
Espectros de FTIR para a pectinas proveniente do \r\nmétodo empregando banho ultrassônico para a casca de \r\nmaracujá.
Conclusões
Os resultados obtidos no presente trabalho permitiram concluir que a extração de pectina da casca (albedo e flavedo) de maracujá via emprego de banho ultrassônico apresentou um rendimento máximo de 15,32% após a otimização das variáveis de temperatura (30°C), razão casca/solvente (1:20), potência do equipamento (200 W) e tempo de extração (120 min). Também foi observado que o emprego da casca de maracujá como matriz de extração propiciou um aumento no rendimento ao considerar o mesmo método, o que era esperado em virtude do maior teor de polissacarídeos presentes nos resíduos dessa fruta. Entretanto, o método empregado não apresentou rendimentos superiores aos descritos na literatura para o método hidrotérmico que é convencionalmente empregado. Vale salientar, porém, que ao ser empregado o método ultrassônico, foi possível utilizar temperaturas e quantidades de solvente menores, o que reafirma o caráter mais sustentável do método. No tocante à caracterização, foi feita sua análise de FT-IR, através da qual foi possível confirmar a existência de bandas características da pectina no material extraído, confirmando a eficiência do processo empregado em separar esse polissacarídeo. Por fim, também foi determinado seu grau de esterificação, sendo obtido um valor de 34,13%, o qual caracteriza a pectina produzida como pectina com baixo teor de metoxila. Assim, pode-se afirmar que o material obtido pode ser testado como coagulante/floculante em tratamentos de águas residuárias.
Agradecimentos
FADE/UFPE, FACEPE (APQ 0947-3.06/22).
Referências
ADETUNJI, L. R.; ADEKUNLE, A.; ORSAT, V.; RAGHAVAN, V. Advances in the pectin production process using novel extraction techniques: A review. Food Hydrocolloids, v. 62, p. 239-250, 2017.
ASGARI, K.; LABBAFI, M.; KHODAIYAN, F.; KAZEMI, M.; HOSSEINI, S. S. High-methylated pectin from walnut processing wastes as a potential resource: Ultrasound assisted extraction and physicochemical, structural and functional analysis. International journal of biological macromolecules, v. 152, p. 1274-1282, 2020.
BENASSI, L.; ALESSANDRI, I.; VASSALINI, I. Assessing green methods for pectin extraction from waste orange peels. Molecules, v. 26, n. 6, p. 1766, 2021.
CHEN, J.; CHENG, H.; ZHI, Z.; ZHANG, H.; LINHARDT, R. J.; ZHANG, F.; YE, X. Extraction temperature is a decisive factor for the properties of pectin. Food Hydrocolloids, v. 112, p. 106160, 2021.
DAO, T. A. T.; WEBB, H. K.; MALHERBE, F. Optimization of pectin extraction from fruit peels by response surface method: Conventional versus microwave-assisted heating. Food Hydrocolloids, v. 113, p. 106475, 2021.
DEMIR, D.; CEYLAN, S.; GÖKTÜRK, D.; BÖLGEN, N. Extraction of pectin from albedo of lemon peels for preparation of tissue engineering scaffolds. Polymer Bulletin, v. 78, n. 4, p. 2211-2226, 2021.
DRANCA, F.; VARGAS, M.; OROIAN, M. Physicochemical properties of pectin from Malus domestica ‘Fălticeni’apple pomace as affected by non-conventional extraction techniques. Food Hydrocolloids, v. 100, p. 105383, 2020.
FAKAYODE, O. A.; ABOBI, K. E. Optimization of oil and pectin extraction from orange (Citrus sinensis) peels: a response surface approach. Journal of Analytical Science and Technology, v. 9, n. 1, p. 1-16, 2018.
FREITAS, C. M. P.; SOUSA, R. C. S.; DIAS, M. M. S.; COIMBRA, J. S. R. Extraction of pectin from passion fruit peel. Food Engineering Reviews, v. 12, n. 4, p. 460-472, 2020.
HOSSEINI, S. S.; KHODAIYAN, F.; KAZEMI, M.; NAJARI, Z. Optimization and characterization of pectin extracted from sour orange peel by ultrasound assisted method. International journal of biological macromolecules, v. 125, p. 621-629, 2019.
KE, J.; JIANG, G.; SHEN, G.; WU, H; LIU, Y; ZHANG, Z. Optimization, characterization and rheological behavior study of pectin extracted from chayote (Sechium edule) using ultrasound assisted method. International journal of biological macromolecules, v. 147, p. 688-698, 2020.
KUMAR, M.; TOMAR, M.; SAURABH, V.; MAHAJAN, T.; PUNIA, S.; DEL MAR CONTRERAS, M.; KENNEDY, J. F. Emerging trends in pectin extraction and its anti-microbial functionalization using natural bioactives for application in food packaging. Trends in Food Science & Technology, v. 105, p. 223-237, 2020.
MAO, G.; WU, D.; WEI, C.; TAO, W.; YE, X.; LINHARDT, R. J.; CHEN, S. Reconsidering conventional and innovative methods for pectin extraction from fruit and vegetable waste: Targeting rhamnogalacturonan I. Trends in Food Science & Technology, v. 94, p. 65-78, 2019.
MAO, Y.; MILLETT, R.; LEE, C. S.; YAKUBOV, G.; HARDING, S. E.; BINNER, E. Investigating the influence of pectin content and structure on its functionality in bio-flocculant extracted from okra. Carbohydrate polymers, v. 241, p. 116414, 2020.
MARENDA, F. R. B.; MATTIODA, F.; DEMIATE, I. M.; DE FRANCISCO, A.; DE OLIVEIRA PETKOWICZ, C. L.; CANTERI, M. H. G; DE MELLO CASTANHO AMBONI, R. D. Advances in studies using vegetable wastes to obtain pectic substances: A review. Journal of Polymers and the Environment, v. 27, n. 3, p. 549-560, 2019.
MARIĆ, M.; GRASSINO, A. N.; ZHU, Z.; BARBA, F. J.; BRNČIĆ, M.; BRNČIĆ, S. R. An overview of the traditional and innovative approaches for pectin extraction from plant food wastes and by-products: Ultrasound-, microwaves-, and enzyme-assisted extraction. Trends in Food Science & Technology, v. 76, p. 28-37, 2018.
MELLINAS, C.; RAMOS, M.; JIMÉNEZ, A.; GARRIGÓS, M. C. Recent trends in the use of pectin from agro-waste residues as a natural-based biopolymer for food packaging applications. Materials, v. 13, n. 3, p. 673, 2020.
MOGHADDAM, M. J.; SHADDEL, R.; PEIGHAMBARDOUST, S. H. Sugar beet pectin extracted by ultrasound or conventional heating: A comparison. Journal of Food Science and Technology, v. 58, n. 7, p. 2567-2578, 2021.
OLIVEIRA, C. F.; GIORDANI, D.; LUTCKEMIER, R.; GURAK, P. D.; CLADERA-OLIVERA, F.; MARCZAK, L. D. F. Extraction of pectin from passion fruit peel assisted by ultrasound. LWT-Food Science and Technology, v. 71, p. 110-115, 2016.
PATIENCE, N. A.; SCHIEPPATI, D.; BOFFITO, D. C. Continuous and pulsed ultrasound pectin extraction from navel orange peels. Ultrasonics Sonochemistry, v. 73, p. 105480, 2021.
SABATER, C.; SABATER, V.; OLANO, A.; MONTILLA, A.; CORZO, N. Ultrasound-assisted extraction of pectin from artichoke by-products. An artificial neural network approach to pectin characterisation. Food Hydrocolloids, v. 98, p. 105238, 2020.
SANTOS, E. E.; AMARO, R. C.; BUSTAMANTE, C. C. C.; GUERRA, M. H. A.; SOARES, L. C.; FROES, R. E. S. Extraction of pectin from agroindustrial residue with an ecofriendly solvent: Use of FTIR and chemometrics to differentiate pectins according to degree of methyl esterification. Food Hydrocolloids, v. 107, p. 105921, 2020.
SENGAR, A. S.; RAWSON, A.; MUTHIAH, M.; KALAKANDAN, S. K. Comparison of different ultrasound assisted extraction techniques for pectin from tomato processing waste. Ultrasonics Sonochemistry, v. 61, p. 104812, 2020.
SIN, L. K.; YHAYA, M. F. B.; TALEBI, A.; ISMAIL, N. Synthesis, characterisation and application of quaternised pectin as flocculant in wastewater treatment. International Journal of Environmental Engineering, v. 10, n. 3, p. 243-262, 2020.
ZOGHI, A.; VEDADI, S.; ESFAHANI, Z. H.; GAVLIGHI, H. A.; KHOSRAVI-DARANI, K. A review on pectin extraction methods using lignocellulosic wastes. Biomass Conversion and Biorefinery, p. 1-13, 2021.
















