ÁREA
Química Ambiental
Autores
Silva, E.C. (UFRN) ; Borges, V.F.S. (UFRN) ; Oliveira, K.C. (UFRN) ; Braga, T.P. (UFRN) ; Fonseca, J.L.C. (UFRN) ; Castro Dantas, T.N. (UFRN) ; Silva, D.C. (UFRN) ; Azevedo, P.H.A. (UFRN) ; Wanderley Neto, A.O. (UFRN)
RESUMO
Os ambientes aquáticos podem ser contaminados por vários íons metálicos. Para a captação desses íons a indústria utiliza diversos adsorventes naturais ou tratados quimicamente. este trabalho teve como objetivo tratar a diatomita com uma solução micelar e sistemas de microemulsão, formulados com UNITOL L-90, n-butanol, querosene e água destilada. A diatomita tratada com solução micelar não proporcionou melhora significativa na eficiência de remoção, chegando a 62% para Fe3+, 58% para Pb2+ e 47% para Cr6+. Enquanto a diatomita tratada com microemulsão teve um aumento substancial no percentual de captura chegando a 99% de Fe3+, 65% para Pb2+ e 66% para Cr6+.
Palavras Chaves
Adsorção ; Diatomita ; Microemulsão
Introdução
O desenvolvimento industrial e o surgimento de novas tecnologias ocorridos nas últimas décadas fizeram com que a sociedade começasse a se preocupar com os problemas causados ao meio ambiente (KARAPINAR; DONAT, 2009). Os efluentes industriais de natureza inorgânica, contendo metais pesados, tais como chumbo, ferro e cromo são um dos mais sérios problemas de poluição ambiental (AL-QODAH, 2000; BOUALIA et al., 1993; RAFATULLAH et al., 2009). Desta forma, representam uma fonte potencial de contaminação aos consumidores primários (zooplâncton e peixes herbívoros), continuando o processo de contaminação aos carnívoros primários e os de topo de cadeia, o que evidencia o processo de biomagnificação, desde que os últimos níveis apresentem concentrações de metais maiores que as dos níveis inferiores (ALI; GUPTA, 2007; SINGH; GUPTA; GUPTA, 2007). As principais fontes de poluição contendo os metais pesados Fe3+, Pb2+ e Cr6+ são encontradas nas indústrias, mineração, pesticidas usados na agricultura e esgoto doméstico, que precisam ser tratados para evitar graves problemas ambientais (SINGH; GUPTA; GUPTA, 2007). A contaminação da água por metais pesados é um problema global, ao qual torna-se necessária uma solução simples e econômica (LENDE, 2016; RAFATULLAH et al., 2009). Portanto, a remoção de íons metálicos tóxicos das águas residuais é uma questão de grande importância. Muitos processos de tratamento de efluentes são estudados tais como a precipitação química, oxidação, eletrólise, filtração por membrana, permuta iônica, coagulação, adsorção entre outros. Dentre estas tecnologias, a adsorção vem despertando como técnica bastante eficaz para o tratamento e descarte de resíduos metálicos (AL-QODAH, 2000; ALI; GUPTA, 2007). Além disso, do ponto de vista ambiental, o adsorvente pode ser recuperado usando técnicas de regeneração e reutilizado sucessivamente no processo (CRINI, 2006). Vários estudos têm demonstrado a viabilidade da utilização de processos de adsorção para a remoção de metais tóxicos de resíduos industriais, por exemplo, o uso de diatomitas e bentonitas para a adsorção de cromo trivalente a partir de soluções aquosas foi relatado (RUTHVEN, 1984). Outros materiais naturais conhecidos como perlita e zeólita têm sido investigados na captura de metais pesados (LENDE, 2016). Através da escolha do adsorvente apropriado, sob condições ótimas de operação, pode-se tornar o processo bastante efetivo e de baixo custo. Porém, os fatores relevantes à seleção de adsorventes alternativos incluem: disponibilidade; alta capacidade de adsorção; baixo custo; reutilização e fácil descarte (CASTRO DANTAS et al., 2001). O presente trabalho visa desenvolver uma microemulsão à base de tensoativo não iônico Unitol L90, n-butanol, querosene e água destilada na superfície da diatomita e sua utilização para remoção dos íons Fe3+, Pb2+ e Cr6+ de solução aquosa. Esses íons metálicos foram utilizados em nosso experimento por serem os principais contaminantes dos ecossistemas aquáticos locais, principalmente relacionados às atividades de mineração (CASTRO DANTAS et al., 2001).
Material e métodos
A diatomita utilizada foi obtida na sua forma bruta, calcinada a 850 °C e triturada em moinhos de martelo. É procedente do município de Maxaranguape, Rio Grande do Norte, Brasil. A preparação das soluções aquosas dos íons Fe3+, Pb2+ e Cr6+ (na forma de Cr2O72-) na concentração de 10 mg/L se deu a partir dos sais cloreto de ferro III Hexahidratado (FeCl3.6 H2O), nitrato de chumbo II (Pb(NO3)2) e dicromato de potássio (K2Cr2O7); todos de grau analítico e da marca Synth. A região de microemulsão no diagrama pseudoternário foi determinada através de titulação mássicas (CASTRO DANTAS et al., 2001). Uma balança analítica digital (modelo 240A, da Precisa), centrífuga (modelo Q-222T28, da Quimis) e agitador magnético (modelo 752, da Fisatom) foram utilizados nesse procedimento. As substâncias químicas utilizadas foram álcool laurílico 9 EO (fornecido pela Oxiteno, Brazil) como tensoativo; n-butanol (99,4% P.A. marca Vetec) como cotensoativo; querosene (fornecida pela Líder distribuidora, Brasil) como fase oleosa e água destilada como fase aquosa; mantendo uma razão cotensoativo/tensoativo igual a 0,5. Foram adicionados 1,0 g do adsorvente a 100,0 mL de solução aquosa do íon (Fe3+, Pb2+ e Cr2O72-) com concentração de 10 mg/L. O pH das soluções foram ajustados em 3,6 (para Fe3+ e Pb2+) e 4,0 (para Cr2O7 2-). O sistema foi mantido por 2 horas 60°C sob agitação mecânica. Após este procedimento, a suspensão foi filtrada e, em seguida, os íons metálicos residuais em solução aquosa foram determinados usando a espectrofotometria de absorção atômica com chama de ar-acetileno. Os comprimentos de onda de absorção foram 372 nm para o Fe3+, 283,3 nm para Pb2+ e 425,4 nm para o Cr2O72-. A quantidade de íon metálico adsorvido foi calculada a partir da diferença das concentrações de metais em solução aquosa antes e após o equilíbrio de adsorção de acordo com a equação 1. Sendo q é a massa de íon metálico adsorvido por massa de adsorvente no equilíbrio (mg/g), Ci é a concentração inicial de íons em solução (mg/L), Cf é a concentração de íons em solução no equilíbrio (mg/L), V é o volume da solução (L) e W é a massa do adsorvente (g). A percentagem de adsorção (%) foi calculada usando a equação 2. Onde Ci e Cf são as concentrações das soluções iniciais e finais dos íons metálicos, respectivamente. Os ensaios de adsorção foram realizados em duplicatas e o erro foi de ±5%.
Resultado e discussão
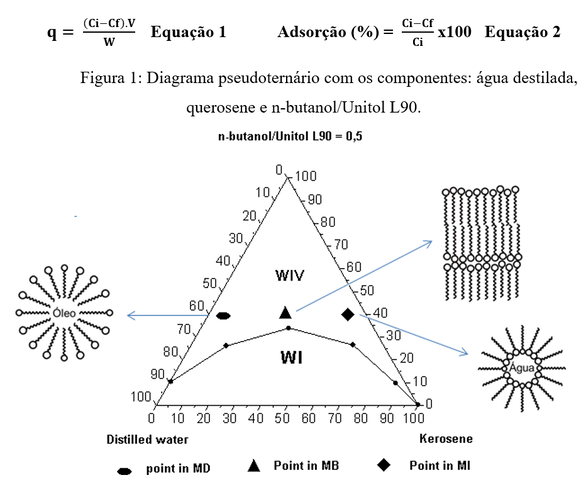
A Figura 1 mostra a construção do diagrama de fase pseudoternário com a sua área
de microemulsão. Dentro desta área foram escolhidas três formulações: micela
direta (MD), micela inversa (MI) e micela bicontínua (MB), para serem usadas no
tratamento dos adsorventes naturais e, posteriormente, serem utilizados na
captura dos ions Fe3+, Pb2+ e Cr6+ (na forma de
Cr2O72-) presentes nas suas soluções
sintéticas.
O diagrama pseudoternário apresenta uma região de microemulsão (WIV)
satisfatória, o que possibilitou a escolha de três formulações (micela direta,
micela bicontínua e micela inversa) para tratar os materiais naturais: bentonita
sódica, bentonita in-natura e diatomita. As formulações se destacaram por
apresentar percentual de cotensoativo/tensoativo a baixo de 50%, situação
favorável por gastar menos matéria ativa (tensoativo).
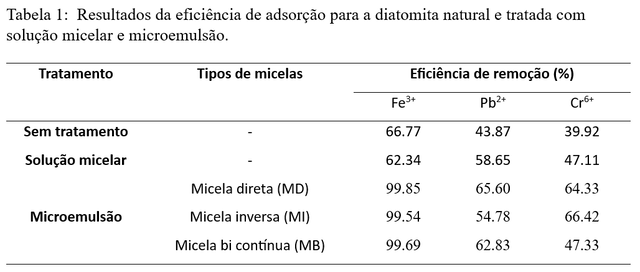
A Tabela 1 apresenta os percentuais de remoção dos cátions Fe3+,
Pb2+ e Cr6+ presentes nas soluções sintéticas a partir da
adição da diatomita natural, tratada com solução de tensoativo e tratada com
microemulsão.
A Tabela 1 mostra que a diatomita na forma natural captura os íons Fe3+
, Pb2+ e Cr6+, com mais eficiência para o íon ferro
quando comparado aos íons chumbo e crômio. Este comportamento se deve ao maior
número de oxidação do íon ferro, que proporciona maior atração deste cátion
pelos grupos silanóis e hidroxilas presentes na superfície da diatomita.
Enquanto os íons chumbo e cromo são menos atraídos devido, possivelmente, ao
menor número de oxidação do chumbo e do cromo, que estar na forma de dicromato
(Cr2O72-).
Os resultados apresentados na Tabela 1 mostram que o processo de impregnação do
tensoativo na superfície da diatomita via solução micelar não é eficiente, pois
não houve alteração significativa nos percentuais de remoção dos íons, mostrando
que esse tipo de tratamento da diatomita não interfere positivamente na captura
dos cátions presentes na solução sintética.
Conforme observado na Tabela 1, a diatomita tratada com as microemulsões
apresentam valores de eficiência de remoção dos íons metálicos bem expressivos,
chegando a atingir valores de 99%. Esses resultados mostram que a impregnação do
tensoativo sobre a superfície da diatomita acontece de maneira eficiente quando
se utiliza a microemulsão, mostrando que esses tipos de micelas são excelentes
no tratamento do adsorvente.
Estes resultados mostram que a impregnação do surfactante na superfície da
diatomita ocorre de forma eficiente quando a microemulsão é utilizada, mostrando
que estes tipos de micelas são excelentes no tratamento do adsorvente. De fato,
o grupo silano é muito ativo e pode interagir com compostos orgânicos polares,
grupos funcionais e íons. Este grupo desempenha um papel importante na interação
entre os íons metálicos e a diatomita natural. Além disso, a presença de grupos
etoxilados e hidroxila no surfactante, oriundos da microemulsão, é fundamental
para aumentar a capacidade de adsorção de íons, uma vez que esses grupos possuem
alta interação com cátions metálicos.
Após o processo de impregnação, as micelas direta e bicamada foram adsorvidas na
superfície da diatomita devido às ligações de hidrogênio entre os grupos
etoxilados presentes na cabeça do surfactante com os grupos silano e hidroxila
da diatomita. Por outro lado, as micelas inversas foram adsorvidas na superfície
da diatomita via interação dipolo entre os hidrocarbonetos presentes na cauda do
tensoativo com os grupos funcionais da diatomita.
Além disso, é importante mencionar que após o processo de secagem é possível que
as micelas adsorvidas na diatomita tenham alterado suas conformações estruturais
devido à evaporação de água, butanol e querosene. As perdas de querosene e
butanol são essenciais para evitar a contaminação do efluente com essas
substâncias tóxicas.
Conclusões
A diatomita tratada com solução micelar do tensoativo Unitol L90 não altera significativamente o poder de captura dos íons ferro, chumbo e cromo quando comparado a diatomita natural. Já o uso de uma microemulsão com o mesmo tensoativo resulta em um aumento significativo do percentual de remoção dos íons. Este sistema foi mais eficaz na remoção de ferro, com quase 100% de eficiência, enquanto o chumbo e cromo atingiram 65% de eficiência. Os diferentes tipos de micela (direta e inversa) não apresentaram diferentes resultados de eficiências, indicando que o processo de secagem da diatomita tratada resulta na reorganização dos tensoativos na forma de camada bicontínua. Os grupos etoxilados presentes na diatomita modificada foram os principais sítios de adsorção dos cátions metálicos.
Agradecimentos
Ao LTT/IQ/UFRN, Instituto de Química, a UFRN, ao PPGEQ, ao PPGQ e a Capes.
Referências
AL-QODAH, Z. Adsorption of dyes using shale oil ash. Water Research, v. 34, n. 17, p. 4295–4303, 2000.
ALI, I.; GUPTA, V. K. Advances in water treatment by adsorption technology. Nature Protocols, v. 1, n. 6, p. 2661–2667, 2007.
BOUALIA, A. et al. Adsorption of organic matter contained in industrial H3PO4 onto bentonite: batch-contact time and kinetic study. Applied Clay Science, v. 7, n. 6, p. 431–445, 1993.
CRINI, G. Non-conventional low-cost adsorbents for dye removal: A review. Bioresource Technology, v. 97, n. 9, p. 1061–1085, 2006.
CASTRO DANTAS, T.N.; DANTAS NETO, A.A. e MOURA, M.C.P.A. Removal of chromium from aqueous solutions by diatomite treated with microemulion. Water Research, v.35, n.9, p.2219-224, 2001.
KARAPINAR, N.; DONAT, R. Adsorption behaviour of Cu2+ and Cd2+ onto natural bentonite. Desalination, v. 249, n. 1, p. 123–129, 2009.
LENDE, A. B. Improvement in removal of Pb(II) using surfactant emulsion membrane from PCB wastewater by addition of NaCl. Journal of Water Process Engineering, v. 11, p. 55–59, 2016.
RAFATULLAH, M. et al. Adsorption of copper (II), chromium (III), nickel (II) and lead (II) ions from aqueous solutions by meranti sawdust. Journal of Hazardous Materials, v. 170, n. 2–3, p. 969–977, 2009.
RUTHVEN, D. M. Principles of adsorption and adsorption process. United States of America: Wiley-Interscience, 1984.
SINGH, A. K.; GUPTA, V. K.; GUPTA, B. Chromium(III) selective membrane sensors based on Schiff bases as chelating ionophores. Analytica Chimica Acta, v. 585, n. 1, p. 171–178, 2007.
















