ÁREA
Química Ambiental
Autores
Silva, F.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Santana, I.L.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Cavalcanti, V.O.M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Silva, M.G. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Santos, A.M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Silva, M.N.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Oliveira, M.A.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Cavalcanti, J.V.F.L. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Honorato, F.A. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Napoleão, D.C. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
RESUMO
O consumo de medicamentos antirretrovirais tem crescido no mundo, aproximadamente 26 milhões de pessoas recebem diariamente terapia com estes fármacos. No entanto, o teor ingerido não é totalmente metabolizado, aumentando assim a detecção desses fármacos em matrizes aquáticas, sendo necessário a adoção de metodologias capazes de identificar esses poluentes de forma precisa, exata e confiável. Assim, foi elaborado um método para identificação e quantificação da mistura dos fármacos zidovudina e lamivudina utilizando cromatografia líquida de alta eficiência utilizando as diretrizes descritas pela ANVISA a partir dos parâmetros de linearidade, precisão, exatidão e limites de detecção e quantificação. A determinação destes parâmetros permitiu a validação do método.
Palavras Chaves
Lamivudina; Método Analítico; Zidovudina
Introdução
Os fármacos antirretrovirais (ARV) são medicamentos que tratam infecções por retrovírus, sobretudo, o vírus da imunodeficiência humana tipo 1 (HIV) (Eryildiz; Gul; Koyuncu, 2022). O HIV é identificado, inicialmente, por uma fase assintomática que pode se prolongar por anos, no entanto, pode evoluir para uma fase crônica se manifestando em forma de síndrome da imunodeficiência adquirida (AIDS) (Shekatkar et al. 2021). Estima-se que até 2019 cerca de 32,7 milhões de pessoas morreram com doenças relacionadas à AIDS e cerca de 26 milhões receberam terapia antirretroviral até final de 2020 (Serag et al. 2022). A zidovudina (ZDV) foi um dos primeiros medicamentos com eficácia comprovada para tratamento do HIV, sendo ainda um dos mais utilizados (Russo et al. 2018). A ZDV tem a capacidade de reduzir a replicação do HIV e restaurar o sistema imunológico, podendo prevenir a transmissão do vírus de mãe para filho durante o parto (Nglirabanga; Aucamp; Samsodien, 2021). Atualmente, o tratamento utilizando a ZDV é feito de maneira combinada de dois ou mais medicamentos, tendo em vista a aumento dos resultados (Nannou et al. 2020). Podendo destacar a lamivudina (3TC), que semelhante a ZDV, inibe a replicação do vírus HIV (Shahabadi et al. 2018). Todavia esses fármacos não são facilmente metabolizados, podendo ser excretado pela urina até 70% do teor ingerido (Omotola et al. 2021). Portanto, se faz necessária a detecção desses poluentes, e em consequência da complexidade da amostra é indispensável a utilização de métodos analíticos adequados para determinação destes compostos (Nannou et al. 2020). A cromatografia líquida de alta eficiência (CLAE) é o método predominante para análise de compostos farmacêuticos, por ser adequado para detecção de inúmeros analitos de maneira simultânea e de alta resolução (Chew; Khor; Lim, 2021). Desse modo, é importante a etapa de validação analítica, por se tratar de uma ferramenta protocolada, formal e ordenada que tem a capacidade de fornecer uma metodologia confiável, precisa e reprodutível (Marson et al. 2020). Diante do exposto, o objetivo do presente estudo foi promover a validação da metodologia para identificação e quantificação da mistura dos fármacos lamivudina e zidovudina, em matriz aquosa, utilizando a técnica de cromatografia líquida de alta eficiência empregando as diretrizes descritas pela Agência Nacional de Vigilância Sanitária (ANVISA).
Material e métodos
Para este trabalho foram utilizados os fármacos lamivudina (Lote: 17933) e zidovudina (Lote: 17925), concedidos pelo Laboratório Farmacêutico do Estado de Pernambuco (LAFEPE). Em seguida, os fármacos foram dissolvidos em água ultrapura (Milliq) e metanol (Merck) em razão volumétrica de 9:1, posteriormente, ocorreu a diluição com água destilada para uma concentração de 15 mg∙L-1. As análises foram realizadas por meio de cromatografia líquida de alta eficiência com detector de UV/Vis, utilizando um cromatógrafo (Shimadzu, modelo SPD 6A), operando em fase reversa, equipado com uma coluna ULTRA C18 (5 μm; 4,6 x 250 mm). Foi utilizada uma fase móvel composta por acetonitrila e água ultrapura (65:35 v/v), com o tempo de corrida de 11 min e fluxo de 1,0 mL∙min-1. Inicialmente para detecção dos fármacos, foram analisados dois comprimentos de onda, 254 e 277 nm, baseado nos trabalhos de Lucena et al. (2022) e Vaikosen et al. (2020). Em seguida, foram construídas oito curvas analíticas de 1, 2, 3, 5, 7, 9, 12, 15 e 20 mg∙L-1. Afim de verificar a confiabilidade do método empregado, foram determinados os parâmetros de limites de quantificação (LQ) e detecção (LD), linearidade, precisão e exatidão, com base nas diretrizes descritas na Resolução da diretoria colegiado (RDC) n.166 de 2017, da Agência Nacional de Vigilância Sanitária (ANVISA, 2017). As equações utilizadas para cada parâmetro estão apresentadas na Figura 1. Figura 1 – Cálculos dos parâmetros de validação conforme ANVISA (2017). Conforme observa-se na Figura 1, a linearidade foi obtida por meio da análise estatística empregando o Teste de Grubbs (Grubbs e Beck, 1972), com intervalo de confiança de 95%. Segundo a ANVISA (2017), este parâmetro pode ser também determinado, mediante o coeficiente de correlação (r), sendo este maior que 0,99. A precisão pode ser determinada pelo coeficiente de variação (CV), expresso em %. Neste estudo foram utilizadas condições de reprodutibilidade com oito repetições independentes. Por fim, a exatidão foi obtida com base em três níveis de concentração e considerando três regiões diferentes da curva analítica.
Resultado e discussão
Inicialmente, foi realizado a testagem dos fármacos de maneira individual e em
mistura no CLAE em dois comprimentos de onda, 254 e 277 nm. Em seguida, foram
construídas as curvas analíticas na faixa de 1 a 20 mg∙L-1. Os
cromatogramas obtidos e a curva analítica para os fármacos em estudo estão
apresentados na Figura 2.
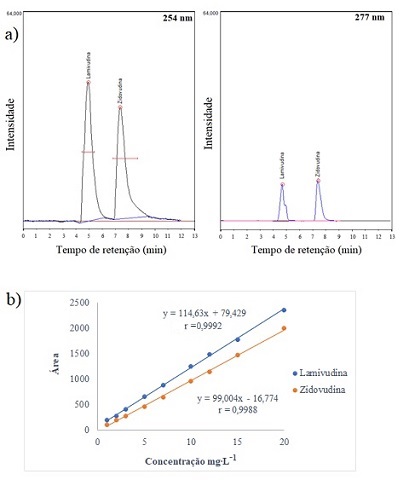
Figura 2 – a) Cromatograma para mistura dos fármacos lamivudina e zidovudina nos
λ = 254 nm e 277 nm. b) Curva analítica para os fármacos lamivudina e
zidovudina.
A Figura 2a) mostra que nos λ testados houve uma boa separação dos picos,
indicando que o metodo escolhido foi seletivo. No entanto, para o λ de 277 nm
apresentou um sinal analitico inferior quando comparado ao λ de 254 nm.
Portanto, sendo este último o adotado, nele nota-se a lamivudina foi
identificada em uma faixa de tempo de retenção de 4,9 a 5,1 min e a zidovudina
entre 7,8 e 8,0 min.
Concluindo a construção das curvas analíticas, seguiu-se para a etapa de
validação da metodologia. A partir das Equações 1 e 2 foram determinados os
limites de quantificação e detecção iguais a 0,36 mg∙L-1 e 0,11
mg∙L-1 para zidovudina, 0,53 mg∙L-1 e 0,17
mg∙L-1 para lamivudina. Na Figura 2b) nota-se que o coeficiente de
correlação (r) foi superior ao critério exigido pela ANVISA (2017), em que foram
obtidos 0,999 para lamivudina e 0,998 para zidovudina. Pelo teste de Grubbs,
para oito repetições no intervalo de confiança de 95% os valores devem ser
inferiores a 2,13, os valores de G< e G> foram inferiores ao tabelado, dessa
forma apontando a linearidade da metodologia aplicada.
A precisão foi calculada pela Equação (5), o CV obtido para lamivudina variou
entre 3,63 e 8,06 % e zidovudina 2,37 e 10,21%, segundo Gad (2007), o valor
máximo aceitável para compostos farmacêuticos é de 20%, sendo os valores
encontrados inferiores a esse estudo. A exatidão calculada para os três níveis
de concentração (ensaios em triplicatas), para lamivudina o resultado encontrado
da recuperação foi de 109,33%, 106,53% e 103,60% para cada nível de concentração
e para zidovudina foi 108,67%, 104,67% e 98,96%. Todos os valores para exatidão
obtidos estão dentro do critério estabelecido pela ANVISA (2017). Dessa forma,
conforme mostra os valores encontrados para cada parâmetro a metodologia é
precisa, reprodutível e confiável.

Cálculos dos parâmetros de validação conforme ANVISA \r\n(2017).
a) Cromatograma para mistura dos fármacos lamivudina \r\ne zidovudina nos λ = 254 nm e 277 nm. b) Curva \r\nanalítica para os fármacos lamivudina e zidovudina
Conclusões
Diante do exposto, o presente trabalho consistiu no desenvolvimento de uma metodologia para quantificação de fármacos antirretrovirais como lamivudina e zidovudina. A técnica analítica empregada para detecção dos compostos orgânicos foi a cromatografia líquida de alta eficiência, sendo a etapa de validação essencial para assegurar uma execução confiável, adequada, precisa e exata do método proposto. Esta foi comprovada por meio dos resultados obtidos a partir dos parâmetros: linearidade, precisão, exatidão e limites de detecção e quantificação, com todos atendendo os padrões e limites estabelecidos pela ANVISA.
Agradecimentos
À Fundação de Amparo à Ciência e Tecnologia de PE (FACEPE) pela concessão de bolsa, Conselho Nacional de Desenvolvimento Científico e Tecnologia (CNPq), FACEPE APQ 0947-3.06/22, FADE/UFPE e ao LAFEPE.
Referências
BRASIL, Ministério da Saúde. Resolução RDC n° 166, de 24 de julho de 2017. Agência Nacional de Vigilância Sanitária – (ANVISA). Brasília, DF, 2017.
CHEW, Y. L.; KHOR, M. A.; LIM, Y. Y. Choices of chromatographic methods as stability indicating assays for pharmaceutical products: A review. Heliyon, v. 7, n. 3, p. e06553, 2021.
ERYILDIZ, B.; GUL, B. Y.; K OYUNCU, I. A sustainable approach for the removal methods and analytical determination methods of antiviral drugs from water/wastewater: A review. Journal of Water Process Engineering, v. 49, p. 103036, 2022.
GAD, S. C.; Handbook of Pharmaceutical Biotechnology. Wiley-Interscience. 1ª Ed. 2007.
GRUBBS, F. E.; BECK, G. Extension of samples sizes and percentage points for significance tests of outlying observations. Technometrics. v. 14, n. 4, p. 847-854, 1972.
LUCENA, A. L. A.; SANTANA, R. M. R.; OLIVEIRA, M. A. S.; ALMEIDA, L. C.; DUARTE, M. M. M. B.; NAPOLEÃO, D. C. Evaluation of combined radiation for the treatment of lamivudine and zidovudine via AOP. Chemical Industry & Chemical Engineering Quartely, v. 28, n. 3, p. 179-190, 2022.
MARSON, B. M.; CONCENTINO, V.; JUNKERFACHI, M. M.; VILHENA, R. O.; PONTAROLO, R. Validation of analytical methods in a pharmaceutical quality system: an overview focused on HPLC methods. Quím. Nova, v. 43, n.8, p.1190-1203, 2020.
NANNOU, C.; OFRYDOPOULOU, A.; EVGENIDOU, E.; HEATH, D.; HEATH, E.; LAMBROPOULOU, D. Antiviral drugs in aquatic environment and wastewater treatment plants: A review on occurrence, fate, removal and ecotoxicity. Science of the Total Environment, v. 699, p. 134322, 2020.
NGILIRABANGA, J. B.; AUCAMP, M.; SAMSODIEN, H. Mechanochemical synthesis and characterization of Zidovudine-lamivudine solid dispersion (binary eutectic mixture). Journal of Drug Delivery Science and Technology, v. 64, p. 102639, 2021.
OMOTOLA, E. O.; GENTHE, B.; NDLELA, L.; OLATUNJI, O. S. Environmental risk characterization of an antiretroviral (Arv) lamivudine in ecosystems. International Journal of Environmental Research and Public Health, v. 18, n. 16, 2021.
RUSSO, D.; SICILIANO, A.; GUIDA, M.; ANDREOZZI, R.; REIS, N. M.; LI PUMA, G.; MAROTTA, R. Removal of antiretroviral drugs stavudine and zidovudine in water under UV254 and UV254/H2O2 processes: Quantum yields, kinetics and ecotoxicology assessment. Journal of Hazardous Materials, v. 349, p. 195–204, 2018.
SERAG, A.; HASAN, M. A.; TOLBA, E. H.; ABDELZAHER, A. M.; ELMAATY, A. A. Analysis of the ternary antiretroviral therapy dolutegravir, lamivudine and abacavir using UV spectrophotometry and chemometric tools. Spectrochimica Acta - Part A: Molecular and Biomolecular Spectroscopy, v. 264, p. 120334, 2022.
SHAHABADI, N.; KHORSHIDI, A.; ZHALEH, H.; KASHANIAN, S. Synthesis, characterization, cytotoxicity and DNA binding studies of Fe3O4@SiO2 nanoparticles coated by an antiviral drug lamivudine. Journal of Drug Delivery Science and Technology, v. 46, p. 55–65, 2018.
SHEKATKAR, M.; KHEUR, S.; GUPTA, A. A.; ARORA, A.; RAJ, A. T.; PATIL, S.; KHAN, S. S.; DESAI, A.; CARROLL, W. B.; AWAN, K. H. Oral candidiasis in human immunodeficiency virus-infected patients under highly active antiretroviral therapy. Disease-a-Month, v. 67, n. 9, p. 101169, 2021.
VAIKOSEN, E. N.; KASHIMAWO, A. J.; SOYINKA, J. O.; ORUBU, S.; ELEI, S.; EBESHI, B. U. Simple thin layer chromatography–ultraviolet spectrophotometric method for quality assessment of binary fixed-dose-combinations of lamivudine/tenofovir disoproxil fumarate and lamivudine/zidovudine in tablet formulations. Journal of Separation Science, v. 43, n. 11, p. 2228–2239, 2020.
















