ÁREA
Química Ambiental
Autores
Leandro Andrade de Lucena, A. (UFPE) ; Santos da Cruz Santana Neves, N. (UFPE) ; Larissa da Silva Santana, I. (UFPE) ; Magali da Rocha Santana, R. (UFPE) ; Paiva Ourem, G. (UFPE) ; Carla Napoleão, D. (UFPE)
RESUMO
Diante da pouca eficiência apresentada pelos sistemas convencionais de tratamentos em degradar contaminantes farmacêuticos, a aplicação de tecnologias mais efetivas como os processos oxidativos avançados eletroquímicos (POAE) se fazem necessárias. Desta forma este trabalho visou promover a degradação dos fármacos paracetamol e propranolol utilizando o POAE oxidação anódica. Os testes utilizaram 3 arranjos de eletrodos cátodo-ânodo (Gr-Gr); (Gr-Cu) e (Cu-Cu), em conjunto com 4 tipos de eletrólitos, NaCl, KCl, sulfato de sódio e sulfato ferroso heptahidratado. Após os ensaios verificou-se que os arranjos cátodo-ânodo/eletrólitos que apresentaram as maiores eficiências foram Gr-Cu/NaCl e Gr-Gr-Gr/KCl, com degradações maiores que 49% para o propranolol e 88% para o paracetamol após 60 min.
Palavras Chaves
Oxidação Anódica; Propranolol; Paracetamol
Introdução
Os produtos farmacêuticos são compostos biologicamente ativos que têm por objetivo gerar efeitos específicos nos organismos, auxiliando no diagnóstico e cura de doenças, bem como no controle e alívio de sintomas (BOXALL; KOOKANA, 2018; WENNMALN, 2019; BRANCHET et al. 2021). Após a sua utilização e excreção, estes compostos seguem pelas redes de coleta de esgoto até as estações de tratamento de efluentes (ETE), cujos tratamentos físico-químicos e biológicos convencionais são pouco eficientes para completa degradação destes poluentes (CHOWDHURY et al. 2020; ROSI et al. 2022). Ao sair das ETE sem o devido tratamento e atingir as matrizes aquáticas, os compostos farmacêuticos geram riscos ao meio ambiente e eventualmente à saúde da população (KLATTE; SCHAEFER; HEMPEL., 2017; MAHJOUB; CHMENGUI, 2021; SERVIEN et al. 2022). Dentre os efeitos adversos que estes compostos podem causar, estão alterações nos crescimentos de algas e fitoplâncton; mudanças de crescimento e reprodução da fauna aquática; facilitação no desenvolvimento e aparecimento das chamadas superbactérias, e, principalmente, a bioacumulação por diferentes rotas, levando à presença destes compostos para além das matrizes aquáticas, afetando assim a fauna e flora terrestres, com posterior ingestão por populações humanas (ROIG; WEISS; THIREAU, 2019; VAUDIN et al. 2022; VESELI et al. 2022). O nível de contaminação difere entre as muitas classes de fármacos existentes baseando-se em sua produção, aplicação e descarte pela sociedade (GUO et al. 2021; KAYA et al. 2022). Merecendo destaque entre as mais consumidas as seguintes: antiepiléticos, antidepressivos, antibióticos, anti-inflamatórios, antidepressivos, fármacos de combate e tratamento ao câncer, insulina e seus análogos, reguladores lipídicos, antiepiléticos e antiparasitários. Visto a crescente detecção e quantificação destes compostos na natureza, todos são motivo de atenção e cuidado (HONG et al. 2021; TKACZYK et al. 2021; XIANG et al. 2021; OMOTOLA, et al. 2022). A aplicação de tratamentos capazes de degradar os fármacos de forma eficiente e completa é importante, dentre os tratamentos existentes, destacam-se os processos oxidativos avançados (POA). Estes se baseiam na geração de radicais hidroxila (●OH), altamente oxidantes, capazes de mineralizar contaminantes farmacêuticos, transformando-os em moléculas menores, inertes ao meio ambiente (AHUJA, 2019; RODRÍGUEZ-CHUECA et al. 2019; RAYAROTH et al. 2022). Além dos POA convencionais, tais como a fotoperoxidação, processos Fenton e foto- Fenton, os processos oxidativos avançados eletroquímicos (POAE) têm recebido destaque. Neles, a adição de agentes oxidantes no sistema de tratamento não se faz necessária e a degradação de contaminantes orgânicos ocorre em células eletrolíticas, onde os elétrons são os reagentes principais (LI et al. 2019; LIU et al. 2020; SANTOS et al. 2021). Oxidação eletroquímica ou anódica (OA), foto-eletro-catálise, eletro-Fenton (EF), foto-eletro-Fenton (FEF), sono-eletro-Fenton (SEF), recuperação de hidrogênio e eletrocoagulação são alguns dos POAE (AMETA; AMETA, 2018; TITCHOU et al. 2021). Estes processos são tratamentos eficientes e limpos, que se baseiam na formação de espécies reativas, como o radical hidroxila, para degradar contaminantes. Porém, nestes processos, estes radicais ativos são gerados de forma eletroquímica, a partir da criação de uma diferença de potencial entre eletrodos (PEREIRA et al. 2020; GARCÍA-ESPINOZA et al. 2021). Um fator importante nos POAE é a natureza e a quantidade de espécies reativas geradas, as quais são induzidas por algumas variáveis, como tipo de eletrólito utilizado, densidade ou potencial de corrente aplicada no meio, material do eletrodo e composição do efluente submetido a tratamento (LTAIEF et al. 2017; GANIYU; MARTÍNEZ-HUITLE; OTURAN, 2021). A oxidação eletroquímica ou anódica é um processo direto no qual os contaminantes ou compostos orgânicos são oxidados na superfície do ânodo a partir de reações de transferência eletrônica. Estas levam à oxidação dos poluentes a partir da transferência de elétrons para as suas moléculas e conduzem à formação de radicais hidroxila ou outras espécies reativas na superfície do ânodo (GANZENKO et al. 2014; SALAZAR et al. 2018; GANIYU; MARTÍNEZ-HUITLE; OTURAN, 2021). A eficiência da oxidação anódica depende de uma série de variáveis envolvidas, como a classe do fármaco, o tempo de exposição, o material de confecção dos eletrodos utilizados, os eletrólitos utilizados e a montagem do sistema (FLORENZA et al. 2014; NIDHEESH, ZHOU; OTURAN, 2018; SIRÉS; BRILLAS, 2021). Diante disto, o presente trabalho teve por objetivo avaliar a degradação de dois contaminantes farmacêuticos, paracetamol e propranolol, de forma individual e em mistura aquosa, frente ao processo de oxidação anódica.
Material e métodos
Soluções de trabalho e método analítico Os princípios ativos para os fármacos paracetamol e propranolol, utilizados neste trabalho, foram obtidos das Farmácias Globo de Manipulação. A partir destes foram construídas duas soluções estoque, de 1000 mg.L-1 cada, em água destilada. Estas foram então diluídas a concentração de 15 mg.L-1 para as soluções de trabalho. A identificação e quantificação dos fármacos foi realizada por metodologia via espectrofotometria de ultravioleta/visível (UV/Vis) (Thermoscientific). Inicialmente foi realizada uma varredura espectral (Scan) da solução de trabalho, de 200 a 900 nm, para obtenção dos comprimentos de onda de máxima absorbância (λmax). Em seguidas foram construídas curvas analíticas para cada um dos fármacos, com faixa linear de concentração de 1 a 30 mg.L-1. Para este método foram determinados parâmetros de linearidade (teste de Grubbs), limite de detecção (LD) e limite de quantificação (LQ), conforme resolução da Agência Nacional de Vigilância Sanitária (Brasil, 2017). Eletrodos, eletrólitos e sistema POAE Dois tipos de eletrodos foram selecionados para a montagem do sistema POAE, bastões cilíndricos de grafite comercial (10 cm de comprimento x 0,5 cm de diâmetro) e cobre comercial (10 cm de comprimento x 0,2 cm de diâmetro) e 4 diferentes eletrólitos em concentrações de 0,1 mol.L-1, sendo eles: cloreto de sódio (NaCl); cloreto de potássio (KCl), sulfato de sódio (Na2SO4) e sulfato ferroso heptahidratado (FeSO4.7H2O). O sistema para o processo de oxidação anódica dos fármacos foi montado com os eletrodos arranjados em 3 diferentes combinações cátodo-ânodo: grafite-grafite; grafite-cobre; e cobre-cobre. Com todos os eletrólitos sendo avaliados para cada uma destas 3 combinações. As condições de trabalho utilizadas foram: 3 cm de distância entre os eletrodos, 1,5 cm de profundidade para os eletrodos de grafite e 4,01 cm para os de cobre (diferença decorrente da diferença de diâmetro de ambos e de forma a garantir a mesma área superficial para o processo), 200 mL de volume das soluções contendo os fármacos e uma voltagem para o sistema de 18V. Os fármacos em análise foram avaliados frente ao processo de oxidação anódica em cada uma das condições citadas durante 60 min sendo observada a degradação destes compostos utilizando a metodologia por espectrofotometria de UV/Vis.
Resultado e discussão
Método analítico
A metodologia via espectrofotometria de UV/Vis para identificação e
quantificação dos fármacos foi avaliada obtendo-se inicialmente os λmax para cada
composto em estudo. Com o paracetamol sendo observado no comprimento de onda de 243
nm, enquanto o propranolol nos comprimentos de onda de 214 nm e 288 nm.
Em seguida, foram construídas as curvas analíticas para ambos os fármacos, em 7
replicatas, sendo observados valores de coeficiente de correlação (r) superiores a
0,99 e valores de G< e G> para o teste de Grubbs inferiores a 1,938, valor tabelado
para análises com 7 repetições (GRUBBS; BECK, 1972). Ambos os resultados indicam
que a metodologia atende os critérios de linearidade do Instituto Nacional de
Metrologia, Qualidade e Tecnologia (INMETRO, 2020) e da Agência Nacional de
Vigilância Sanitária (ANVISA) (BRASIL, 2003). Os dados referentes a determinação
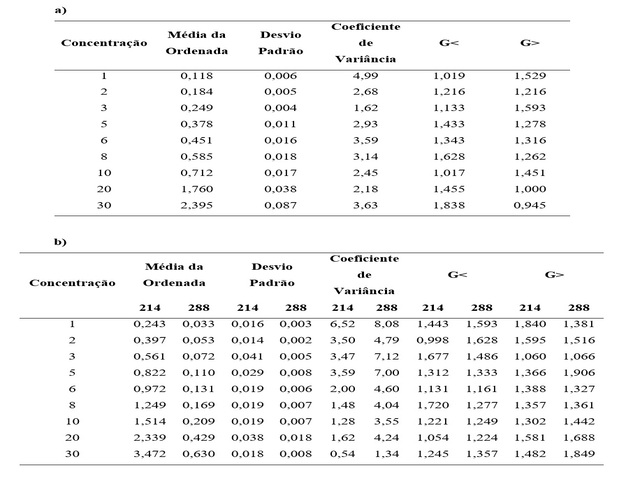
deste resultado estão expostos na Tabela 1.
Conforme observado na Tabela 1, os valores do coeficiente de variância variaram de
1,62 a 4,99 para o paracetamol e de 0,54 para 6,52 (214 nm) e de 1,34 para 8,08
(288 nm) para o propranolol. Estes valores permitiram constatar que para as
concentrações analisadas nas duas curvas construídas todos os CV(%) se encontram
abaixo de 20%, valor mínimo exigido para amostras envolvendo compostos
farmacêuticos, conforme Gad (2007). Pode-se afirmar então que além de linear, a
metodologia empregada é precisa.
Ensaios de degradação
Uma vez avaliada a metodologia para quantificação dos fármacos foram
realizados os ensaios de degradação via oxidação anódica, em duplicata, para os 3
sistemas cátodo-ânodo, utilizando os 4 tipos de eletrólitos citados. Os resultados
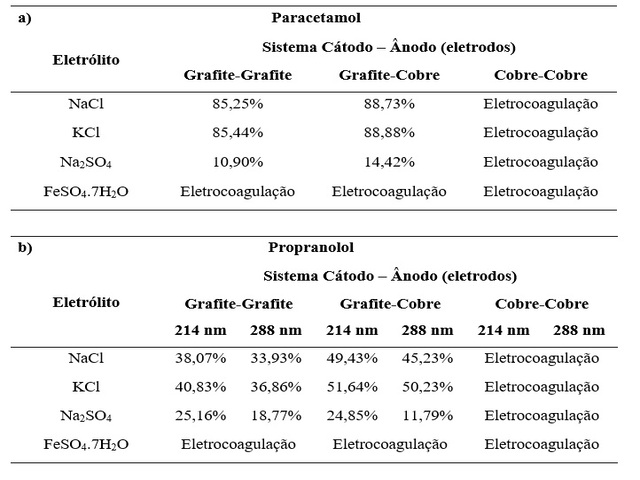
de degradação após 60 min de tratamento para cada fármaco individualmente estão
expostos na Figura 1 a) para o paracetamol e na Figura 1 b) para o propranolol.
A partir da Figura 1 percebe-se que não houve diferenças significativas para a
degradação dos fármacos utilizando NaCl e KCl nos arranjos do tipo grafite-grafite
e grafite-cobre, com a degradação do paracetamol atingindo a faixa entre 85 e 88%
após 60 min de tratamento e o propranolol entre 45 e 51%. Esta eficiência não foi
observada para o (Na2SO4), em que foram obtidas degradações
entre 10 e 14% para o paracetamol e entre 11 e 25% para o propranolol no mesmo
período de tratamento. Esta diferença pode ser explicada pelo efeito da presença de
oxidantes eletrogerados no sistema, que é dependente do tipo de eletrólito
utilizado.
Na oxidação anódica, radicais hidroxila são formados na superfície dos eletrodos
utilizados e reagem com os poluentes orgânicos os degradando (PERIYASAMY;
MUTHUCHAY, 2018). Porém, alterar o eletrólito utilizado no sistema, neste caso de
NaCl e KCl para (Na2SO4), afeta diretamente nos agentes
oxidantes formados paralelamente ao processo, contribuindo até certo ponto para
degradação do fármaco, com diferentes eficiências sendo observadas num período de
60 min (PERIYASAMY; MUTHUCHAY, 2018; SAHA et al. 2022).
No caso da presença de cloretos (Cl-), estes podem ser oxidados diretamente na
superfície dos eletrodos formando espécies de cloro ativo como Cl2 e
ClO- ou radicais cloro ●Cl, aumentando a taxa de degradação de
contaminantes orgânicos (ZHANG et al., 2021). Porém, quantidades excessivas
de cloreto podem causar efeitos adversos, reagindo diretamente com os radicais
hidroxila presentes no sistema para formação de dicloretos e diminuindo a
eficiência da degradação (GREBEL et al., 2010; WANG et al., 2020;
SAHA et al. 2022).
A escolha do tipo de material a ser utilizado nos eletrodos é um dos fatores mais
importantes na eficiência de um processo de degradação de fármacos por oxidação
anódica (ZHANG et al., 2021). Analisando a Figura 1 e o par cátodo-ânodo
utilizado percebe-se que para o paracetamol não foi verificada diferença
significativa para os diferentes eletrodos testados. O propranolol, porém,
apresentou comportamento distinto, com uma leve melhora na degradação sendo
observada ao se aplicar o segundo sistema.
Esta melhora pode ser explicada pela facilidade da geração eletroquímica de
H2O2 ao se utilizar ânodos metálicos como o cobre ou ferro
quando comparado ao uso de grafite, levando a uma maior formação de radicais
hidroxila através da dissociação daquele. Em contrapartida, eletrodos de grafite
apresentam baixa inércia química, correntes residuais com consumo de energia
relativamente reduzido e fácil acesso, o que reduz custos (SIVODIA, SINHA, 2020;
YUAN et al., 2023).
Por fim, foi observado que ao se utilizar o sulfato ferroso heptahidratado,
independentemente do tipo de arranjo, e o arranjo cobre-cobre com qualquer um dos
eletrólitos, para ambos os fármacos, levou à eletrocoagulação das soluções, além da
formação de subprodutos de cor azulada em solução, possivelmente fosfato de cobre
(Cu3(PO4)2) e hidróxido de cobre (Cu(OH)
2), impossibilitando a quantificação da degradação dos fármacos em
solução após 60 min (HONG et al., 2013; GARCÍA-OROZCO et al., 2022).
Parâmetros de validação para as curvas construídas por \r\nmetodologia via espectroscopia de ultravioleta/visível \r\npara: a) Paracetamol e b) Propranolol.
Degradação após 60 min de tratamento por oxidação \r\n\\r\\nanódica do: a) paracetamol e b) propranolol.
Conclusões
A aplicação do processo de oxidação anódica para degradação dos fármacos paracetamol e propranolol, de forma individual e em soluções aquosas apresentou resultados satisfatórios já nos ensaios iniciais de 60 min. A abrangência dos testes iniciais, utilizando 3 arranjos cátodo-ânodo (grafite-grafite); (grafite-cobre) e (cobre- cobre), em conjunto com 4 tipos diferentes de eletrólitos, cloreto de sódio (NaCl), cloreto de potássio (KCl), sulfato de sódio (Na2SO4) e sulfato ferroso heptahidratado (FeSO4.7H2O), demonstraram o impacto que estas duas variáveis têm diretamente no processo de degradação de contaminantes farmacêuticos antes mesmo de otimizá-las. Foram verificados nos ensaios iniciais que a combinação de arranjos cátodo-ânodo e eletrólito que apresentou as maiores eficiências foram grafite-cobre/NaCl e grafite- cobre/KCl, após 60 min de tratamento, atingindo valores de degradação superiores a 88% para o paracetamol e acima de 49% para o propranolol.
Agradecimentos
À Fundação de Amparo à Ciência e Tecnologia de PE (FACEPE) pela concessão de bolsa, à FACEPE APQ 0947-3.06/22 e à FADE/UFPE.
Referências
AHUJA, S.; Comprehensive Water Quality and Purification. v.1, Preface. Elsevier Inc. Waltham, USA, 2019.
AMETA, S.; AMETA, R. Advanced Oxidation Processes for Wastewater Treatment. 1ª ed., London, UK: Academic Press, Elsevier Inc, 2018.
BOXALL, A. B. A.; KOOKANA, R. S. Health Care and Environmental Contamination: A volume in Environmental Contaminants. 1ª Ed. v. 11, Amsterdam, Netherlands: Elsevier B. V., 2018.
BRANCHET, P.; ARPIN-PONT, L.; PIRAM, A.; BOISSERY, P.; WONG-WAH-CHUNG, P.; DOUMENQ, P.; Pharmaceuticals in the marine environment: What are the present challenges in their monitoring. Science of The Total Environment. v. 766, 142644, 2021.
BRASIL, Ministério da Saúde. Resolução n° 899, de 29 de maio de 2003. Agência Nacional de Vigilância Sanitária – (ANVISA). Brasília, DF, 2003.
BRASIL, Ministério da Saúde. Resolução RDC n° 166, de 24 de julho de 2017. Agência Nacional de Vigilância Sanitária – (ANVISA). Brasília, DF, 2017.
CHOWDHURY, P.; SARATHY, S. R.; DAS, S.; LI, J.; RAY, A. K.; RAY, M. B. Direct UV photolysis of pharmaceutical compounds: Determination of pH-dependent quantum yield and full-scale performance. Chemical Engineering Journal. v. 380, n. 1224660, 2020.
FLORENZA, X.; SOLANO, A. M. S.; CENTELLAS, F.; MARTÍNEZ-HUITLE, C. A.; BRILLAS, E.; GARCIA-SEGURA, S.; Degradation of the azo dye Acid Red 1 by anodic oxidation and indirect electrochemical processes based on Fenton’s reaction chemistry. Relationship between decolorization, mineralization and products. Electrochimica Acta. v. 142, p. 276-288, 2014.
GAD, S. C.; Handbook of Pharmaceutical Biotechnology. Wiley-Interscience. 1ª Ed. 2007.
GANIYU, S. O.; MARTÍNEZ-HUITLE, C. A.; OTURAN, M. A.; Electrochemical advanced oxidation processes for wastewater treatment: Advances in formation and detection of reactive species and mechanisms. Current Opinion in Electrochemistry. v. 27, 100678, 2021.
GANZENKO, O.; HUGUENOT, D.; HULLEBUSCH, E. D. VAN.; ESPOSITO, G.; OTURAN, M. A. Electrochemical advanced oxidation and biological processes for wastewater treatment: a review of the combined approaches. Environmental Science and Pollution Research. v. 21, p.8493–8524. 2014.
GARCÍA-ESPINOZA, J. D.; ROBLES, I.; DURÁN-MORENO, A.; GODÍNEZ, L. A.; Photo-assisted electrochemical advanced oxidation process for the disinfection of aqueous solutions: A review. Chemosphere. v. 274, 129957, 2021.
GARCÍA-OROZCO, V. M.; LINARES-HERNÁNDEZ, I.; NATIVIDAD, R.; BALDERAS-HERNÁNDEZ, P.; ALANIS-RAMÍREZ, C.; BARRERA-DÍAZ, C. E.; ROA-MORALES, G.; Solar-photovoltaic eletrocoagulation of wastewater from a chocolate manufacturing industry: Anodic material effect (aluminium, Copper and zinc) and life cycle assessment. Journal of Environmental Chemical Engineering. v. 10, n. 3, 107969, 2022.
GREBEL, J. E.; PIGNATELLO, J. J.; MITCH, W. A.; Effect of halide ions and carbonates on organic contaminant degradation by hydroxyl radical-based advanced oxidation processes in saline water. Environmental Science & Technology. v. 44, n. 44, p. 6288-6828, 2010.
GRUBBS, F. E.; BECK, G. Extension of samples sizes and percentage points for significance tests of outlying observations. Technometrics. v. 14, n. 4, p. 847-854, 1972.
GUO, J.; LIU, S.; ZHOU, L.; CHENG, B.; LI, Q.; Prioritizing pharmaceuticals based in environmental risks in the aquatic environment in China. Journal of Environmental Management. v. 278, part 1, 111479, 2021.
HONG, B.; YU, S.; ZHOU, M.; LI, J.; DING, J.; NIU, Y.; Development of a pH-paralleling approach of quantifying six-category pharmaceuticals in surface water using SPE-HPLC-MS/MS. Watershed Ecology and the Environment. v. 3, p. 1-16, 2021.
HONG, K.; CHANG, D.; BAE, H.; SUNWOO, Y.; KIM, J.; Electrolytic removal of phosphorus in wastewater with Noble Electrode under the conditions of low current and constant voltage. International Journal of Electrochemical Science. v. 8, n. 6, p. 8557-8571, 2013.
INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA – (INMETRO). DOC-CGCRE-008 Orientação sobre validação de métodos analíticos. 2020.
KAYA, S. I.; GUMUS, E.; CETINKAYA, A.; ZOR, E.; OZKAN, S. A.; Trends in on-site removal, treatment, and sensitive assay of common pharmaceuticals in surface waters. TrAC Trends in Analytical Chemistry. v. 149, 116556, 2022.
KLATTE, S.; SCHAEFER, H-C.; HEMPEL, M. Pharmaceuticals in the environment – A short review on options to minimize the exposure of humans, animals, and ecosystems. Sustainable Chemistry and Pharmacy. v. 5, p. 61-66, 2017.
LI, J.; LI, Y.; XIONG, Z.; YAO, G.; LAI, B. The electrochemical advanced oxidation processes coupling of oxidants for organic pollutants degradation: mini-review. Chinese Chemical Letters. v.30, n. 12, p. 2139-2146 2019.
LIU, L.; HE D.; PAN, F.; HUANG R.; LIN, H.; ZHANG, X. Comparative study on treatment of methylene blue dye wastewater by different internal electrolysis systems and COD removal kinetics, thermodynamics and mechanism. Chemosphere, v. 238, p. 124671, 2020.
LTAÏEF, A. H.; D'ANGELO, A.; AMMAR, S.; GADRI, A.; GALIA, A.; SCIALDONE, O. Electrochemical treatment of aqueous solutions of catechol by various electrochemical advanced oxidation processes: Effect of the process and of operating parameters. Journal of Electroanalytical Chemistry, v. 796, p. 1–8, 2017.
MAHJOUB, O.; CHMENGUI, W.; Pharmaceutical active compounds in marine and coastal environments of arid and semi-arid countries of the Arab region. Pharmaceuticals in Marine and Coastal Environments. v. 1, p. 91-119, 2021.
NIDHEESH, P. V.; ZHOU, M.; OTURAN, M. A. An overview on the removal of synthetic dyes from water by electrochemical advanced oxidation processes. Chemosphere. v.197, p.210-227. 2018.
OMOTOLA, E. O.; OLUWOLE, A. O.; OLADOYE, P. O.; OLATUNJI, O. S.; Occurrence, detection and ecotoxicity studies of selected pharmaceuticals in aqueous ecosystems – a systematic appraisal. Environmental Toxicology and Pharmacology. v. 91, 103831, 2022
PEREIRA, L. A.; ALMEIDA, D. A. L.; COUTO, A. B.; FERREIRA, N. G. Titanium dioxide/oxidized carbon fiber electrodes electrochemically produced and their influences on Brilliant Green dye degradation. Materials Research Bulletin. v. 122, 110642, 2020.
PERIYASAMY, S.; MUTHUCHAMY, M. Electrochemical oxidation of paracetamol in water by graphite anode: Effect of pH, electrolyte concentration and current density. Journal of Environmental Chemical Engineering. v. 6, n. 6, p. 7358-7367, 2018.
RAYAROTH, M. P.; ARAVINDAKUMAR, C. T.; SHAH, N. S.; BOCZKAJ, G.; Advanced oxidation processes (AOPs) based wastewater treatment – unexpected nitration side reactions – a serious environmental issue: A review. Chemical Engineering Journal. v. 430, 133002, 2022.
RODRÍGUEZ-CHUECA, J.; GIUSTINA, S. V. D.; ROCHA, J.; FERNANDES, T.; PABLOS, C.; ENCINAS, A.; BARCELO, D.; RODRÍGUE-MOZAZ, S.; MANAIA, C. M.; MARUGÁN, J. Assessment of full-scale tertiary wastewater treatment by UV-C based-AOPs: Removal or persistence of antibiotics and antibiotic resistance genes?. Science of The Total Environment. v. 652, p. 1051-1061, 2019.
ROIG, B.; WEISS, K.; THIREAU, V. Management of Emerging Public Health Issues and Risks: Multidisciplinary Approaches to the Changing Environment. 1ª Ed. London, UK: Elsevier Ltc, 2019.
ROSI, E.; FORK, M.; HOELLEIN, T.; KELLY, J. J.; RICHMOND, E.; Inputs, Occurrence and Effects of Pharmaceuticals and Microplastics in Freshwater Ecosystems. Encyclopedia of Inland Waters (Second Edition). v. 2, p. 471-481, 2022.
SAHA, P.; WANG, J.; ZHOU, Y.; CARLUCCI, L; JEREMIASSE, A. W.; RIJNAARTS, H. H. M.; BRUNING, H. Effect of electrolyte composition on electrochemical oxidation: Active sulfate formation, benzotriazole degradation, and chlorinated by-products distribution. Environmental Research. v. 211, 113057, 2022.
SALAZAR, R.; CONTRERAS, N.; MANSILLAB, H. D.; YÁ˜NEZA, J.; SALAZAR, R. Electrochemical degradation of industrial textile dye disperse yellow 3: Role of electrocatalytic material and experimental conditions on the catalytic production of oxidants and oxidation pathway. Chemosphere, v. 198, p. 21–29, 2018.
SANTOS, A. J.; KRONKA, M. S.; FORTUNATO, G. V.; LANZA, M. R. V.; Recent advances in electrochemical water technologies for the treatment of antibiotics: A short review. Current Opinion in Electrochemistry. v. 26, 100674, 2021.
SERVIEN, R.; LEENKNECHT, C.; BONNOT, K.; ROSSARD, V.; LATRILLE, E.; MAMY, L.; BENOIT, P.; HÉLIAS, A.; PATUREAU, D.; Improved impact assessment of micropollutants release from WWTPs. Case Studies in Chemical and Environmental Engineering. v. 5, 100172, 2022.
SIRÉS, I.; BRILLAS, E.; Upgrading and expanding the electro-Fenton an related processes. Current Opinion in Electrochemistry. v. 27, 100686, 2021.
SIVODIA, C.; SINHA, A.; Assessment of graphite electrode on the removal of anticancer drug cytarabine via indirect electrochemical oxidation process: Kinetics & pathway study. Chemosphere. v. 243, 125456, 2020.
TITCHOU, F. E.; ZAZOU, H.; AFANGA, H.; EL GAAYDA, J.; AKBOUR, R. A.; NIDHEESDH, P. V.; HAMDANI, M.; An overview on the elimination of organic contaminants from aqueous systems using electrochemical advanced oxidation processes. Journal of Water Process Engineering. v. 41, 102040, 2021.
TKACZYK; A.; BOWNIK, A.; DUDKA, J.; KOWAL, K.; SLASKA, B.; Daphnia magna model in the toxicity assessment of pharmaceuticals: A review. Science of The Total Environment. v. 763, 143038, 2021.
VAUDIN, P.; AUGÉ, C.; JUST, N.; MHAOUTY-KODJA, S.; MORTAUD, S.; PILLON, D.; When pharmaceutical drugs become environmental pollutants: Potential neural effects and underlying mechanisms. Environmental Research. v. 205, 112495, 2022.
VESELI, M.; ROZMAN, M.; VILENICA, M.; PETROVIC, M.; PREVISIC, A.; Bioaccumulation and bioamplification of pharmaceuticals and endocrine disruptors in aquatic insects. Science of The Total Environment. v. 838, part 2, 156208, 2022.
WANG, L.; LU, J.; LI, L.; WANG, Y.; HUANG, Q.; Effects of chloride on electrochemical degradation of perfluorooctanesulfonate by Magnéli phase Ti4O7 and boron doped diamond anodes. Water Research. v. 170, 115254, 2020.
WENNMALM, A.; Pharmaceuticals: Environmental Effects. Encyclopedia of Environmental Health (Second Edition) – Reference Module in Earth Systems and Environmental Sciences. p. 142-150, 2019.
XIANG, Y.; WU, H.; LI, L.; REN, M.; QIE, H.; LIN, A.; A review of distribution and risk of pharmaceuticals and personal care products in the aquatic environment in China. Ecotoxicology and Environmental Safety. v. 213, (112044) 2021.
YUAN, Q.; QU, S.; LI, R.; HUO, Z-Y.; GAO, Y.; LUO, Y.; Degradation of antibiotics by electrochemical advanced oxidation processes (EAOPs): Performance, mechanisms, and perspectives. Science of the Total Environment. v. 856, part 2, 159092, 2023.
ZHANG, J.; ZHOU, Y.; YAO, B.; YANG, J.; ZHI, D.; Current progress in electrochemical anodic-oxidation of pharmaceuticals: Mechanisms, influencing factors and new technique. Journal of Hazardous Materials. v. 418, 126313, 2021
















