ÁREA
Química Ambiental
Autores
Silva, C.O.L. (UFPE) ; Guedes, G.A.J.C. (UFPE) ; Silva, M.N. (UFPE) ; Freitas, R.A. (UFPE) ; Santana, I.L.S. (UFPE) ; Napoleão, D.C. (UFPE) ; Duarte, M.M.M.B. (UFPE)
RESUMO
O objetivo do trabalho é avaliar a eficiência do adsorvente preparado a partir da casca de amendoim para adsorção de íons chumbo em sistema de leito fixo. A caracterização do CAH3PO4 indicou a presença de grupos oxigenados e mesoporos. No estudo da influência da concentração inicial da solução para um leito de 30 cm (8,5 g) ocorreu 100% de remoção dos íons chumbo em 240 min. Desta forma, não foram observados os pontos de ruptura (tr) e saturação (ts). Para o leito de 10 cm (3,5 g) o tr ocorreu nas concentrações de 1,0 e 2,0 mmol∙L-1, em 390 e 150 min, respectivamente. A concentração de 2,0 mmol∙L-1 apresentou ts em 420 min. Os resultados indicam que o CAH3PO4 apresenta alto potencial de remoção dos íons chumbo em leito fixo.
Palavras Chaves
Chumbo; Leito fixo; Resíduo agroindustrial
Introdução
A emissão de efluentes industriais sem o devido tratamento, contendo metais como o chumbo, tem sido motivo de preocupação em virtude de sua elevada toxicidade, efeito bioacumulativo, não biodegrabilidade e potencial ação cancerígena (DIACONU et al. 2020). Em relação a saúde pública, as crianças e gestantes são mais susceptíveis à intoxicação por chumbo, podendo desenvolver distúrbios no sistema nervoso central (FIYADH et al.2019). O chumbo pode ser encontrado em efluentes oriundos de indústria de baterias, pesticidas e tintas (KUSHWAHA et al. 2018). No Brasil, o despejo de efluentes em corpos receptores é regido pela Resolução Nº 430/2011 do Conselho Nacional do Meio Ambiente (CONAMA), que estabelece como limite de concentração para o chumbo de 0,5 mg·L-1 (BRASIL, 2011). Deste modo, torna-se necessário o emprego de processos voltados ao tratamento de efluentes industriais contendo este metal. Dentre os tratamentos aplicados, a adsorção apresenta-se como um dos processos mais simples, eficazes e de fácil operação na remoção de metais pesados. Além disso, possibilita a recuperação do adsorvente durante o processo de remoção dos íons em soluções aquosas (SINGH et al. 2018; LIMA et al.2020). Diante disto, a fim de desenvolver um adsorvente eficiente e de fonte renovável, nos últimos anos tem sido realizado estudos com resíduos agroindustriais, considerando sua ampla demanda (SILVA et al. 2018). A aplicação de biomassas na produção de adsorventes tem sido investigada utilizando resíduos, como cascas de amendoim, palha de arroz, bagaço de cana-de-açúcar e casca de abacaxi. Estes materiais apresentaram uma boa eficiência na adsorção de íons metálicos (SANTOS et al. 2022; OLIVEIRA, 2019; ZHAO et al. 2020). A casca do amendoim (Arachis hypigaea Linn), é um material rico em fibras e, é responsável por 30% em peso da oleaginosa. Este resíduo possui uma considerável aplicabilidade como combustível, em processos fermentativos e alimentação animal, porém grande parte dessas cascas ainda são descartadas indevidamente (SANTOS et al. 2022). Desta forma, tem-se investigado formas de agregar valor ao material (DEPIERI, 2019). Basu, Guha e Ray (2019) utilizaram casca de lentilha como adsorvente para adsorção de Pb2+ em sistema de leito fixo. Os autores avaliaram a influência da altura da coluna (5 (2,10 g), 8 (2,75 g) e 10 (3,10 g) cm) e da concentração inicial (C0) (0,25 mmol·L-1 e 0,48 mmol·L-1), em pH 5, durante 360 min, utilizando uma coluna de leito fixo de 20 cm de comprimento e 1,0 cm de diâmetro. A maior capacidade adsortiva foi de 0,99 mmol·g-1 obtida no leito de 10 cm, C0 de 0,48 mmol·L-1 e vazão de 20 mL·min-1). Qu et al. (2019) avaliaram o uso de resíduos de matriz modificada de Auricularia como adsorvente para adsorção de Pb2+ em coluna de leito fixo. Os autores estudaram os efeitos da vazão (15,20 e 25 mL·min-1), concentração inicial (0,48; 0,72 e 0,96 mmol·L-1 e altura do leito (15, 20 e 25 cm), utilizando uma coluna de leito fixo de 40 cm de comprimento e 2,4 cm de diâmetro. O melhor resultado da capacidade adsortiva foi de 0,73 mmol·L-1, obtida para vazão de 15 mL·min-1, C0 de 0,72 mmol·L-1 e leito de 25 cm. Ramola et al. (2021) estudaram a aplicação de bambu (BBm) e bagaço de cana de açúcar (BBg), com e sem modificação com ferro, como biomassa para remoção de íons Pb2+ e Cu2+ em leito fixo. Os autores estudaram diferentes proporções de biomassa e amostras de solo, em condições fixas de concentração inicial ((0,14 mmol·L-1 para Pb2+) e (0,47 mmol·L-1 Cu2+)) e vazão (2 mL·min-1), numa coluna de 40 cm de comprimento e 4 cm de diâmetro. Os maiores valores de capacidade adsortiva para o Pb2+ foi de 0,00063 mmol·L-1 em 10% BBg e de 0,00068 mmol·L-1 em 6% BBm. Já para o Cu2+ foi de 0,00173 mmol·L-1 em 10% BBg e de 0,00189 mmol·L-1 em 10% BBm. Perante o exposto, este trabalho teve como objetivo avaliar a eficiência do adsorvente preparado a partir de resíduo agroindustrial, casca de amendoim, visando a remoção dos íons Pb2+ por processo adsortivo em leito fixo.
Material e métodos
As soluções de trabalho foram obtidas por diluição da solução estoque (4,8mmol·L-1) dos íons Pb2+. Os ensaios foram realizados no pH 5, tendo em vista que neste pH não ocorre precipitação dos íons conforme Santos et al. (2022). Os teores do íon foram quantificados em Espectrofotômetro de Absorção Atômica com Chama (Varian, AA 240) no comprimento de onda de 261,4 nm em curva analítica previamente avaliada conforme INMETRO (2020). As cascas de amendoim, obtidas em comércio do Recife-PE, foram lavadas em água corrente, cortadas e secas à 105ºC em estufa (Splabor) por 24 h. Em seguida, foram trituradas em moinho de facas (Cienlab, CED-430), lavadas com água destilada e secas em estufa a 60ºC/24h (IN). Para obtenção do carvão ativado (CAH3PO4), frações de 20 g do IN foram tratadas com ácido fosfórico (H3PO4 85%) na proporção de 5:3 (p/V). A mistura foi levada a mufla (Quimis), com rampa de 10ºC∙min-1, permanecendo à 100ºC/30 min, 200ºC/1 h e 350ºC/1 h. Visando a remoção do ácido residual, o CAH3PO4, foi lavado com NaHCO3 1% (marca, Neon) até atingir pH entre 6 e 7. O material foi lavado com água destilada e seco em estufa à 105ºC/24 h, este adsorvente foi classificado na granulometria de 0,15-0,21 nm. O CAH3PO4 foi caracterizado pelas técnicas de adsorção/dessorção de N2 (Quantachrome, NOVA-2000) com aquecimento a 120ºC e pressão relativa (P/P0) de 0 a 0,3. Por espectroscopia na região do infravermelho por transformada de Fourier (FT-IR) em espectrômetro (Perkin- Elmer), para CA/H3PO4 antes e após adsorção dos íons Pb2+, empregando a técnica de Refletância Total Atenuada (ATR). Os espectros foram avaliados numa faixa entre 4000 e 500 cm-1 do infravermelho. Por fim, foi caracterizado pelo método do pH do ponto de carga zero (pHPCZ), obtido com 0,1 g do adsorvente em contato com 25 mL de água em pH 2 a 11, 300 rpm por 24 h a 25 ±2°C. A relação massa do adsorvente, volume da solução a ser tratada e tempo de contato foram definidos com base em estudos realizados previamente em reator de banho finito. Os ensaios para avaliar o efeito da concentração inicial (C0) foram realizados em coluna de leito fixo de vidro borosilicato (D=0,8 cm), empacotada com CAH3PO4. As soluções dos íons Pb2+,em concentrações de 5; 1,0 e 2 mmol∙L-1 foram bombeadas em fluxo ascendente com vazão de 5 mL∙mim-1 percorrendo o leito adsortivo de 30 cm (8,5 g), na temperatura de 25±2ºC, com coleta de amostras realizada no topo da coluna, em tempos pré-estabelecidos de 1 a 240 mim para um volume tratado de 1,2 L. Considerando os resultados obtidos, foi realizado novo estudo utilizando uma menor altura do leito (10 cm) com 3,5 g do adsorvente, nas mesmas condições do estudo anterior. O tempo de retirada das alíquotas foi estendido até 480 min para um volume tratado de 2,4 L.
Resultado e discussão
Visando a quantificação dos íons Pb2+, foi construída uma curva
analítica na faixa linear de 0,025 a 2,25mmol·L-1, com limite de
detecção de 0,004 mmol·L-1 e limite de quantificação de 0,015
mmol·L-1. O valor do coeficiente de variação (CV%) foi de 5,15 e do
coeficiente de correlação (r) igual a 0,9999. Estes resultados indicam a
precisão e exatidão do método, conforme INMETRO (2020) e Harris (2017),
respectivamente. A técnica de adsorção/dessorção de N2 foi empregada
a fim de obter os valores da área superficial, diâmetro médio e volume do poro.
Na Figura 1A apresentada a isoterma de adsorção/dessorção do CAH3PO4.
A isoterma do material se assemelha a curva do tipo Ib, atribuída a presença de
micro e mesoporo, com alta afinidade entre adsorvente-nitrogênio. Através da
aplicação dos métodos de Brunauer, Emmett e Teller (BET) e Banet, Joyner e
Halenda (BJH), foram obtidos os valores do volume do poro de 0,382
cm3.g-1, da área superficial de 689
m2.g-1 e diâmetro médio do poro reduziu 2,2 nm. Este
resultado pode ser atribuído a evaporação do H3PO4 durante
o procedimento de carbonização, conforme Belhamdi et al. (2019) e Chen
et al. (2020). Deste modo, considerando o diâmetro médio do poro do
CAH3PO4, pode-se classificá-lo como mesoporoso, conforme
classificação da International Union of Pure and applied Chemistry (IUPAC,
Thommes et al. (2015). A partir da Figura 1B, foi possível constatar que
os picos compreendidos na faixa de 1650 a 1200 cm-1 para o
CAH3PO4, estão associados aos estiramentos de ligações C=O, C=C em
grupos aromáticos, C-H e estiramentos C-O em compostos carboxílicos, conforme
Oliveira (2019) e Zama et al. (2017). De acordo com Gama et al.
(2022), Chen et al. (2020) e Oliveira (2019), a ativação ácida com
posterior carbonização resulta em alterações na cristalinidade da celulose,
intensificando a presença de vários grupos oxigenados, como hidroxilas,
carboxílicos, fenólicos e carbonílicos, que contribuem para a coordenação de
íons de metais pesados. Comparando os espectros de CAH3PO4 antes e
após a adsorção dos íons Pb2+, pode-se verificar uma redução dos
picos na faixa de 1650-100 cm-1. Logo, a redução das bandas
correspondentes a vibrações de C=O e C-O, indicando que estes grupamentos estão
relacionados a adsorção destes íons. O pHPCZ é um indicativo do valor
de pH da solução em que a carga superficial do adsorvente é nula. A partir da
Figura 1C, pode-se verificar que o pHPCZ do CAH3PO4 foi de
7,2. A submissão ao processo de lavagem com bicarbonato de sódio pode ter
influenciado neste valor, visto que foi utilizado a fim de remover o ácido
residual. Além disso, vale salientar que o tratamento com
H3PO4, com posterior carbonização, promoveu a produção de
grupos oxigenados na superfície do adsorvente, resultados que corroboram com os
espectros de FT-IR. O estudo da concentração inicial da solução em leito fixo
permitiu avaliar sua influência no processo adsortivo. De acordo com a Figura 2A
pode-se verificar que em nenhuma das concentrações avaliadas ocorreu o início do
ponto de ruptura (C/C0 = 5%) do leito, mesmo após 4 horas de tratamento de um
volume de 1,2 L, demonstrando assim o alto potencial do adsorvente preparado
para a adsorção dos íons Pb2+. Pode ser observado na Figura 2B que
para todas as concentrações avaliadas, o processo adsortivo resultou em um
percentual de remoção de 100% para o tempo de análise. Deste modo, foram
realizados novos ensaios utilizando uma massa do adsorvente 2,4 vezes menor na
tentativa de identificar o ponto de ruptura e de exaustão. Conforme pode ser
observado na Figura 2C, a concentração de 0,5 mmol·L-1 não apresentou
a formação da curva de ruptura para um volume de 2,4 L. Para 1,0
mmol·L-1 a ruptura do leito ocorreu no tempo (tr) de 390
min, mas sem a saturação total do sistema mesmo após tratamento 2,4 L por 480
min. Conforme Oliveira (2019) o leito pode apresentar uma maior disponibilidade
de sítios ativos do que íons em solução, o que torna o tempo de saturação maior.
Nas condições avaliadas, a curva de ruptura foi obtida para concentração de 2,0
mmol·L-1. Nesta concentração o tr foi em 150 min (0,75 L),
com o tempo de saturação (ts) em torno de 420 min (2,1 L) e
capacidade adsortiva de 0,6 mmol·g-1. Além disso, nota-se que à
medida que a concentração inicial aumenta o tempo de ruptura reduz. Isto ocorre
devido uma menor resistência à transferência de massa dos íons Pb2+
da camada limite para a superfície de CAH3PO4. A partir da Figura 2D,
observa-se que na concentração de 0,5 mmol·L-1 o percentual de
remoção foi de 100%. Este resultado pode ser atribuído a maior disponibilidade
de sítios ativos do leito nesta concentração, conforme supracitado. Em
contrapartida, na concentração de 1,0 mmol·L-1 o percentual de
remoção teve uma queda de 9,97% logo após a ruptura do leito, para tr
de 390 min. Um comportamento semelhante foi observado para a concentração de 2,0
mmol·L-1, com uma queda de 27,2% para tr em 150 min.
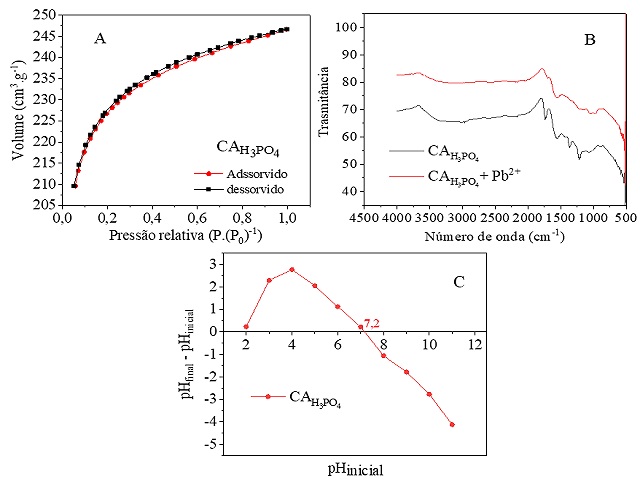
Caracterização do adsorvente. A - Isoterma de adsorção/dessorção de nitrogênio; b - Espectro de FT-IR; C - pH do ponto de carga zero (pHPCZ).
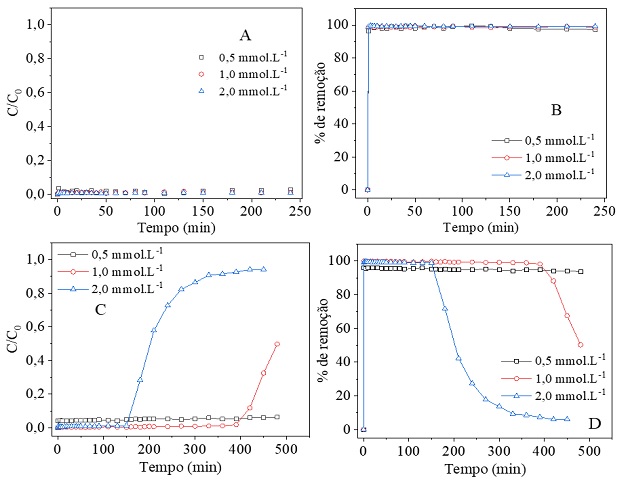
Figura 2- Efeito da Co na adsorção do íon. A- Relação C/Co x tempo e B- % de remoção para Z = 30 cm; C- C/Co x tempo e D- % de remoção para Z = 10 cm.
Conclusões
Diante do exposto é possível concluir que o CAH3PO4 proveniente da casca de amendoim foi eficaz para remoção de íons Pb2+ de soluções aquosas. A presença de grupos oxigenados na superfície do adsorvente, bem como uma estrutura mesoporosa são características favoráveis para adsorção do íon estudado. O reator de 30 cm (8,5 g), construído com base nos dados obtidos em reator de banho finito, apresentou eficiência de remoção de 100% para todas as concentrações avaliadas, não sendo possível determinar o tempo de ruptura e nem o de saturação, num intervalo de tempo de 420 min de tratamento. Quando a altura foi reduzida 3 vezes (leito de 10 cm de altura) para a menor concentração avaliada de 0,5 mmol∙L-1 o comportamento foi semelhante ao anterior, no entanto ao dobrar a concentração inicial foi possível determinar o tempo de ruptura. Devido à alta eficiência do material não foi possível determinar o tempo de saturação mesmo após 480 min de tratamento. Apenas para a concentração de 2,0 mmol∙L-1 foi possível determinar a tempo de ruptura e saturação de mesmo assim com percentual de remoção de 100% até 150 min. Desta foram, pode-se afirmar que o CAH3PO4 apresenta potencial técnico para o tratamento de efluentes contendo os íons Pb2+. Desta forma, agregando valor a um resíduo agroindustrial e reincorporando na cadeia produtiva.
Agradecimentos
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), PIBIC/UFPE, FADE/UFPE e Núcleo de Química Analítica Avançada de Pernambuco - NUQAAPE (FACEPE, processo APQ-0346-1.06/14).
Referências
BASU, M.; GUHA, A.K.; RAY, L. Adsorption of lead on lentil husk in fixed bed column bioreactor. Bioresource Technology.v. 283, p. 86-95, 2019.
BELHAMDI, B.; MERZOUGUI, Z.; LAKSACI, H.; TRARI, M. The removal and adsorption mechanisms of free amino acid 1-trytophan from aqueous solution by biomass-based activated carbono by H3PO4 activation: Regeneration study. Physics and Chemistry of the Earth, Parts A/B/C, v. 114, p. 102791, 2019.
BRASIL. Ministério do Meio Ambiente. Resolução nº 430, d e13 de maio de 2011. Conselho Nacional do Meio Ambiente (CONAMA), Brasília, DF, 2011.
CHEN, M.; HE, F.; HU, D.; BAO, C.; HUANG, Q. Broadened operating pH range for adsorption/reduction of aqueous Cr(VI) using biochar from directly treated jute (Corchorus capsularis L.) fibers by H3PO4. Chemical Engineering Journal, v. 381, p. 122739, 2020.
DEPIERI, H. A. Gestão das Inovações tecnológicas na agroindústria do amendoim do estado de São Paulo. Dissertação de Mestrado. São Carlos, SP: UFSCar, 2019.
DIACONU, M.; PAVEL, L.V.; HLIHOR, R.M.; ROSCA, M.; FERTU, D.I.; LENZ, M.; CORVINI, P.X.; GAVRILESCU, M. Characterization of heavy metal toxicity in some plants and microorganisms – a preliminary approach for environmental bioremediation. New Biotechnology, v. 56, p. 130-139, 2020.
FIYADH, S.S.; ALSAADI, M.A.; JAAFAR, W.Z.; ALOMAR, M.K.; FAYAED, S.S.; MOHD, N.S.; HIN, L.S.; EL-SHAFIE, A. Review heavy metal adsorption processes by carbon nanotubes. Journal of Cleaner Production, v. 230, p.783-793, 2019.
GAMA, B.M.V.; SALES, D.C.S.; NASCIMENTO, G.E.; RODRIGUEZ-DÍAZ, J.M.; BARBOSA, C.M.B.M.; DUARTE, M.M.M.B. Modeling mono and multicomponent adsorption of phenol and cadmium from aqueous solution by peanut shell biochar. Industrial & Engineering Chemistry Research, 2022.
HARRIS, D.C. Análise Química Quantitativa. 9ª ed. LTC - Livros Técnicos e Científicos, Editora S.A. Rio de Janeiro: RJ, 2017.
INMETRO. Orientação sobre validação de métodos analíticos: Documento de caráter orientativo. DOQ-CGCRE-008. p. 1-30, 2020. Revisão 09 - Junho de 2020.
KUSHWAHA, A.; HANS, N.; KUMAR, S.; RANI, S. A critical review on speciation, mobilization and toxicity of lead in soil-microbe-plant system and bioremediation strategies. Ecotoxicology and Environmental Safety, v. 147, p.1035-1045, 2018.
LIMA, V.E.; GOUVEIA, A.G.M.; SILVA, M.L.C.; SOUSA, A.A.P.; PIMENTEL, E.L.; RODRIGUES, A.P. Avaliação do uso de materiais residuais como adsorventes para remoção de Pb2+ em efluentes de laboratórios. Brazilian jornal of Development, v. 6, n.12, p. 97249-97626, 2020.
OLIVEIRA, L.P.S. Adsorção de cádmio(II) e cobalto(II) em sistemas de banho finito e de leito fixo para soluções monocomponente e binária. Tese doutorado. Recife - PE: Universidade Federal de Pernambuco, 2019.
QU, J.; SONG, T.; LIANG, J.; BAI, X.; LI, Y.; WEI, Y.; HUANG, S.; DONG, L.; JIN, Y. Adsorption of lead (II) from aqueous solution by modified Auricularia matrix waste: A fixed-bed column study. Exotoxicology and Environmental Safety. v. 169, p. 722-729, 2019.
RAMOLA, S.; RAWAT, N.; SHANKHWAR, A.K.; SRIVASTAVA, R.K. Fixed bed adsorption of Pb and Cu by iron modified bamboo, bagasse and tyre biochar. Sustainable Chemistry and Pharmacy. v. 22, p. 100486, 2021.
SANTOS, V.H.; NASCIMENTO, G.E.; SALES, D.C.S.; SANTOS, J.H.L.; RODRIGUEZ-DÍAZ, J.M.; DUARTE, M.M.M.B. Preparation of adsorbents from agro-industrial wastes and their application in the removal of Cd2+ and Pb2+ ions from a binary mixture: Evaluation of ionic competition. Chemical Engineering Research and Design, v. 184, p. 152-164, 2022.
SILVA, T.; BARBOSA, C.; GAMA, B.; NASCIMENTO, G.; DUARTE, M. Agregação de valor à resíduo agroindustrial: remoção de fenol utilizando adsorvente preparado a partir da casca de amendoim. Revista Matéria, v. 23, n. 1, 2018.
SINGH, N.B.; NAGPAL, G.; AGRAWAL, S.; RACHNA. Water purification by using Adsorbents: A Review. Environmental Technology & Innnovation, v.11, p.187-240, 2018.
THOMMES, M.; KANEKO, K.; NEIMARK, A.V.; OLIVIER, J.P.; RODRIGUEZ-REINOSO, F.; ROUQUEROL, J.; SING, K.S.W. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and applied Chemistry, v. 87, n. 9-10, p. 1051-1069, 2015.
ZAMA, F.E.; ZHU, Y.; REID, B.J.; SUN, G. The role of biochar properties in influencing the sorption and desorption of Pb(II), Cd(II) and As(III) in aqueous solution. Journal of Cleaner Production, v. 148, p. 127-136, 2017.
ZHAO, M.; DAI, Y.; ZHANG, M.; FENG, C.; QIN, B.; ZHANG, W.; ZHAO, N.; LI, Y.; NI, Z.; XU, Z.; TSANG, D.C.W.; QIU, R. Mechanisms of Pb and/or Zn adsorpion by diferente biochars: Biochar characteristics, stability and binding energies. Science of the Total Environment, v.717, p. 136894, 2020.
















