ÁREA
Química Analítica
Autores
da Costa, W.A. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Nunes, M.B.M. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; de Souza, T.A. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Tavares, J.F. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Moreira, E.D.T. (UNIVERSIDADE FEDERAL DA PARAÍBA) ; Pontes, L.F.B.L. (UNIVERSIDADE FEDERAL DA PARAÍBA)
RESUMO
Na presente pesquisa, uma investigação do uso de diferentes solventes eutéticos profundos naturais (NADESs) na extração de Compostos Fenólicos, a partir do resíduo do abacaxi, foi realizada. A melhor extração foi alcançada pelo NADESs à base de cloreto de colina, glicose e ácido lático (ChGuLa, 1:5:2), tendo o extrato apresentado um teor de compostos fenólicos totais de 10,93 ± 0,91 mgEAG g-1extrato, levando o material a uma deslignificação de 64,79 ± 4,21 %. Estes resultados se mostraram promissores frente ao uso de uma solução hidroetanólica convencional (19,05 ± 0,94 mgEAG g-1extrato e 40,65 ± 4,06 %, respectivamente), o que o configura como um forte candidato para o desenvolvimento de um processo de extração adequado aos preceitos da química verde.
Palavras Chaves
Solventes Verdes; Extração Sólido-líquido; Bioativos
Introdução
A busca por fontes naturais de compostos bioativos tem sido uma crescente tendencia nas últimas décadas tendo em vista as propriedades bioquímicas destes sobre a saúde do corpo humano. Em especial, destaca-se a classe dos compostos fenólicos (CF) como uma das mais exploradas uma vez que estes apresentam diversas atividades biológicas, destacando-se sua atividade antioxidante, bactericida e, mais recentemente, seu papel como candidatos à fármacos auxiliares ao tratamento de pessoas acometidas pela COVID-19 (AUGUSTI et al., 2021; EL-MAATI et al., 2016; GLIGORIJEVIC et al., 2021; KHALIL; TAZEDDINOVA, 2020; LAKKA et al., 2019). Neste contexto, muitos materiais de origem vegetal, como raízes e flores, já foram avaliados como proeminentes matrizes fornecedoras de CF. No entanto, nos últimos anos, estudos vêm apontado a potencialidade do uso de resíduos agroindustriais para tal finalidade, o que também agrega valor às suas referidas cadeias produtivas, dentro dos preceitos da biorrefinaria, e assim minimiza os impactos das atividades do agronegócio sobre o meio ambiente (DA COSTA LOPES et al., 2016; SEPÚLVEDA et al., 2018). Um outro impasse associado à temática aqui abordada é o fato de os processos convencionais de extração de CF fazerem uso dos tradicionais solventes orgânicos (TSO) voláteis, infláveis e tóxicos, tais como etanol e metanol. É nesse cenário que os chamados solventes eutéticos profundos (DESs) têm surgido como uma alternativa ambientalmente amigável aos TSO. DESs são formados por meio de uma reação ácido-base de Bronsted-Lowry entre uma espécie aceptora de ligação de hidrogênio (HBA) e outra(s) doadores de tais ligações (HBD). Quando obtidos a partir de metabolitos naturais, como alguns ácidos e carboidratos, os DESs recebem a designação de solventes eutéticos profundos naturais (NADESs). Os NADESs são capazes de solubilizar compostos com diferentes graus de polaridade, sem comprometer suas propriedades químicas e físicas, além de serem uma classe de solventes moleculares biodegradável, não inflamável, com baixa pressão de vapor e mais ecologicamente compatível frente aos TSO (DA COSTA et al., 2023; MIŠAN et al., 2020). O abacaxi (Ananas comosus) tem sido uma das matrizes lignocelulósicas atreladas a estudos que almejam à obtenção de compostos bioativos. Esta, por sua vez, é uma planta monocotiledônea pertencente à família Bromeliaceae, sendo facilmente em países tropicais como Brasil, Filipinas, Indonésia e China (RICO et al., 2020). No Brasil, especificamente, foram produzidos cerca de 1.545.036 mil frutos em todo país, sendo a maior produção concentrada nos estados do Pará (361.027 mil frutos) e Paraíba (263.370 mil frutos), segundo relatório da Embrapa 2022. Dado o acima exposto, o presente trabalho objetivou à investigação do potencial uso de três diferentes solventes eutéticos na extração e quantificação de compostos fenólicos presentes no resíduo do abacaxi (Ananas comosus), bem como no biorrefino desta matriz liognocelulósica.
Material e métodos
Amostras de resíduo de abacaxi (casca e coroa) foram coletadas no dia 18 de maio de 2023 na indústria de polpa de frutas Intrafrut, localizada no Distrito Industrial da cidade de João Pessoa – PB. O material coletado foi seco em estufa de circulação (Splabor – SP-102) a 60 ºC por 4 dias, até massa constante. Em seguida, a amostra foi moída em moinho de facas e homogeneizada por peneiramento, sendo coletada a fração com diâmetro de partícula inferior a 25 mesh. A amostra laboratorial foi então caracterizada quanto ao seu pH e teor de sólidos solúveis de acordo com o protocolo do Instituo Adolf Lutz (2008). O teor de açúcares redutores totais livres na amostra foi quantificado por espectrofotometria UV-Vis a 540 nm (MALDONADE; CARVALHO; FERREIRA, 2013). O espectrofotômetro usado foi o QUIMIS – U2M e as absorbâncias convertidas em concentração de açúcares (mg mL-1). A curva analítica foi construída utilizando-se glicose como padrão (y = 0,7132.X + 0,0314; r2 = 0,999; LOD = 0,068 mg mL-1 e LOQ = 0,229 mg mL-1). Os solventes eutéticos profundos utilizados como agentes extratores foram obtidos utilizando-se cloreto de colina (Ch) como HBA e ácido lático (La), ácido cítrico (Ca) e/ou glicose (Gu) como HBD, nas seguintes razões molares: ChLa (1:1); ChCaLa (2:1:2) e ChGuLa (1:5:2). Como extrator de referência, uma solução aquosa de etanol (EtOH), a 70% v v-1, foi utilizada. A síntese dos referidos NADESs foi realizada em banho térmico (SOLAB – SL 152) a 80 ºC por cerca de 2h (ABBOTT et al., 2003; DA COSTA et al., 2023). As extrações dos bioativos presentes na matriz amostral foram realizadas em banho térmico por 1 h a 60 ºC, com periódicas agitações em vórtex a cada 10 minutos. Para esse propósito 0,3 g de amostra sólida foram transferidos para tubos cônicos plásticos de 15 mL, em seguida, 3 mL de dos NADESs, adicionados de 10 % (m m-1) de água, foram adicionados ao sistema. Para o ensaio comparativo, 3 mL da solução hidroetanólica foram utiliziados. A determinação dos teores de lignina do material, antes e após cada extração realizada, foi conduzida de acordo com o protocolo do National Renewable Energy Laboratory (NREL) (SLUITER et al., 2008). A quantificação do teor de compostos fenólicos totais extraídos foi realizado por espectrofotometria UV-Vis, a 760 nm, de acordo com o protocolo analítico proposto por Santos et al., (2017). As absorbâncias medidas em um espectrofotômetro de microplacas (BIOTEK, H1M) foram convertidas em mgEAG gamostra por meio de uma curva analítica previamente elaborada utilizando-se ácido gálico (AG) como padrão (y = 0,0048.X + 0,0252, r2 = 0,999, LOD = 37,5 mg mL-1 e LOQ = 125 mg mL-1). Os dados obtidos foram expressos como média ± desvio padrão. Todos os resultados foram analisados estatisticamente a um nível de confiança de 95% por meio do teste de Tukey, com auxílio do software Statistica® (versão 10). Todos os ensaios e quantificações foram realizados em triplicata.
Resultado e discussão
O resultado da caracterização preliminar da amostro do resíduo estudado mostrou que este possui a capacidade de acidificação de efluentes onde venham a ser destacados, haja vista que o pH de uma solução 1:10 (m v-1) tenha apresentado um valor de 3,32 ± 0,02. Com relação a teor de açucares totais livres no material, fora quantificado um teor de 200,26 mg g-1resíduo. Estes resultados caracterizam esse material lignocelulósico como potencialmente poluidor, haja vista que a alteração do pH dos meios hídricos pode conduzir a desequilíbrios consideravelmente danosos aos ecossistemas que destes dependam. Além disso, o alto teor de carboidratos remanescentes no material, mesmo após seu completo processamento industrial, indica não só uma falha no aproveitamento da matéria prima originária, como também representa um outro agravante do ponto de vista ambiental, uma vez que muito oxigênio seja demandado para decompor todo este conteúdo orgânico, acentuando ainda mais os possíveis impactos ambientais advindos do descarte inadequado desta biomassa.
A Figura 01 apresenta os aspectos da amostra de resíduo de abacaxi ((a) e (b)) e dos extratos obtidos (c) utilizando-se cada um dos agentes extratores aqui investigados.
A determinação do percentual de lignina presente no material indicou que este, antes de qualquer tratamento, apresentava-se a um teor de 9,39 ± 0,52 %, resultado este muito similar ao reportado por Chen et al., (2021), o qual reportou um teor de cerca de 13,97% para amostras de casca de abacaxi. Discrepâncias entre a os teores de lignina de amostras diferentes de um mesmo material podem ser atribuídas à diferença entre as variantes investigadas, porções colhidas do material, seus períodos de cultivo, bem como às condições climáticas de onde estas tenham sido obtidas, podendo este valor geralmente variar entre 5 e 15% (PRADO; SPINACÉ, 2019).
A lignina é um heteropolímero mais abundante na superfície do planeta terra, sendo este constituído por, sobretudo, unidade de compostos fenólicos unidos por ligações diferentes tipos de ligações moleculares e intermoleculares (SETHUPATHY et al., 2022). Desta forma, fica evidente que a extração e despolimerização da lignina presente em resíduos agroindústriais pode ser enquadrada como uma importante estratégia para a obtenção de compostos fenólicos para as mais variáveis aplicações em outros setores da indústria química e biotecnológica.
Após cada uma das extrações aqui conduzidas, o teor de lignina da fração sólida do resíduo do abacaxi variou entre 5,57 a 0,39 % (Figura 02), sendo obtidos os seguintes percentuais de remoção, frente ao material não tratado: ChCaLa (95,85 ± 4,05 %), ChLa (69,76 ± 3,63 %), ChGuLa (64,79 ± 4,21 %) e EtOH (40,65 ± 4,06 %). A melhor remoção de lignina apresentada pelos NADESs frente ao convencional EtOH pode ser atribuída ao fato destes poderem estabelecer ligações de hidrogênio para com os grupos hidroxilas livres dos monômeros estruturais da lignina com maior eficácia, dada a maior disponibilidade de sítios disponíveis para tal na estrutura de seus precursores.
Todavia, é importante salientar que, embora os NADESs tenham promovido uma maior deslignificação do material, estes não apresentaram uma maior recuperação de compostos fenólicos totais (Figura 02). O Extrato que apresentou a maior concentração de CF (19,05 ± 0,94 mgEAG g-1extrato) foi o EtOH. Dentre os NADESs avaliados, o ChGuLa (10,93 ± 0,91 mgEAG g-1extrato) apresentou uma capacidade de extração superior ao ChLa (9,54 ± 0,52 mgEAG g-1extrato) e ao ChCaLa (6,90 ± 0,94 mgEAG g-1extrato), o que pode ser atribuído ao maior número de sítios formadores de ligação de hidrogênio, grupos hidroxilas (-OH), acrescidos pela presença das moléculas da glicose que compõem o sistema ternário ChGuLa.
Embora ainda cabíveis de otimização, os resultados aqui reportados se mostraram superiores aos de Sepúlveda et al. (2018), os quais, em sua melhor condição, obtiveram um extrato contendo 1,75 g L-1 (cerca de 1.75 mg g-1) de CF totais fazendo uso de um processo de autohidrólise. Já o estudo de Zampar et al. (2022) apresentou um extrato mais rico em CF totais (405.06 mg g-1), tendo sido este obtido por um processo em que uma mistura, 50:50 (v v-1) de etanol e ácido clorídrico (1 mol L-1), fora utilizada como agente extrator, a 60 ºC, em um processo assistido por micro-ondas (50 W por 30 min). Nesse mesmo contexto, o estudo de Vargas-sernas, Ochoa-Marínez e Vélez-Pasos (2022) obteve, em sua melhor condição de extração, um extrato rico em CF (7.98 mg g-1) por meio do uso de um DES à base de cloreto de colina e glicerol. Todos os trabalhos citados utilizaram o resíduo de abacaxi como fonte dos CF.
(a) amostra coletada; (b) amostra homogeneizada; (c) extratos obtidos.
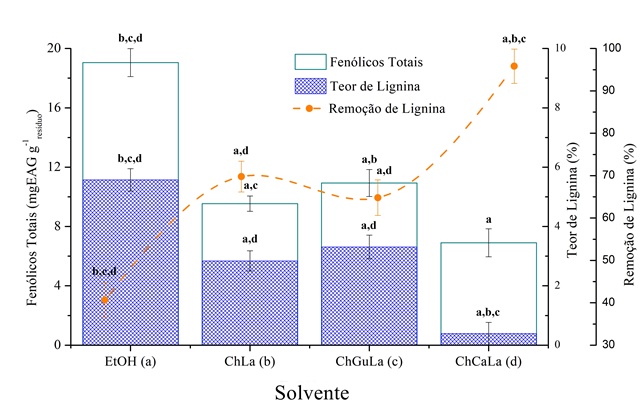
Nota: Diferentes letras (a,b,c,d) indicam diferentes valores (p < 0,05).
Conclusões
Os dados apresentados no presente trabalho se mostram promissores uma vez que, mesmo em condições não otimizadas, apresentaram-se satisfatório quando comparados ao que vem sendo reportado na presente literatura, a despeito das singularidades das matrizes avaliadas nas diferentes regiões onde foram coletadas. Ademais, é importante salientar que a substituição de ácidos inorgânicos e dos tradicionais solventes orgânicos, em processos de extração, configura-se como um desafio ainda latente dentro das perspectivas de construção de uma química verde de fato. Estudos de otimização das principais variáveis que influenciam a extração de compostos fenólicos pelos NADESs investigados, em especial o ChGuLa, serão conduzidos futuramente, bem como a avaliação da manutenção das atividades biológicas dos ativos extraídos.
Agradecimentos
Os autores agradecem à CAPES pelo suporte financeiro concedido, aos laboratórios parceiros pelo suporte técnico-instrumental e à participação no INCT-CiMol, financiado pelo CNPq.
Referências
ABBOTT, A. P.; CAPPER, G.; DAVIES, D. L.; RASHEED, R. K.; TAMBYRAJAH, V. Novel solvent properties of choline chloride/urea mixtures. Chemical Communications, no. 1, p. 70–71, 2003. https://doi.org/10.1039/b210714g.
AUGUSTI, P. R.; CONTERATO, G. M. M.; DENARDIN, C. C.; PRAZERES, I. D.; SERRA, A. T.; BRONZE, M. R.; EMANUELLI, T. Bioactivity, bioavailability, and gut microbiota transformations of dietary phenolic compounds: implications for COVID-19. Journal of Nutritional Biochemistry, vol. 97, 1 Nov. 2021. https://doi.org/10.1016/j.jnutbio.2021.108787.
CHEN, Y.; ZHANG, H.; FENG, X.; MA, L.; ZHANG, Y.; DAI, H. Lignocellulose nanocrystals from pineapple peel: Preparation, characterization and application as efficient Pickering emulsion stabilizers. Food Research International, vol. 150, 1 Dec. 2021. https://doi.org/10.1016/j.foodres.2021.110738.
DA COSTA LOPES, A. M.; BRENNER, M.; FALÉ, P.; ROSEIRO, L. B.; BOGEL-ŁUKASIK, R. Extraction and Purification of Phenolic Compounds from Lignocellulosic Biomass Assisted by Ionic Liquid, Polymeric Resins, and Supercritical CO2. ACS Sustainable Chemistry and Engineering, vol. 4, no. 6, p. 3357–3367, 6 Jun. 2016. https://doi.org/10.1021/acssuschemeng.6b00429.
DA COSTA, W. A.; DE FRANÇA, V. F.; DA SILVA SOUZA, L. S.; DE ANDRADE, A. S. A.; DE ARAÚJO, D. A. M.; MOREIRA, E. D. T.; PONTES, L. F. B. L. Physical–chemical and ecotoxic evaluation of different deep eutectic solvents for green analytical applications. Environmental Science and Pollution Research, vol. 30, no. 27, p. 70701–70712, 1 Jun. 2023. https://doi.org/10.1007/s11356-023-27398-z.
EL-MAATI, M. F. A.; MAHGOUB, S. A.; LABIB, S. M.; AL-GABY, A. M. A.; RAMADAN, M. F. Phenolic extracts of clove (Syzygium aromaticum) with novel antioxidant and antibacterial activities. European Journal of Integrative Medicine, vol. 8, no. 4, p. 494–504, 1 Aug. 2016. https://doi.org/10.1016/j.eujim.2016.02.006.
EMBRAPA - TABELA-PRODUÇÃO BRASILEIRA DE ABACAXI EM 2021 REGIÃO ÁREA QUANTIDADE RENDIMENTO PARTICIPAÇÃO FISIOGRÁFICA COLHIDA PRODUZIDA MÉDIO NA PRODUÇÃO (HA) (MIL FRUTOS) (FRUTOS/HA). Disponível em: < http://www.cnpmf.embrapa.br/Base_de_Dados/index_pdf/dados/brasil/abacaxi/b1_abacaxi.pdf>.
GLIGORIJEVIC, N.; RADOMIROVIC, M.; NEDIC, O.; STOJADINOVIC, M.; KHULAL, U.; STANIC-VUCINIC, D.; VELICKOVIC, T. C. Molecular mechanisms of possible action of phenolic compounds in covid-19 protection and prevention. International Journal of Molecular Sciences, vol. 22, no. 22, 1 Nov. 2021. https://doi.org/10.3390/ijms222212385.
Instituto Adolf Lutz. Métodos Físico-Químicos para Análise de Alimentos. São Paulo, 2008.
KHALIL, A.; TAZEDDINOVA, D. The upshot of Polyphenolic compounds on immunity amid COVID-19 pandemic and other emerging communicable diseases: An appraisal. Natural Products and Bioprospecting, vol. 10, no. 6, p. 411–429, 1 Dec. 2020. https://doi.org/10.1007/s13659-020-00271-z.
LAKKA, A.; GRIGORAKIS, S.; KARAGEORGOU, I.; BATRA, G.; KALTSA, O.; BOZINOU, E.; LALAS, S.; MAKRIS, D. P. Saffron processing wastes as a bioresource of high-value added compounds: Development of a green extraction process for polyphenol recovery using a natural deep eutectic solvent. Antioxidants, vol. 8, no. 12, 1 Dec. 2019. https://doi.org/10.3390/antiox8120586.
MALDONADE, I. R.; CARVALHO, P. G. B.; FERREIRA, N. A. Comunicado Técnico 85 Protocolo para determinação de açúcares totais em hortaliças pelo método de DNS. 2013. .
MIŠAN, A.; NAĐPAL, J.; STUPAR, A.; POJIĆ, M.; MANDIĆ, A.; VERPOORTE, R.; CHOI, Y. H. The perspectives of natural deep eutectic solvents in agri-food sector. Critical Reviews in Food Science and Nutrition, vol. 60, no. 15, p. 2564–2592, 21 Aug. 2020. https://doi.org/10.1080/10408398.2019.1650717.
PRADO, K. S.; SPINACÉ, M. A. S. Isolation and characterization of cellulose nanocrystals from pineapple crown waste and their potential uses. International Journal of Biological Macromolecules, vol. 122, p. 410–416, 1 Feb. 2019. https://doi.org/10.1016/j.ijbiomac.2018.10.187.
RICO, X.; GULLÓN, B.; ALONSO, J. L.; YÁÑEZ, R. Recovery of high value-added compounds from pineapple, melon, watermelon and pumpkin processing by-products: An overview. Food Research International, vol. 132, 1 Jun. 2020. https://doi.org/10.1016/j.foodres.2020.109086.
SANTOS, J.; TORRES, P.; CHOW, F.; SANTOS, D. Ensaio em microplaca de substâncias redutoras pelo método do Folin-Ciocalteu para extratos de algas Chemical characterization and biological activities of some native species of Gracilaria with economic importance View project. 2017. DOI 10.13140/RG.2.2.29127.80809.
SEPÚLVEDA, L.; ROMANÍ, A.; AGUILAR, C. N.; TEIXEIRA, J. Valorization of pineapple waste for the extraction of bioactive compounds and glycosides using autohydrolysis. Innovative Food Science and Emerging Technologies, vol. 47, p. 38–45, 1 Jun. 2018. https://doi.org/10.1016/j.ifset.2018.01.012.
SETHUPATHY, S.; MURILLO MORALES, G.; GAO, L.; WANG, H.; YANG, B.; JIANG, J.; SUN, J.; ZHU, D. Lignin valorization: Status, challenges and opportunities. Bioresource Technology, vol. 347, 1 Mar. 2022. https://doi.org/10.1016/j.biortech.2022.126696.
SLUITER, A.; HAMES, B.; RUIZ, R.; SCARLATA, C.; SLUITER, J.; TEMPLETON, D.; CROCKER, D. Determination of Structural Carbohydrates and Lignin in Biomass: Laboratory Analytical Procedure (LAP) (Revised July 2011). [S. l.: s. n.], 2008. Available at: http://www.nrel.gov/biomass/analytical_procedures.html.
VARGAS-SERNA, C. L.; OCHOA-MARTÍNEZ, C. I.; VÉLEZ-PASOS, C. Microwave-Assisted Extraction of Phenolic Compounds from Pineapple Peel Using Deep Eutectic Solvents. Horticulturae, vol. 8, no. 9, 1 Sep. 2022. https://doi.org/10.3390/horticulturae8090791.
ZAMPAR, G. G.; ZAMPAR, I. C.; BESERRA DA SILVA DE SOUZA, S.; DA SILVA, C.; BOLANHO BARROS, B. C. Effect of solvent mixtures on the ultrasound-assisted extraction of compounds from pineapple by-product. Food Bioscience, vol. 50, 1 Dec. 2022. https://doi.org/10.1016/j.fbio.2022.102098.
















