ÁREA
Química Analítica
Autores
Junior, C.A.C. (UFRN) ; Junior, E.D. (UFRN) ; Fernandes, N.S. (UFRN)
RESUMO
O presente trabalho estudou o processo de incorporaçãodaisoniazida (INH), um tuberculostático, utilizando a montmorilonita (Mt) como nanocarreador. O processo de incorporação do fármaco foi avaliado por meio de um planejamento fatorial 24, a fim de se investigar a influência de alguns fatores na intercalação do fármaco na estrutura. O experimento foi realizado utilizando a concentração mínima (0,05 mg/mL), maior massa de nanocarreador (100 mg), menor potencial hidrogeniônico (pH 2) e o tempo de 24 horas. Esses parâmetros foram os mais eficientesquando comparadosaos demais experimentos realizados, resultando em uma maior porcentagem de isoniazida incorporada. Na validação realizada a quantidade de fármaco incorporada foi de 95,60 ± 1,21%.
Palavras Chaves
Isoniazida; Montmorilonita; Planejamento
Introdução
A isoniazida (INH), também chamadade hidrazina de ácido isonicotínico, é um dos fármacos mais eficazes para o tratamento da tuberculose. Esse fármacopossuigrande seletividade em relação a algumas microbatérias, incluindo a Mycobacterium tuberculosis (que se trata da bactéria causadora da tuberculose).Além disso apresenta uma elevada capacidade bacteriostática, em outras palavras, a concentração mínima inibitória deste fármaco para o tratamento de bacterioses (doenças provocadas por bactérias) é de cerca de 0,05- 0,1 µg/mL. A INH é classificada como fármaco de classe IIIde acordo com o Sistema de Classificação Biofarmacêutica (BCS), sendo hidrofílica (solubilidade aquosa de 125 mg/mL a 25 °C) e pouco permeável (logP = -0,64 a 25 °C)[ADELEKE, 2018; H. D., 2015]. Por apresentar baixa permeabilidade, a isoniazida, assim como os demais antibióticos de primeira linha empregados no tratamento da tuberculose, é administrada em uma alta dosagem para que o fármaco alcance a eficácia desejada. Devido a isso, a INH pode apresentar efeitos colaterais graves, como neuropatia periférica, hepatotoxicidade, hematotoxicidade e outros efeitos adversos oriundos do uso prolongado da isoniazida, podendo resultar em fatalidades. Além disso, o composto orgânico apresenta uma diminuição da sua permeabilidade, que já é baixa, no estômago, devido à protonação ácida, o que influencia negativamente na sua biodisponibilidade e eficácia terapêutica[HAZRATI, 2017; ADELEKE, 2018]. Dessa forma, faz-se necessário a busca por novos sistemas de liberação para a INH, de modo a evitar efeitos adversos indesejados, proteger o fármaco da degradação no trato gastrointestinal, aumentar a sua biodisponibilidade e, consequentemente, melhorar a sua eficácia terapêutica[NKANGA, 2018]. Nessa perspectiva tem-se a possibilidade da utilizaçãode diferentes argilominerais, assim como nanopartículas de sílica como carreadores de fármacos, como por exemplo a montmorilonita. A montmorilonita (Mt) é um argilomineral do tipo 2:1, pertencente ao grupo das esmectitas. Possui uma estrutura organizada na forma de camadas, com uma carga negativa líquida entre -0,2 e -0,6 resultante de processos de substituições isomórficas aleatórios nas folhas de tetraedros e de octaedros. Para equilibrar essa carga negativa, a Mt apresenta em sua região interlamelar (entre camadas) cátions trocáveis como Na+, K+, Ca2+ e Mg2+, que geralmente encontram-se hidratados. Esse tipo de argilomineral incha facilmente, ocasionando na formação de géis com propriedades reológicas bem definidas, exibindo um comportamento pseudo-plástico. Além disso, possui capacidade de troca catiônica (80-150 mEq/100 g) e área específica elevada. Todas essas características fazem com que a montmorilonita seja aplicada no desenvolvimento de novos dispositivos híbridos para liberação modificada de fármacos[DAWSON, 2013; KIM, 2016; JAIN, 2014; OLIVEIRA, 2017; MORAES, 20176–10]. Os íons presentes na região interlamelar da montmorilonita são facilmente trocáveis por moléculas orgânicas, como fármacos, por meio de processos de troca catiônica. Sendo assim, é possível obter híbridos argila-fármaco através da intercalação dessas moléculas bioativas entre as camadas que compõem a estrutura do argilomineral [OLIVEIRA, 2017; MORAES, 2017; REBITSKI, 2019]. Além disso, Mt possui grupos silanol (Si-OH) em sua superfície externa, altamente sensíveis à presença de moléculas orgânicas, que fornecem a possibilidade de diferentes tipos de interações, como ligações de hidrogênio, interações íon-dipolo, ligações de coordenação, reações ácido-base, atração eletrostática e interações de Van der Waals. Essa rica variedade de interações possíveis sugere possibilidades interessantes para a entrega de biomoléculas[GHADIRI, 2015; RUIZ- HITZKY, 2013; RUIZ-HITZKY, 2010]. Sendo assim, o presente trabalho tem como objetivo principal a otimização do processo de incorporação de isoniazida no argilo mineral, montmorilonita, como etapa prévia no desenvolvimento de um sistema de liberação modificada. Essa incorporação será avaliada por meio de um planejamento fatorial, a fim de investigar a influência de alguns fatores no processo.
Material e métodos
2. Método (completo (3000 caracteres)) Materiais A montmorilonita (Mt) utilizada no presente trabalho foi a cloisite Na+ (BYK Additives&Instruments, Lote: 1603362), fornecida pela empresa Colormix Especialidades. A isoniazida (INH) foi gentilmente cedida pela empresa farmacêutica Amsal, por meio do Núcleo de Pesquisa em Alimentos e Medicamentos – NUPLAM/UFRN. O princípio ativo foi empregado neste trabalho como reagente padrão, visto que o mesmo apresentou pureza de 99,24%. A análise de pureza foi feita a partir do ponto de fusão do fármaco utilizando a Calorimetria Exploratória Diferencial (DSC) e aplicando-se a equação de Van’t Hoff. Os demais reagentes utilizados foram de grau analítico. Avaliação da eficiência de incorporação No desenvolvimento do presente do trabalho, avaliou-se a influência de alguns parâmetros operacionais no processo de incorporação da isoniazida em montmorilonita, por meio da aplicação de planejamento experimental 24 do tipo Delineamento Composto Central (DCC). Os parâmetros avaliados foram os seguintes: massa de Mt, concentração de INH, pH e tempo. O planejamento e a validação do modelo foram obtidos com o auxílio do software Protimiza Experimental Design. A Tabela 1 apresenta os valores utilizados no DCC para os quatros fatores descritos anteriormente. Em que “-1” e “+1” correspondem aos níveis inferiores e superiores, respectivamente, e “0” ao nível central, associados a cada parâmetro. O fator resposta (variável dependente) avaliado foi a “Quantidade de fármaco incorporada (%) – Y1”. A incorporação do fármaco no argilomineral foi realizada por meio de um processo de adsorção/troca catiônica. A montmorilonita foi pesada em um erlenmeyer de 250 mL. Em seguida, adicionou-se 100 mL da solução de fármaco, que teve o seu pH ajustado pela adição de HCl 1,0 mol/L. As amostras permaneceram sob agitação constante (180 rpm) a 25 ± 0,5 °C em uma incubadora (TECNAL, modelo TE-420) durante o tempo de contato pré-estabelecido. Ao final de cada experimento, uma alíquota de 15 mL da suspensão foi centrifugada (Centrífuga CENTRIBIO, modelo 08-2B) por 15 min a 4000 rpm e sua absorbância foi determinada com o auxílio de um espectrofotômetro, modeloUV-1800 da marca Shimadzuem comprimento de onda de265 nm. A eficiência de incorporação foi determinada pela equação abaixo (Equação 1). Eficiência de incorporação (%) = [(C0 – Ct)/C0] x 100 (Equação 1) Em que C0 é a concentração da solução de fármaco antes do processo de incorporação e Ct é a concentração da solução de fármaco após o processo de incorporação. A massa de fármaco incorporada em cada experimento foi determinada a partir das concentrações obtidas por meio de curva de calibração. A obtenção dessa curva seguiu o procedimento estabelecido na Resolução da Diretoria Colegiada (RDC) de número 166 da Agência Nacional de Vigilância Sanitária (ANVISABRASIL, 2017).
Resultado e discussão
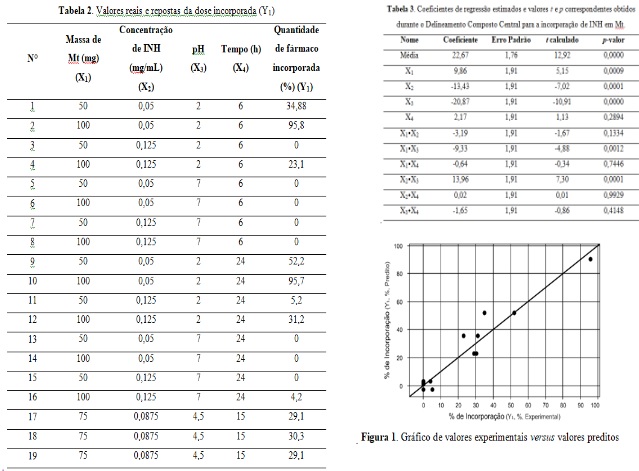
A Tabela 2 apresenta a matriz de planejamento, com os valores de resposta
(quantidade de fármaco incorporada %), obtidos em cada experimento.Como
observado, 19 experimentos foram realizados a partir da definição do
planejamento experimental, com o objetivo de obter-se a quantidade de fármaco
incorporada. As informações obtidas são inseridas no software Protimiza
Experimental Design para obtenção dos parâmetros estatísticos, conforme
indicados na Tabela 3, como também na geração do gráfico de valores
experimentais versus valores preditos, gráfico de Pareto e superfícies de
respostas.
A Tabela 3 apresenta os valores para os coeficientes, o erro padrão, o ponto de
distribuição de Student (t) e os p-valores (nível de significância) obtidos para
as variáveis estudadas por meio da técnica de regressão linear. Considerando um
nível de confiança de 95% e, consequentemente, um nível de significância de 5%,
temos que, para que o efeito principal de uma variável ou o efeito de interação
seja considerado significativo, o p-valor deve ser inferior a 0,05[NETOet al,
2010; RODRIGUES, 2014; de ASSIS, 2021]. Sendo assim, conforme observamos na
tabela, os efeitos X1, X2 e X3 e alguns efeitos de interação (X1•X3 e X2•X3)
podem ser considerados significativos.
A relação entre a resposta (variável dependente) e os quatro parâmetros
principais podem ser descritas por uma equação polinomial empírica de primeira
ordem[NETOet al, 2010; RODRIGUES, 2014; de ASSIS, 2021]. Sendo assim, a Equação
2 descreve a quantidade de INH incorporada pelo modelo em função das variáveis
que apresentaram significância estatística.
Y₁ = 22,67 + 9,86 x₁ - 13,43 x₂ - 20,87 x₃ - 9,33 x₁ x₃ + 13,96 x₂ x₃(Equação 2)
A Figura 1 apresenta o gráfico de ajuste do modelo teórico aos dados obtidos
experimentalmente. Podemos observar uma certa correlação, no qual não há pontos
muito distantes da reta. Sendo assim, pode-se inferir que existe uma boa
concordância entre os resultados experimentais e os resultados preditos pelo
modelo [NETOet al, 2010; RODRIGUES, 2014; de ASSIS, 2021].
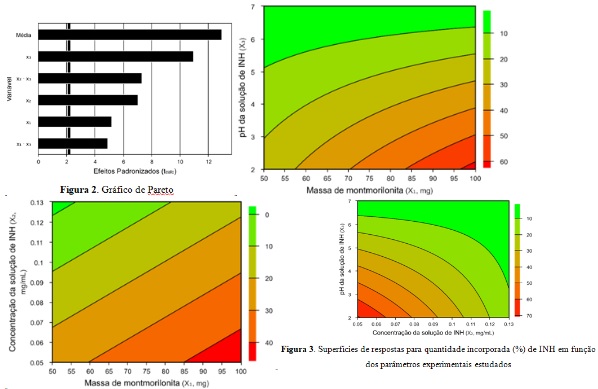
As significâncias analisadaspelos valores apresentados na Tabela 3 apresentada
anteriormentepodem ser atestadas por meio da análise do gráfico de Pareto
apresentado na Figura 2. A linha vertical representa o valor de t (ponto de
distribuição de Student) tabelado e as barras horizontal valores t calculados,
relacionados a cada variável, a um nível de confiança de 95%. Assim, conforme é
observado no gráfico, pode-sedizer que todos os efeitos principais X1, X2 e X3 e
alguns efeitos de interação podem ser considerados significantes, uma vez que as
barras estão acima do valor de t tabelado [NETOet al, 2010; RODRIGUES, 2014; de
ASSIS, 2021].
A Tabela 4 apresenta os valores para a análise de variância do modelo obtido no
presente trabalho.
Analisando a tabela apresentada anteriormente para a resposta Y1, verificamos
que a regressão foi altamente significativa com (p < 0,05). Para que o modelo
possa ser considerado estatisticamente válido, o F calculado para a regressão
deve ser maior que o valor de F tabelado. Já o F obtido para a falta de ajuste
deve ser menor que o valor de F tabelado[NETOet al, 2010; RODRIGUES, 2014; de
ASSIS, 2021; HASSANI, 2015].
O valor de F tabelado para a regressão, de acordo com os graus de liberdade para
a regressão e para os resíduos, é de 3,00 (nível de significância de 5%). Sendo
assim, é possível atestar que o modelo é estatisticamente válido, visto que o F
calculado para a regressão apresenta valor consideravelmente maior. OF tabelado
para a falta de ajuste, de acordo com os graus de liberdade para a falta de
ajuste e para o erro puro, é de 19,40 (nível de significância de 5%). Se o valor
de F calculado foimaior do que o tabelado, entretanto, isso não retira a
validade do modelo comprovada anteriormente[NETOet al, 2010; RODRIGUES, 2014].
Conforme Rodrigues e Iemma (2014), casos assim são observados quando a falta de
ajuste é baixa, mas o erro padrão tende a zero. Além disso, conforme apresentado
anteriormente na Figura 1, o ajuste do modelo aos dados experimentais é
satisfatório.
O modelo de regressão também apresentou um alto coeficiente de determinação (R2
= 95,46%), o que implica que 95,46% das variações na dose de INH incorporada
podem ser explicadas pelo modelo. Apenas 4,54% das variações não podem ser
explicadas. Esse valor, bastante satisfatório, também atesta a validade
estatística do modelo obtido. Sendo assim foram obtidas as superfícies de
reposta para o nosso modelo, que serão apresentadas a seguir[NETOet al, 2010;
RODRIGUES, 2014; de ASSIS, 2021; HASSANI, 2015].As superfícies de respostas
obtidas a partir do modelo são apresentadas na Figura 3.
Por meio da análise das superfícies de resposta e dos dados apresentados na
Tabela 1, pode-se observar que quanto maior a massa de montmorilonita, maior a
quantidade de fármaco incorporada. Damasceno-Junior et al. (2020)[JUNIOR,
2020]relataramresultados semelhantes ao avaliar a adsorção de isoniazida no
argilomineral palygorkista.
Em relação à concentração da solução empregada, observou-se que, quanto menor a
concentração de fármaco no meio, maior a quantidade incorporada. Quando se tem
um fármaco em uma concentração mais elevada, o número de moléculas de INH
disponíveis em solução para o total de sítios ativos do material é muito maior
quando comparado com o fármaco em menor concentração. Assim, quanto maior a
quantidade de moléculas no sistema, mais saturada fica a superfície e a região
interlamelar do argilomineral e, consequentemente, menor a quantidade de fármaco
incorporada [SILVA, 2018].
Por fim, em relação ao pH do meio, observou-se que quanto menor o valor de pH,
maior quantidade de fármaco incorporada. Para justificar essa forte influência
do pH no processo, pode-se calcular a fração molar da forma em que o fármaco se
encontra (forma catiônica, neutra ou aniônica) à um dado valor de pH por meio da
seguinte equação[FUKAHORI, 2011]:
α(%) = 100 – [100/1+10(pKa-pH)]
(Equação 3)
O pKa da molécula de isoniazida é de 1,82, correspondente ao nitrogênio do anel
heterocíclico piridínico[ALMEIDA, 2019; MASHHADI, 2016]. Esse nitrogênio é
rapidamente protonado em pH mais ácido, e a isoniazida se apresenta na forma
catiônica (INH+) em cerca de 39,8%.
A montmorilonita apresenta em sua região interlamelar cátions trocáveis. Como as
moléculas de INH encontram-se protonadas, a intercalação do fármaco ocorre por
meio de um processo de troca catiônica entre os cátions trocáveis e os cátions
INH+[OLIVEIRA, 2017; MORAES, 2017; REBITSKI, 2019]. Além disso, o argilomineral
apresenta em sua superfície grupos silanol e aluminol que se portam como bases
de Lewis, dado que o átomo de oxigênio é capaz de doar/compartilhar um par de
seus elétrons para estabelecer uma interação do tipo ácido-base. Além do mais,
esses grupos são altamente sensíveis à presença de grupos funcionais orgânicos,
porexemplo aqueles presentes em fármacos e/ou moléculas bioativas. Têm-se então,
que os grupos básicos presentes nas moléculas de INHprotonadas, as aminas,
interagiria de forma mais abrangente e mais bem estável com os grupos presentes
na superfície do argilomineral [JUNIOR et al, 2020; JUNIOR et al, 2020].
Para validar os resultados apresentados anteriormente, repetiu-se em triplicata
o processo nas condições otimizadas: massa de Mt de 100 mg, concentração de INH
de 0,05 mg/mL, pH 2 e tempo de 24 horas. A quantidade de fármaco incorporada foi
de 95,60 ± 1,21%.
Contém as tabelas 2 e 3, e a figura 1 do presente \r\ntrabalho.
Contém as figuras 2 e 3 do presente trabalho.
Conclusões
A partir dos resultados apresentados conclui-se que o processo de incorporação da isoniazida na montmorilonita é efetivo e ocorre majoritariamente por meio de troca catiônica com os cátions trocáveis na região interlamelar do argilomineral. Tal processo foi avaliado por meio de um planejamento fatorial, a fim de se investigar a influência de alguns fatores. O experimento utilizando a concentração mínima (0,05 mg/mL) de INH,maior massa de Mt (100 mg), pH mais baixo (pH 2) e tempo de 24 horasapresentou maioreficiência perante os demais ensaios realizados, resultando em uma maior quantidade de fármaco incorporada, equivalente a 95,60 ± 1,21%.
Agradecimentos
Referências
A. Hassani, R.D.C. Soltani, S. Karaca, A. Khataee, Preparation of montmorillonite-alginate nanobiocomposite for adsorption of a textile dye in aqueous phase: Isotherm, kinetic and experimental design approaches, J. Ind. Eng. Chem. 21 (2015) 1197–1207. doi:10.1016/j.jiec.2014.05.034.
A.S. Oliveira, A.C.S. Alcântara, S.B.C. Pergher, Bionanocomposite systems based on montmorillonite and biopolymers for the controlled release of olanzapine, Mater. Sci. Eng. C. (2017). doi:10.1016/j.msec.2017.03.044.
BRASIL, ANVISA. RDC no. 166, de 25 de Julho de 2017 - Guia para Validação de Métodos Analíticos e outras Providências, Diário Of. Da República Fed. Do Bras. (2017).
C.I. Nkanga, R.B. Walker, R.W. Krause, pH-Dependent release of isoniazid from isonicotinic acid (4-hydroxy-benzylidene)-hydrazide loaded liposomes, J. Drug Deliv. Sci. Technol. 45 (2018) 264–271. doi:10.1016/j.jddst.2018.03.016.
E. Damasceno Junior, J.M.F.D. Almeida, I.D.N. Silva, M.L. Moreira de Assis, L.M.D. Santos, E.F. Dias, V.E. Bezerra Aragão, L.M. Veríssimo, N.S. Fernandes, D.R. da Silva, pH-responsive release system of isoniazid using palygorskite as a nanocarrier, J. Drug Deliv. Sci. Technol. 55 (2020). doi:10.1016/j.jddst.2019.101399.
E. Damasceno Junior, J.M.F. De Almeida, I.D.N. Silva, M.L.M. De Assis, L.M. Dos Santos, E.F. Dias, F.E. Da Silva, N.S. Fernandes, D.R. Da Silva, Obtaining and Applying Nanohybrid Palygorskite-Rifampicin in the pH-Responsive Release of the Tuberculostatic Drug, Langmuir. (2020). doi:10.1021/acs.langmuir.0c01834.
E.P. Rebitski, G.P. Souza, S.A.A. Santana, S.B.C. Pergher, A.C.S. Alcântara, Bionanocomposites based on cationic and anionic layered clays as controlled release devices of amoxicillin, Appl. Clay Sci. 173 (2019) 35–45. doi:10.1016/j.clay.2019.02.024.
E. Ruiz-Hitzky, M. Darder, F.M. Fernandes, B. Wicklein, A.C.S. Alcântara, P. Aranda, Fibrous clays based bionanocomposites, Prog. Polym. Sci. (2013). doi:10.1016/j.progpolymsci.2013.05.004
E. Ruiz-Hitzky, P. Aranda, M. Darder, G. Rytwo, Hybrid materials based on clays for environmental and biomedical applications, J. Mater. Chem. (2010). doi:10.1039/c0jm00432d.
H. D., L. D., W. T., S. H., Z. P., L. B., Y. Y., M. Y., Y. F., W. D., Isoniazid conjugated poly(lactide-co-glycolide): Long-term controlled drug release and tissue regeneration for bone tuberculosis therapy, Biomaterials. 52 (2015) 417–425. doi:http://dx.doi.org/10.1016/j.biomaterials.2015.02.052.
I.D.N. Silva, J.M.F. de Almeida, S.P.M.C. de Souza, É.S. Oliveira, N.S. Fernandes, Proposta Metodológica De Avaliação Da Técnica Do Azul De Metileno Na Avaliação Da Qualidade Da Água., Holos. 6 (2018) 82–91. doi:10.15628/holos.2018.5558.
J.D.D. Moraes, S.R.A. Bertolino, S.L. Cuffini, D.F. Ducart, P.E. Bretzke, G.R. Leonardi, Clay minerals: Properties and applications to dermocosmetic products and perspectives of natural raw materials for therapeutic purposes—A review, Int. J. Pharm. (2017). doi:10.1016/j.ijpharm.2017.10.031.
J.I. Dawson, R.O.C. Oreffo, Clay: New opportunities for tissue regeneration and biomaterial design, Adv. Mater. (2013). doi:10.1002/adma.201301034.
J.M.F. de Almeida, E.D. Júnior, L.M. Verríssimo, N.S. Fernandes, pH-Dependent release system of isoniazid carried on nanoparticles of silica obtained from expanded perlite, Appl. Surf. Sci. 489 (2019) 297–312. doi:10.1016/j.apsusc.2019.05.317.
M. Ghadiri, W. Chrzanowski, R. Rohanizadeh, Biomedical applications of cationic clay minerals, RSC Adv. (2015). doi:10.1039/c4ra16945j.
M.H. Kim, G. Choi, A. Elzatahry, A. Vinu, Y. Bin Choy, J.H. Choy, Review of clay-drug hybrid materials for biomedical applications: Administration routes, Clays Clay Miner. (2016). doi:10.1346/CCMN.2016.0640204.
M.I. Rodrigues, A.F. Iemma, Experimental design and process optimization, 2014. doi:10.1201/b17848.
M.K. Hazrati, Z. Bagheri, A. Bodaghi, Application of C30B15N15heterofullerene in the isoniazid drug delivery: DFT studies, Phys. E Low-Dimensional Syst. Nanostructures. 89 (2017) 72–76. doi:10.1016/j.physe.2017.02.009.
M.L.M. de Assis, E.D. Junior, J.M.F. de Almeida, I. do Nascimento Silva, R.V. Barbosa, L.M. dos Santos, E.F. Dias, N.S. Fernandes, C.A. Martinez-Huitle, Photocatalytic degradation of Novacron blue and Novacron yellow textile dyes by the TiO2/palygorskite nanocomposite, Environ. Sci. Pollut. Res. 28 (2021) 64440–64460. doi:10.1007/s11356-021-15519-5.
O.A. Adeleke, P.C. Tsai, K.M. Karry, N.O. Monama, B.B. Michniak-Kohn, Isoniazid-loaded orodispersible strips: Methodical design, optimization and in vitro-in silico characterization, Int. J. Pharm. 547 (2018) 347–359. doi:10.1016/j.ijpharm.2018.06.004.
R.E. Barros Neto, B., Scarmino, I. S., & Bruns, Como fazer experimentos: pesquisa e desenvolvimento na indústria, 2010.
S. Fukahori, T. Fujiwara, R. Ito, N. Funamizu, PH-Dependent adsorption of sulfa drugs on high silica zeolite: Modeling and kinetic study, Desalination. (2011). doi:10.1016/j.desal.2011.03.006.
S. Jain, M. Datta, Oral extended release of dexamethasone: Montmorillonite-PLGA nanocomposites as a delivery vehicle, Appl. Clay Sci. 104 (2015) 182–188. doi:10.1016/j.clay.2014.11.028.
S.M.A. Mashhadi, U. Yunus, M.H. Bhatti, I. Ahmed, M.N. Tahir, Synthesis, characterization, solubility and stability studies of hydrate cocrystal of antitubercular Isoniazid with antioxidant and anti-bacterial Protocatechuic acid, J. Mol. Struct. (2016). doi:10.1016/j.molstruc.2016.03.057.
















