ÁREA
Físico-Química
Autores
Maciel, N.C. (UFVJM) ; Santos, M.J.A. (UFVJM) ; Ribeiro, J.K.L. (UFVJM) ; Oliveira Júnior, W. (UFVJM) ; Vieira, L.H.O.C. (UFVJM) ; Pinto, H.C. (EESC-USP) ; Silva, E.P. (UFVJM)
RESUMO
Existe um acordo quanto à necessidade da transição energética, e o hidrogênio emerge como uma alternativa promissora. Uma maneira de gerar esse gás é através da hidrólise do magnésio, o qual requer aumento da superfície de contato do metal com a solução e controle da formação da camada de hidróxido formada na superfície do metal durante a reação. Nesse contexto, o estudo atual empregou cavacos de magnésio produzidos por meio do método de deformação plástica severa em soluções contendo cloreto de sódio, com concentração equivalente à água do mar, ácido cítrico, que é um ácido orgânico não tóxico e ambos. Os métodos resultaram em um rendimento de aproximadamente 97% na produção de hidrogênio em menos de três minutos de reação ao usar uma solução contendo 5,0% em massa de ácido cítrico.
Palavras Chaves
Hidrólise do Magnésio; Produção de Hidrogênio; Hidrogênio
Introdução
A crescente dependência da energia fóssil é preocupante devido à finitude dos recursos e aos problemas ambientais causados pela emissão excessiva de dióxido de carbono. Para enfrentar esse desafio global, há um consenso sobre a necessidade urgente de adotar fontes de energia limpas e renováveis, com potencial para mitigar os impactos ambientais e combater as mudanças climáticas (HOLECHEK et al., 2022). Neste contexto, o hidrogênio surge como uma alternativa promissora para impulsionar a transição energética (XIAO et al., 2023). Embora seja o elemento mais abundante, ele é encontrado geralmente combinado com outros elementos, requerendo processos para isolá-lo como gás diatômico, H2. O desafio reside em tornar a produção de hidrogênio eficiente e econômica para competir com os combustíveis fósseis. Atualmente, a hidrólise, especialmente com o uso de magnésio devido à sua alta capacidade de oxidação e baixo custo, tem se destacado como uma opção ecológica para produzir hidrogênio, gerando também hidróxido de magnésio como subproduto, uma substância sustentável e reciclável (AWAD et al., 2016). O desafio na hidrólise do magnésio é a formação de uma camada de hidróxido que interrompe a reação, exigindo medidas para aumentar a eficiência. Para superar esse obstáculo, é crucial dissolver essa camada para obter um rendimento superior, e embora o uso de ácidos seja eficaz, preocupa-se com sua toxicidade e impacto ambiental, destacando a importância de ácidos ecologicamente seguros. (XIAO et al., 2023). Outra alternativa para aumentar o rendimento é a ampliação da área de superfície, sendo que a moagem de bolas demonstrou eficácia ao reduzir o tamanho das partículas de magnésio, resultando em maior produção de hidrogênio (WU et al., 2023). Contudo, esse procedimento é oneroso e perigoso, requerendo precauções devido a propriedades pirofóricas do pó de magnésio, que exige uma atmosfera inerte, tornando-o um processo caro e demorado (SILVA et al., 2020). Diante desse cenário, há uma necessidade evidente de encontrar uma abordagem alternativa mais econômica e segura para aprimorar a eficiência da hidrólise do magnésio na produção de hidrogênio. Uma alternativa promissora é o uso do método Severe Plastic Deformation (SPD), ou Deformação Plástica Severa. Esse procedimento é uma abordagem mais simples e direta para o refinamento de grãos em metais. Através dessa técnica, é possível produzir grãos ultrafinos e até estruturas nanocristalinas com defeitos. (SILVA et al., 2020; JORGE et al., 2014). O método SPD promove o refinamento da estrutura cristalina do material. Essa abordagem oferece várias vantagens, como um processo eficiente e menos custoso, bem como uma redução nos riscos associados ao manuseio e ao armazenamento dos cavacos de magnésio gerados, já que estes não são pirofóricos. (SILVA et al., 2020). Mas ainda assim uma camada de hidróxido de magnésio pode se formar na superfície do magnésio, interrompendo a reação e causando estagnação. No entanto, a introdução de uma substância capaz de dissolver essa camada pode aumentar consideravelmente a velocidade e a eficiência da reação (OZ et al., 2017). Embora os ácidos sejam eficazes para esse propósito, a consideração da sustentabilidade ambiental é crucial. Nesse contexto, a escolha de um ácido orgânico e não tóxico é mais adequada. O ácido cítrico, também conhecido como ácido 2-hidroxi-1,2,3-propanotricarboxílico, é um exemplo que atende a esses critérios. Este ácido fraco possui a fórmula molecular C6H8O7 e é naturalmente encontrado em diversas frutas, como laranjas e limões (UAN et al., 2019). Além disso, uma solução de cloreto de sódio com concentração equivalente à da água do mar (3,5% m/m) foi utilizada, demonstrando ser uma alternativa acessível e quase inesgotável. (UAN et al., 2019) O uso do cloreto de sódio tem o benefício de retardar a formação da camada passiva que envolve o magnésio, uma vez que os cátions dos sais reagem com as hidroxilas, inibindo a formação de hidróxido de magnésio (XIAO et al., 2023) e o íon cloreto contribui para a indução da corrosão por pites, o que aumenta o rendimento da reação (AWAD et al., 2016). Dessa forma, o objetivo deste trabalho é produzir hidrogênio de forma rápida e ecológica, sem a necessidade de maquinário ou energia elétrica. A diminuição do tamanho das partículas é alcançada por meio da produção de cavacos de magnésio, enquanto o meio corrosivo é obtido com a utilização de solução de ácido cítrico e cloreto de sódio (3,5% m/m). Essa combinação pode levar a uma significativa melhoria no rendimento e na cinética da reação. Para fins de comparação, foi testada solução contendo apenas cloreto de sódio e soluções de ácido cítrico na presença e ausência do cloreto de sódio.
Material e métodos
- PREPARAÇÃO DOS CAVACOS DE MAGNÉSIO A obtenção dos cavacos de magnésio iniciou com o uso de uma barra de magnésio puro como matéria-prima. Essa barra foi submetida a um processo de deformação plástica severa (SPD), a qual removeu finas camadas de magnésio da barra, resultando nos cavacos de magnésio desejados. Para garantir a qualidade das amostras obtidas, a primeira camada retirada da barra foi descartada, a fim de evitar a utilização de cavacos que poderiam estar oxidados devido à exposição ao ar. Cada conjunto de cavacos foi pesado até atingir 0,5g. - PREPARAÇÃO DAS SOLUÇÕES Uma solução de cloreto de sódio foi preparada apresentando uma concentração de 3,5% m/m. Também foram preparadas duas soluções contendo ácido cítrico em concentrações distintas, uma com 2,5% m/m e outra com 5,0% m/m, ambas com adição de cloreto de sódio na concentração de 3,5% m/m. Por último foi preparada uma solução de 5,0% m/m de ácido cítrico. Para todas as soluções usou-se água destilada. - MEDIÇÃO VOLUME DE GÁS HIDROGÊNIO O método utilizado para medir a quantidade de hidrogênio gerado envolveu o uso de um cilindro graduado, o qual registrou o deslocamento da água. Esse cilindro graduado possibilitou a quantificação do volume de hidrogênio liberado durante a reação. As medições foram realizadas em centímetros de deslocamento e, posteriormente, convertidas para volume, levando em conta o volume correspondente a 1cm no cilindro graduado. Em seguida, o volume obtido foi transformado em rendimento de conversão, calculado a partir do volume produzido em relação ao teórico, determinado a partir da equação 1. Mg(s) + H2O(l) → H₂(g) + Mg(OH) 2(s) (Equação 1) Para a análise dos dados, foram elaborados gráficos que relacionaram o rendimento de conversão de hidrogênio com o tempo decorrido e cada experimento referente a uma variável específica foi conduzido em triplicata.
Resultado e discussão
As amostras foram preparadas via processo SPD, resultando em cavacos de magnésio
com diversas formas e tamanhos. Em geral, esses cavacos exibem uma configuração
alongada e apresentam vincos devido ao processo, como observado na figura 1.
Cada cavaco possui um lado liso e outro com lamelas micrométricas, que aumentam
a área de superfície de contato do magnésio com a solução, como previsto por
SILVA et al., 2020 e JORGE et al., 2014. Importante notar que, ao contrário das
amostras produzidas por moagem de bolas, os cavacos de magnésio obtidos pelo
método de SPD não são pirofóricos, eliminando a necessidade de armazenamento em
atmosfera controlada.
Para a hidrólise com rendimento de 100% de 0,5g de magnésio é esperada a
produção de 466mL de hidrogênio, de acordo com os cálculos teóricos considerando
a equação 1 e de acordo com RODRÍGUEZ et al., 2023. Na reação dos cavacos de
magnésio com 3,5% m/m de NaCl (conforme ilustrado na figura 2.a), a produção de
hidrogênio à temperatura ambiente atingiu cerca de 50% da teoria após um período
de dez horas de reação. Esses resultados indicam que a presença de íons cloreto
retarda a formação de hidróxido de magnésio, pois faz ocorrer a oxidação por
corrosão localizada (conhecida como "pite"), formando canais na camada de
passivação que permitem à água reagir com o magnésio, além de produzir cloreto
de magnésio (MgCl₂) solúvel em água como subproduto, como sugerido por “AWAD et
al., 2016”. A escolha da concentração de 3,5% m/m de cloreto de sódio foi
baseada na concentração encontrada na água do mar, justificando o uso de uma
fonte praticamente inesgotável e mostrando não ser necessário o uso de água
potável para tais reações (UAN et al., 2019). A comparação do resultado obtido
com aqueles alcançados por estudos que empregam moinho de bola com adição de
cloreto de sódio revela que, apesar de ser mais eficiente na produção de
hidrogênio, principalmente em relação a cinética, o uso do moinho de bola
demanda um consumo significativo de energia, prolongados períodos de moagem e a
necessidade de armazenar os pós de magnésio em ambiente inerte (SHETTY et al.,
2020). Esses fatores tornam a produção mais desafiadora, levando à consideração
de possíveis alternativas, como o uso de cavacos e ácidos.
Na reação com ácido cítrico e cloreto de sódio, representado pelo gráfico da
figura 2.b, o rendimento mostrou-se altamente promissor, alcançando 85,5% em
apenas oito minutos de reação, utilizando uma concentração de 2,5% m/m de ácido
cítrico e 3,5% m/m de cloreto de sódio. Isso se traduz em uma quantidade
considerável de hidrogênio produzido em um curto período. A concentração de 2,5%
m/m de ácido cítrico foi determinada por cálculos estequiométricos com base na
reação do ácido cítrico com hidróxido de magnésio, mostrada na equação 2,
considerando a ionização dos três hidrogênios do ácido cítrico, para a
quantidade de magnésio e solução utilizados.
2C6H8O7(aq) + 3Mg(OH)2(aq) ->
Mg3(C6H5O7)2(aq) +
6H2O(l) (Equação 2)
Para avaliar a influência do aumento da concentração de ácido cítrico nos
rendimentos, os resultados foram comparados com aqueles obtidos utilizando
solução contendo 5,0% m/m de ácido cítrico e 3,5% m/m de cloreto de sódio. Os
resultados mostraram um aumento inicial da cinética e rendimento com o aumento
da concentração de ácido, atingindo um pico de aproximadamente 99% de rendimento
em menos de 3 minutos, após o qual houve uma diminuição do rendimento para
aproximadamente 97% aos 10min de reação. Esse fenômeno é atribuído à natureza
exotérmica da reação, que se torna mais evidente com o aumento da concentração
de ácido cítrico, levando à produção de vapor de água. Após um determinado
período, o sistema foi resfriado naturalmente, condensando o vapor de água e
revelando o rendimento real da reação.
Também foi examinado o efeito do cloreto de sódio na reação, visando determinar
se a presença do sal contribui para a cinética e o rendimento da reação. Isso se
baseia na sugestão de que a presença de NaCl, em conjunto com o ácido cítrico,
pode ter um efeito positivo, aprimorando a velocidade e o rendimento da
hidrólise do magnésio, como sugerido por AWAD et al., 2016. Para essa análise,
comparamos a solução contendo 5% m/m de ácido cítrico e 3,5% m/m de NaCl com
aquela que continha apenas os 5% m/m de ácido cítrico. Como representado no
gráfico na figura 2.c, podemos observar diferenças na cinética da reação,
indicando que a presença dos íons do sal facilita a hidrólise. No entanto, em
relação ao rendimento, observamos que, independentemente da presença do cloreto
de sódio, o rendimento da reação permanece o mesmo, demonstrando que o uso do
ácido cítrico permite a utilização tanto da água pura quanto da água do mar, sem
afetar negativamente o rendimento do processo.

Microscopia óptica dos cavacos de magnésio
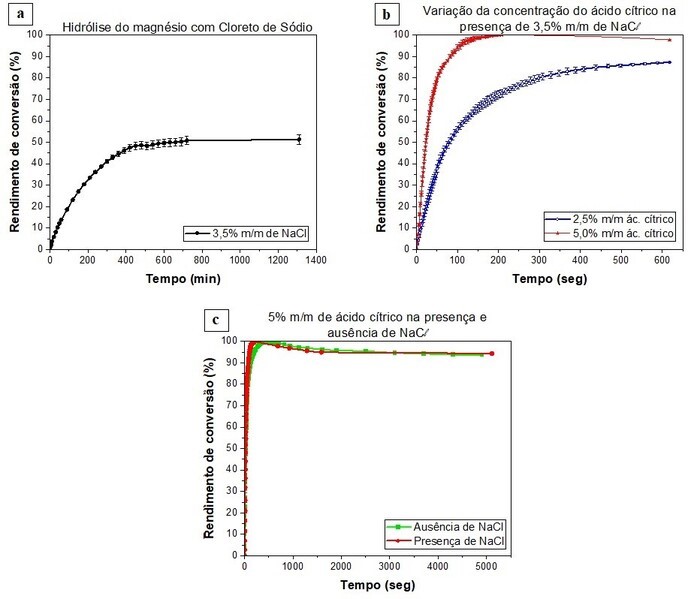
Gráficos rendimento de conversão da produção de \r\n\\r\\nhidrogênio por tempo em solução de a)NaCl \r\nb)ácido \\r\\ncítrico e c)ácido cítrico com e sem NaCl
Conclusões
CONCLUSÕES • É possível produzir hidrogênio de maneira segura, simples e eficiente usando cavacos de magnésio. • A produção de hidrogênio a partir de cavacos de magnésio, em água com cloreto de sódio (3,5% m/m) obteve rendimento de aproximadamente 50%. • A reação com ácido cítrico (2,4% m/m) e cloreto de sódio (3,5% m/m) obteve um rendimento de cerca de 85% na produção de hidrogênio em apenas 8 minutos . • Ao aumentar a concentração de ácido cítrico para 5,0% m/m, se obteve um rendimento de aproximadamente 97% na produção de hidrogênio em menos de 3 minutos de reação, independentemente da presença de cloreto de sódio.
Agradecimentos
Agradecemos à FAPEMIG e CAPES pelo apoio financeiro neste trabalho, ao PPGQ-UFVJM, EESC-USP e ao grupo de pesquisa em Magnésio e Hidrogênio da UFVJM-Janaúba.
Referências
AWAD, A.S.; EL-ASMAR, E.; TAYEH, T.; MAUVY, F.; NAKHL, M.; ZAKHOUR, M.; BOBET, J.-L. Effect of carbons (G and CFs), TM (Ni, Fe, and Al) and oxides (Nb2O5 and V2O5) on hydrogen Generation from ball milled Mg-based hydrolysis reaction for fuel cell. Elsevier Science Direct Journals Energy (Oxford), v. 95, p.175-186, 2016.
HOLECHEK, JERRY L.; GELI, HATIM M. E.; SAWALHAH, MOHAMMED N.; VALDEZ, RAUL. A Global Assessment: Can Renewable Energy Replace Fossil Fuels by 2050?. Sustainability, v.14(8), p. 4792, 2022.
JORGE, ALBERTO MOREIRA; FERREIRA DE LIMA, GISELE; MARTINS TRIQUES, MARIA REGINA; BOTTA, WALTER JOSÉ; KIMINAMI, CLAUDIO SHYINTI; NOGUEIRA, RICARDO PEREIRA; YAVARI, ALAIN REZA; LANGDON, TERENCE G. Correlation between hydrogen storage properties and textures induced in magnesium through ECAP and cold rolling. International journal of hydrogen energy, v.39 (8), p.3810-3821, 2014.
OZ, CISEM; FILIZ, BILGE COSKUNER; FIGEN, AYSEL KANTURK. The effect of vinegar–acetic acid solution on the hydrogen generation performance of mechanochemically modified Magnesium (Mg) granules. Energy (Oxford), v.127, p.328-334, 2017.
RODRÍGUEZ, MARÍA; URRETAVIZCAYA, GUILLERMINA; BOBET, JEAN-LOUIS; CASTRO, FACUNDO J. Effective hydrogen production by hydrolysis of Mg wastes reprocessed by mechanical milling with iron and graphite. Journal of alloys and compounds, v.946, p.169352, Article 169352, 2023.
SHETTY, TAKSHAK; SZPUNAR, JERZY A.; FAYE, OMAR; EDUOK, UBONG. A comparative study of hydrogen generation by reaction of ball milled mixture of magnesium powder with two water-soluble salts (NaCl and KCl) in hot water. International journal of hydrogen energy, v.45 (48), p.25890-25899, 2020.
SILVA, E.P.; LEIVA, D.R.; FLORIANO, R.; OLIVEIRA, V.B.; PINTO, H.C.; BOTTA, W.J. Hydrogen storage Properties of filings of the zk60 alloy modified with 2.5 wt% mischmetal. International jornal of hydrogen energy, v.45(8), p.5375-5383, 2020.
UAN, JUN-YEN; YU, SHIH-HAO; LIN, MENG-CHANG; CHEN, LI-FAN; LIN, HENG-L. Evolution of hydrogen from magnesium alloy scraps in citric acid-added seawater without catalyst. International jornal of hydrogen energy, v.34(15), p.6137-6142, 2019.
XIAO, FEI; WU, TIANZHAO; YANG, YONGXIA. Research progress in hydrogen production by hydrolysis of magnesium-based materials. International jornal of hydrogen energy, 2023.
WU, CHAOLING; HUANG, QIN; GONG, BINGSHOU; ZHOU, JI; XIA, GUANGHUI; HE, FANGNAN; WANG, YAO; YAN, YIGANG; CHEN, YUNGUI. Hydrolysis enhancing mechanisms of Mg-based alloys/hydrides from perspectives: Electrochemical corrosion, active sites, mass transfer, and kinetics. Journal of materials Science & technology, v.163, p.1-16, 2023.
















