ÁREA
Química Inorgânica
Autores
Assunção, R.J.Q. (UNIVERSIDADE FEDERAL DO SUL E SUDESTE DO PARÁ) ; Nascimento, R.S. (UNIVERSIDADE FEDERAL DO SUL E SUDESTE DO PARÁ) ; Saldanha, L.S. (UNIVERSIDADE FEDERAL DO PARÁ) ; Figueira, B.A.M. (UNIVERSIDADE FEDERAL DO OESTE DO PARÁ)
RESUMO
Nesse trabalho, apesenta-se os resultados da análise do comportamento termal por TGA, DRX e FTIR de zeolita natural escolecita proveniente do município de Feliz (RS). Os resultados da TG indicaram uma desidratação em duas etapas que leva a um favorecimento da cristalinidade e aumento nos parâmetros de rede, assim como a passagem por uma fase amorfa até sua recristalização em anortita e quartzo. O espectro FTIR mostrou bandas de estiramento TO4 exclusivas de escolecita.
Palavras Chaves
Anáise Termal; Escolecita; Zeolita Natural
Introdução
Zeolitas naturais são compostos inorgânicos formados por blocos de construção de tetraedros TO4 (T= Al e Si) com largos canais e vazios interconectados formando estruturas microporosas bem desenvolvidas e ordenadas com moléculas moveis de água e cátions, mono e divalentes (TSCHERNICH, 1992; RHODES, 2010). Devido a sua estrutura cristalina as zeolitas apresentam uma grande capacidade de absorção de água e liberação da mesma quando aquecidas, processo que aumenta o volume de vazios e influência no seu uso como peneiras moleculares e adsorventes (MOSHOESHOE et. al., 2017; DERBE et. al., 2021). A zeólita escolecita Ca8Al16Si24O80⋅24H2O) é um mineral fibroso que compõem o grupo da Natrolita. Sua estrutura e formada por dois sistemas de canais de 8 anéis TO4 (T= Al e Si) interligados nas direções [100] e [001] além de moléculas de água e cátions Ca2+ trocáveis nos microporos. Sua ocorrência pode ser verificada em ambientes geológicos como cavidades em basaltos, gnaisses e anfibolitos, assim como lacólitos e diques derivados de magmas sieníticos e gabróicos (COMODI et. al., 2002; PRASAD et. al., 2006). O processo de calcinação promove a remoção de moléculas de H2O, que leva a um aumento da área especifica da superfície e volume dos poros, isso resulta em uma maior interação dos cátions com as cavidades zeolíticas, favorecendo os processos catalíticos e outras interações químicas. Em razão de suas propriedades químico-mineral de desidratação, transformação para meta-escolecita seguida de uma fase amorfa, que recristaliza a uma temperatura mais elevada em anortita e quartzo (PRASAD ET. AL.., 2005) e reidratação, que favorecem processos de troca iônica, sua abundância na Bacia do Paraná (região sul do Brasil) o baixo custo de obtenção comparado a outros materiais utilizados habitualmente aliado a “simplicidade” do processo de calcinação, fazem da zeolita natural escolecita um interessante material de baixo custo para adsorção de corantes aniônicos e catiônicos, compostos nitrogenados como NH3 e metais tóxicos como Mn2+, Cd2+, Ni2+, Pb2+, Cu2+, Zn2+ e Co2+ (BOSSO E ENZWEILER, 2002; JIMIREZ et. al., 2005; DERBE et. al., 2021; PRASAD et. al., 2005). Este trabalho, apresenta um estudo sobre a decomposição térmica da zeólita natural escolecita, do municio de Feliz (RS), para posteriormente ser aplicada com adsorvente na remoção de corantes aniônicos e catiônicos em solução aquosa. Para a caracterização da zeolita foram empregadas as técnicas analíticas de difração de raio X (DRX), análise térmica (TG-DSC) e infravermelho (FTIR).
Material e métodos
2.1 AMOSTRA A amostra natural de escolecita investigada neste trabalho foi coletada manualmente em trabalhos de campo pelo Prof. Dr. Antônio C.S.N.P de Oliveira, no município de Feliz (Rio Grande do Sul). A amostra foi pulverizada manualmente em um grau de ágata e caracterizada por DRX e FTIR. Posteriormente foi submetida a aquecimento em mufla de 200ºC a 1000ºC, com intervalos de temperatura de 100ºC por 1 hora. 2.2 CARACTERIZAÇÃO O aquecimento da amostra foi feito em mufla da marca MARCONI com capacidade de temperatura de até 1600ºC. A escolecita natural e cada fase de aquecimento foram analisadas por um difratometro da marca Rigaku TTRAX de ânodo rotatório, utilizando tubo de radiação de Cu (CuKα = 1.5406 Å) e ângulo de varredura de 5° a 70°. O espectro de FTIR foi obtido usando um espectrofôtometro, da marca Agilent, modelo CARY 630 com reflectância atenuada (ART), varredura 600 a 4000 cm-1. A análise térmica foi obtida em um Módulo de Termogravimetria, modelo DTG-60 Shimadzu. As análises foram feitas em um cadinho de platina, com aquecimento de 20°C/min, temperatura inicial e final variando de 20°C a 1600°C e fluxo de nitrogênio 50 mL.min.
Resultado e discussão
A figura 1 ilustra os dados de TG-DSC. A curva TG sugere que a desidratação
ocorre em duas etapas correspondentes a perca de duas moléculas de água na
estrutura. A primeira curva ocorre em cerca de 200°C, e a segunda curva a cerca
de 400°C°. Dentro do intervalo de temperatura de 0ºC a 600°C, como mostra o
gráfico, a amostra perdeu um total de 2,01mg de massa, estando de acordo com
GHAN et al., (2015).
Os padrões difratométricos da escolecita aquecida até 1000ºC são ilustrados na
Figura 2 e 3. Os picos característicos do mineral (JCPDS 01-075-1456) presentam-
se nítidos e intensos demonstrando um excelente grau cristalinidade. Em 100ºC,
os parâmetros de rede calculados foram: α = 6,51 b = 18,91 Å, c =
9,75 Å, V = 1136 Å3 e grupo espacial Cc do sistema cristalino
monoclínico (Mattioli et al., 2016). O valor dado pela largura a meia altura
(FWHM = 0,138) revela um bom ordenamento da estrutura da zeolita, cujo tamanho
médio do cristalito foi de 66,54 nm (calculado pela equação de Scherrer). Foi
possível observar que o aumento da temperatura favoreceu a cristalinidade da
escolecita, e isso é confirmado pela FWHM = 0,077 e tamanho médio do cristalito
de 99,27 nm, a 400ºC. Ainda foi possível observar que nessa mesma temperatura os
parâmetros de rede tiveram um leve aumento sendo α = 6,51 b = 18,93 Å,
c = 9,76 Å, V = 1137 Å3. Entre 500ºC até 900ºC é considerada
amorfa, e sua recristalização ocorre a partir de 1000ºC, que de acordo com
Reeuwijk, L.P. Van (1972) a escolecita se recristaliza em plagioclásio cálcico
do tipo anortita e em quartzo.
O espectro FTIR da escolecita em temperatura ambiente é mostrado na Figura 4. As
bandas entre 926 a 1098 cm-1 são características dos modos de
estiramento Si(Al)-O da rede tetraedro, indicam uma estrutura altamente ordenada
da escolecita. Um modo deformacional em anel de quatro tetraedros Si(Al)-O na
estrutura é observado em torno de 717 cm-1, juntamente com outros
modos em 692, 671, 631, 602, 496 e 426 cm-1. As bandas em 1646 e 1662
-1 correspondem aos modos vibracionais das moléculas de água. Os
estiramentos das moléculas de H2O são observados na região entre 3226
a 3578 -1 (MOZGAWA, 2001; PRASAD et. al., 2006).
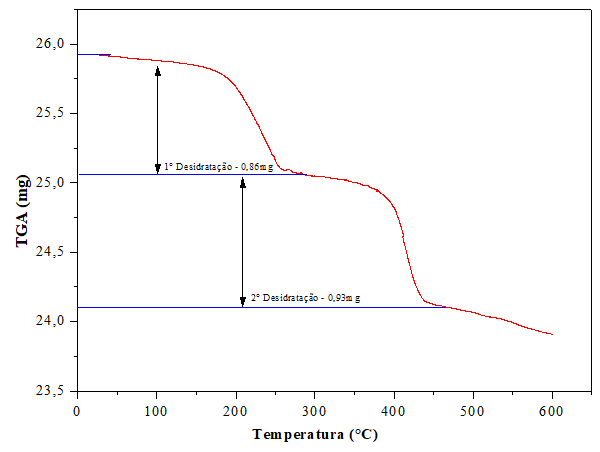
Curvas de TG da escolecita demostrando as temperaturas de desidratação e a quantidade de massa perdida em cada uma.
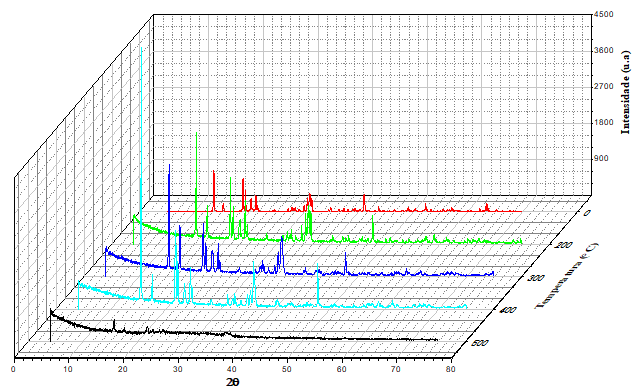
Padrões difratométricos da escolecita a temperaturas de 0°C em vermelho; 200°C em verde, 300°C em azul, 400°C em ciano e 500°C em preto.
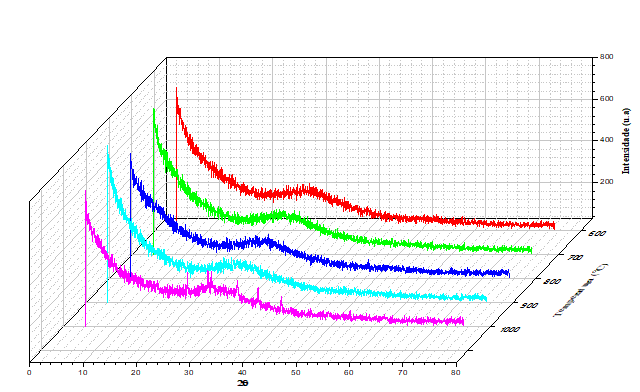
Padrões difratométricos da escolecita a temperaturas de 600°C em vermelho, 700°C em verde, 800°C em azul, 900°C em ciano e 1000°C em magenta.
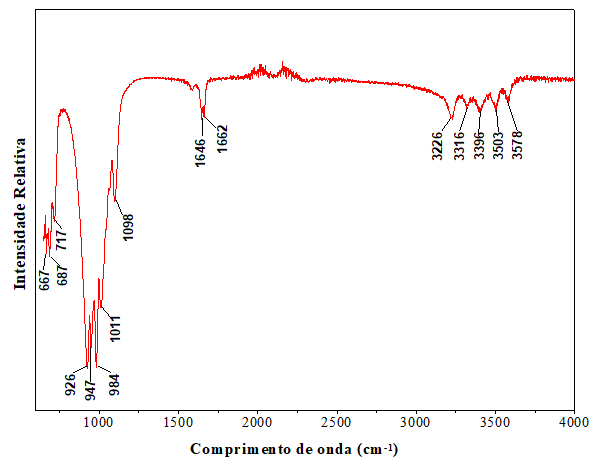
Espectro de FTIR da escolecita.
Conclusões
A análise do comportamento termal mostra que o processo de aquecimento foi efetivo, pois, a TGA até uma temperatura de 600°C mostra que ocorre desidratação com perda de duas moléculas de H2O na estrutura. Na análise de DRX e evidenciado que essa alteração na estrutura leva a um favorecimento na cristalinidade do mineral, confirmado pela FWHM = 0,077 e tamanho médio do cristalito de 99,27 nm e aumento nos parâmetros de rede a 400ºC, as demais temperaturas analisadas representam uma fase a morfa entre 500°C a 900°C e o início da recristalização em 1000°C. Para a zeolita do tipo escolecita em temperatura ambiente, bandas exclusivas no espectro de FTIR mostraram estiramentos referentes aos tetraedros de SiO4 que forma a unidade básica estrutural do mineral.
Agradecimentos
Os autores agradecem ao laboratório de caracterização mineral (LCM) da UFPA. Ao laboratório de análises química e ao laboratório de caracterização estrutural, ambos pertencentes a UNIFESSPA.
Referências
BOSSO, S. T.; ENZWEILER, J. Evaluation of heavy metal removal from aqueous solution onto scolecite. Water Research, v. 36, n. 19, p. 4795-4800, 2002.
COMODI, Paola; GATTA, Giacomo Diego; ZANAZZI, Pier Francesco. High-pressure structural behavior of scolecite. European Journal of Mineralogy, v. 14, n. 3, p. 567-574, 2002.
DERBE, Tessema; TEMESGEN, Shewaye; BITEW, Mamaru. A short review on synthesis, characterization, and applications of zeolites. Advances in Materials Science and Engineering, v. 2021, p. 1-17, 2021.
GHAN, S. D.; MAHAVIDYALAYA, Yogeshwari. Thermal Behavior of Group V Zeolites from Marathwada, India.
JIMENEZ, Ricardo Sarti; DAL BOSCO, Sandra Maria; CARVALHO, Wagner Alves. Remoção de metais pesados de efluentes aquosos pela zeólita natural escolecita-influência da temperatura e do pH na adsorção em sistemas monoelementares. Química nova, v. 27, p. 734-738, 2004.
MATTIOLI, Michele et al. Morpho-chemical characterization and surface properties of carcinogenic zeolite fibers. Journal of hazardous materials, v. 306, p. 140-148, 2016.
MOSHOESHOE, Mohau; NADIYE-TABBIRUKA, M. Silas; OBUSENG, Veronica. A review of the chemistry, structure, properties and applications of zeolites. Am. J. Mater. Sci, v. 7, n. 5, p. 196-221, 2017.
MOZGAWA, W. The relation between structure and vibrational spectra of natural zeolites. Journal of Molecular Structure, v. 596, n. 1-3, p. 129-137, 2001.
OSIPOVA, N. A. et al. Thermal Characteristics of Natural Zeolite-Scolecite of Georgia. Journal of Biological and Chemical Research, v. 37, n. 1, p. 127-131, 2020.
PRASAD, K. Shiva; PRASAD, P. S. R.; SHARMA, S. R. Infrared spectroscopic study of phase transitions in natural scolecite. 2005.
PRASAD, Pinnelli SR et al. In-situ FTIR study of dehydration and rehydration mechanisms of natural scolecite. European Journal of Mineralogy, v. 18, n. 2, p. 265-272, 2006.
REEUWIJK, LP van. High-temperature phases of zeolites of the natrolite group. American Mineralogist: Journal of Earth and Planetary Materials, v. 57, n. 3-4_Part_1, p. 499-510, 1972.
RHODES C. J, “Properties and applications of zeolites,” Science Progress, vol. 93, pp. 223–284, 2010.e, 2012.
TSCHERNICH, Rudy W. Zeolites of the World. Harbinger House, 1992.
















