ÁREA
Iniciação Científica
Autores
Braga, J.L. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Nascimento, L.R. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Nogueira, L.E.R. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Ferreira, T.A.G. (UNIVERSIDADE FEDERAL DO CEARÁ) ; da Silva, W.M.B. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Ribeiro, M.E.N.P. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Pinheiro, S.O. (UNIVERSIDADE ESTADUAL DO CEARÁ)
RESUMO
Estudos com complexos inorgânicos estão sendo empregados na produção e otimização dos tratamentos terapêuticos, devido a presença de várias atividades biológica que os íons metálicos estão envolvidos, que quando complexados, como no caso de complexos íon metálico-flavonoides, podem potencializar as propriedades farmacológicas. O objetivo do trabalho é obter o complexo naringina-cobre(II) e caracterizar através de análises químicas. O complexo foi sintetizado e caracterizado por espectroscopia eletrônica na região do ultravioleta e visível (Uv-Vis), espectroscopia vibracional na região do infravermelho (IV) e ressonância paramagnética eletrônica (EPR). Assim, com as caracterizações realizadas demonstrou-se que houve coordenação da molécula naringina com o íon metálico em estudo.
Palavras Chaves
Complexo; Naringina; Cobre
Introdução
A Química Bioinorgânica estuda as funções, metabolismo e íons metálicos na formação de complexos atuando nos sistemas biológicos, podendo promover novas propostas para fármacos (BENITE; MACHADO; BARREIRO, 2007), onde atualmente se busca cada vez mais medicamentos que não causem tantos efeitos colaterais (ALVES, 2022). Os compostos de coordenação são interações de um íon metálico central ligado por uma série de ligantes (ATKINS, JONES, 2018). Na literatura, os complexos já apresentaram diversas atividades em processos biológicos e em medicamentos (FARIAS, 2009), pois os metais conseguem perder elétrons, formando compostos carregados positivamente, auxiliando na solubilização quando encontrados no metabolismo, ativando com mais eficiências suas funções (ADEYEMI; ONWUDIWE, 2018). Ao longo dos anos estudos com íons metálicos, como por exemplo, Na+, K+, Fe2+, Cu2+ e Zn2+ (PASSOS, 2008) foram aprofundados pelas propriedades apresentadas, atuando como cofatores, agentes microbianos, inibidores enzimáticos, no tratamento do câncer e da artrite (BAKHTIAR; OCHIAI, 1999; BENITE; MACHADO; BARREIRO, 2007), pois quando se tratava de estudos relacionados a tratamentos terapêuticos, as pesquisas se voltavam a produtos naturais. Assim, com os íons atuando como centro metálicos em compostos inorgânicos, evidenciou-se resultados promissores frente a diversas doenças (WEST et al., 1993; SILVEIRA, 2008). Na literatura (TISATO et al.,2010; SANTINI et al.,2014) os relatos relacionados ao elemento cobre (Cu) mostram sua manipulação desde civilizações antigas. Desta forma, o cobre é classificado como um micronutriente essencial no metabolismo humano, atuando como cofator catalítico ou até na estrutura de proteínas, possuindo uma homeostase regulada que auxilia na suas atuações biológicas, como exemplo, no transporte de oxigênio, atividades do tipo enzimáticas, sinalização celuar e síntese do DNA. Como foi citado, esse elemento possui funções importantes para o ser humano, então a ausência pode acarretar em doenças sérias. Frente a isso, fontes nutricionais que podem encontrar esse elemento são ovos, sementes, legumes, batata, cereais integrais e cacau em pó (STUPPIELLO, 2019). O íon metálico cobre (ll), que biologicamente é essencial para o funcionamento de várias enzimas e proteínas, sendo encontrados nos sistemas biológicos e bastante utilizado em sínteses por seus sais metálicos apresentarem grande versatilidade, elevada reatividade, alta disponibilidade, baixo custo e alta solubilidade, e são facilmente manipulados (SILVA et al., 2011; SILVA, 2009). Além disso, a formação de compostos de coordenação com íon cobre (II) manifestou várias atividades biológicas, como: antimicrobiana, anti-inflamatória, antitumoral, anticonvulsivante, anti-neurodegenerativa, antioxidante e anti-tuberculose, sendo ótimo para aplicações farmacológicas (REDDY, 2016). Um conjunto de polifenóis que está se destacando no campo da pesquisa voltada a atuação medicinal é os flavonoides, em que no cotidiano pode ser localizado em frutas, grãos, cerais e bebidas, como chá e vinhos (PÉREZJIMÉNEZ et al., 2010). Assim, como ligante do complexo em estudo utilizou-se o produto natural naringina, sendo este um flavonoide que possui metabólitos secundários de plantas biossintetizados e apresentam atividades biológicas como: atividades antioxidante, anti inflamatória e ação antiviral. A naringina é comumente encontrada em frutas cítricas e tem sido amplamente estudada por seus efeitos benéficos em patologias neurológicas (MACHADO; NAGEM; PETERS; FONSECA; OLIVEIRA, 2008). Estudos que apontam resultados positivos na aplicação da naringina são voltados à doença de Parkinson (JUNG; KIM, 2014; KIM et al., 2016), epilepsia (GOLECHHA et al., 2014; JEONG; JUNG; KIM, 2015) e acidente vascular cerebral (GAUR; AGGARWAL; KUMAR, 2009). O composto de coordenação do íon metálico cobre (II) coordenado ao ligante naringina pode desenvolver uma proposta promissora de um fármaco devido à biodisponibilidade do cobre (II) que quando complexado tende a aumentar as propriedades biológicas do composto podendo ser utilizada para tratar certas doenças negligenciadas como a leishmaniose. Desse modo, neste trabalho foi feita a síntese e caracterizações de espectroscopia eletrônica na região do ultravioleta visível (Uv-Vis), espectroscopia vibracional na região do infravermelho (IV) e ressonância paramagnética eletrônica (EPR). Esse complexo tem como objetivo principal seu uso e aplicação em testes biológicos, observando suas atividades farmacológicas.
Material e métodos
Na elaboração deste estudo foram empregados o sal acetato de cobre (II) monohidratado e o flavonoide Naringina (NARIN), sendo o flavonoide obtido em parceria com a Universidade Federal do Ceará (UFC). Os solventes foram dimetilsufóxido (MERCK), trietilamina (MERCK), metanol (Dinâmica) e água destilada. As sínteses e as análises dos espectros na região do ultravioleta e visível e na região do infravermelho foi realizado na Universidade Estadual do Ceará e a ressonância paramagnética eletrônica (EPR) foi realizada em parceria com Universidade Federal do Ceará (UFC). A síntese foi realizada utilizando-se o sal do metal Cu(CH3COO)2.H2O (acetato de cobre (II) monohidratado) e o ligante Naringina (NARIN) na proporção de 1:2 respectivamente. Incialmente dissolveu-se 30 mg de acetato de cobre em 10 mL de água destilada e adicionado à solução de naringina contendo 174,7 mg dissolvido em 10 ml de metanol, sob agitação, por 20 minutos. Em seguida, adicionou-se 3 gotas de trietilamina, sob agitação por 3 horas. Ao fim da síntese o composto foi levado a refrigeração. O composto foi filtrado em funil de placa porosa e estocado em dessecador sob vácuo. Foi realizado o teste de solubilidade do composto em solventes diferentes: água destilada, metanol, diclorometano, etanol, éter e dimetilsulfóxido. Os espectros eletrônico na região do ultravioleta e visível (Uv-Vis) foram realizados em um espectrofotômetro SHIMADZU UV-1800. A leitura das soluções foi na faixa de 200-800 nm utilizando uma cubeta de quartzo com concentração das soluções de 1x10-3 mol L-1, utilizando o solvente DMSO. A espectroscopia vibracional da região do infravermelho (IV) foi adquirido na região de 4000 a 400 cm-1 utilizando um espectrofotômetro modelo Nicolet iS5 da Thermo Scientific. Para a leitura do percentual das amostras foram empregados 1 mg do sal metálico, ligante e complexo em pastilhas de KBr (SIGMA). A ressonância paramagnética eletrônica (EPR) do complexo naringina-cobre (II) foi realizado em um espectrômetro Miniscope 400 da firma Magnettech, aplicando potência de micro-ondas de 10 mW e campo de modulação de 100 kHz. O tempo da leitura foi de 60s.
Resultado e discussão
Após o contato das duas soluções, que tem coloração incolores, observou-se uma
mudança de coloração para o verde. Essa alteração na coloração da reação sugere
a coordenação do ligante ao centro metálico. Quando é adicionado a trietilamina
o composto mudou novamente de coloração para um verde escuro, comprovando a alta
reatividade do ligante frente ao íon metálico Cu2+. Com o teste de solubilidade
obteve-se o resultado de que o complexo naringina-cobre (II) foi solúvel em
DMSO, não sendo solúvel em água, metanol, diclorometano, etanol e éter.
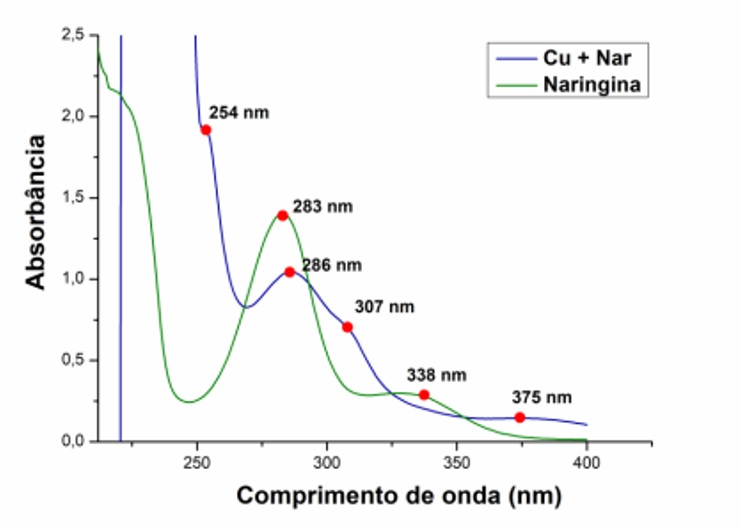
Os experimentos de espectroscopia na região do Uv-Vis (Figura 1) foi utilizado o
sal metálico dissolvido em água, o ligante em metanol e o complexo em DMSO. O
espectro do ligante naringina apresentou duas bandas em 283 nm e em 338 nm
(DEHGHAN et al., 2012). As bandas observadas no espectro eletrônico de Uv-Vis
apresentaram as bandas em 254, 286, 307 e 375 nm que foram atribuídas às
transições intraligantes e de transições do metal-ligante. As bandas em 307 e
375 nm são referentes à interação do metal com o ligante, atribuídas à
transições de transferência de carga do tipo metal-ligante (MLCT) e transições
d-d, pois trata-se de complexos de metais contendo elétrons no orbital d e
revelam a interação da naringina com íon metálico Cu (II).
No espectro de IV a coordenação ocasionou em um deslocamento da banda vO-H para
uma região menor de 3421 cm-1, observada no ligante, para 3384 cm-1 no complexo
naringina-cobre (II), indicando a coordenação nos grupos fenólicos de forma
bidentada. O deslocamento do vC=O (carbonila) de 1646 cm-1 no ligante naringina
para 1615 cm-1 no complexo, demonstrou a coordenação do ligante ao centro
metálico. Ocorreu deslocamentos também nas bandas em 1577 para 1579 cm-1 e 1520
para 1519 cm-1 ambos referentes ao grupo funcional C=C do anel aromático. As
bandas 1296 cm-1 para 1277 cm-1, 1204 para 1216 cm-1 e 1089 para 1095 cm-1 que
indicam deformação angular de O-H de fenóis. As demais bandas permaneceram
semelhantes tanto do ligante quanto do metal. A partir dos resultados adquiridos
nos dados espectroscópicos de UV-Vis e IV sugere-se a fórmula do complexo como
[Cu(Narin)2](CH3COO)2. O resultado do complexo naringina-cobre (II) de coloração
verde nos estudos de EPR indicou sinais mais intensos, apresentando três valores
de gxx = 2.30; gyy = 2.10; gzz = 2.03 (gx> gy>gz), sendo que o EPR para o Cu2+
na forma isolada apresenta linhas largas em simetria rômbica ou mais baixa,
sugerindo uma combinação dos orbitais dz2 e dx2-y2 (GARRIBBA; MICERA, 2006).
Fonte: Próprio autor.
Conclusões
De acordo com os resultados obtidos durante as caracterizações espectroscópicas sobre o complexo em estudo permitiu observar que ocorreu a coordenação do ligante naringina e do sal metálico acetato de cobre (II). Inicialmente, com a mudança de coloração durante a síntese permitiu sugerir que ocorreu a coordenação da naringina com o íon cobre (II). A partir das análises espectroscópicas realizadas, observou-se no espectro de Uv-Vis que houve deslocamentos das bandas do complexo em relação as bandas do ligante. No espectro de IV apontou os sítios de coordenação do metal ao ligante. A análise de EPR indicaram uma simetria rômbica para o complexo em estudo. Assim, os próximos avanços deste estudo é a aplicação desse composto em testes biológicos e assim compreender as funções farmacológicas presentes no complexo de naringina-cobre (II).
Agradecimentos
A Universidade Estadual do Ceará (UECE), ao Laboratório de Química Inorgânica (LQUIN) e a Universidade Federal do Ceará (UFC).
Referências
ADEYEMI, Jerry O.; ONWUDIWE, Damian C. Organotin (IV) dithiocarbamate complexes: Chemistry and biological activity. Molecules, v. 23, n. 10, p. 2571, 2018.
ALVES, Daniel Lima. Síntese e Caracterização de complexos de cobre (II) contendo hidrazidas alifáticas e 1,10 - fenantrolina. 2022. 51 f. TCC (Graduação em Química Industrial), Universidade Federal de Uberlândia, Uberlândia, 2022.
ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de Química-: Questionando a Vida Moderna e o Meio Ambiente. [S.l.]: Bookman, 2018.
BAKHTIAR, Ray; OCHIAI, Ei-Ichiro. Pharmacological applications of inorganic complexes. General Pharmacology: The Vascular System, v. 32, n. 5, p. 525-540, 1999.
BENITE, Anna M.C.; MACHADO, Sérgio de Paula; BARREIRO, Eliezer J.. Considerações sobre a Química Bioinorgânica Medicinal/ Revista Eletrônica de Farmácia. Vol 4 (2), 131-142, 2007.
DEHGHAN, Gholamreza; KHOSHKAM, Zahra. Tin (II)–quercetin complex: Synthesis, spectral characterisation and antioxidant activity. Food Chemistry, v. 131, n. 2, p.422-426, 2012.
FARIAS, Robson Fernandes; Química de Coordenação: fundamentos e atualidades. 2 ed. [S.l.] Átomo, 2009.
GARRIBBA, Eugenio; MICERA, Giovanni. The Determination of the Geometry of Cu(II) Complexes. Journal Of Chemical Education, [S.I], v. 83, n. 8, p. 1229-1232, 8 ago. 2006.
GAUR, V.; AGGARWAL, A.; KUMAR, A. Protective effect of naringin against ischemic reperfusion cerebral injury: Possible neurobehavioral, biochemical and cellular alterations in rat brain. EuropeanJournalofPharmacology, v. 616, n. 1–3, p. 147–154, 2009.
GOLECHHA, M. et al. Naringin ameliorates pentylenetetrazol-induced seizures and associated oxidative stress, inflammation, and cognitive impairment in rats: Possible mechanisms of neuroprotection. EpilepsyandBehavior, v. 41, p. 98–102, 2014.
JEONG, K. H.; JUNG, U. J.; KIM, S. R. Naringin Attenuates Autophagic Stress and Neuroinflammation in Kainic Acid-Treated Hippocampus In Vivo. Evidence-based Complementary and Alternative Medicine, v. 2015, 2015.
JUNG, U. J.; KIM, S. R. Effects of naringin, A flavanone glycoside in grapefruits and citrus fruits, On the nigrostriatal dopaminergic projection in the adult brain. Neural Regeneration Research, v. 9, n. 16, p. 1514–1517, 2014.
KIM, H. D. et al. Naringin treatment induces neuroprotective effects in a mouse model of Parkinson’s disease in vivo, but not enough to restore the lesioned dopaminergic system. Journal of Nutritional Biochemistry, v. 28, p. 140–146, 2016.
MACHADO, H.; NAGEM, T. J.; PETERS, V. M.; FONSECA, C. S.; OLIVEIRA, T. T. Flavonóides e seu potencial terapêutico. Boletim do Centro de Biologia da Reprodução, Juiz de Fora, v. 27, n. 1/2, p. 33-39, 2008.
PASSOS, Fernando dos. Síntese e caracterização de novos complexos de cobre (II) e zinco (II) de relevância bioinorgânica. 2008. 49 f. TCC (Graduação) - Curso de Química, Universidade Federal de Santa Catarina, Florianópolis, 2008.
PÉREZ-JIMÉNEZ, J., et al. Urinary metabolites as biomarkers of polyphenol intake in humans: a systematic review. The American journal of clinical nutrition, v. 92, n. 4, p. 801- 809, 2010.
REDDY, PulimamidiRabindra; RAJESHWAR, Suryam; SATYANARAYANA, Battu. Synthesis, characterization of new copper (ii) Schiff base and 1, 10 phenanthroline complexes and study of their bioproperties. Journal of Photochemistry and Photobiology B: Biology, v. 160, p. 217-224, 2016.
SANTINI, C.; PELLEI, M.; GANDIN, V.; PORCHIA, M.; TISATO, F.; MARZANO, C. Advances in Copper Complexes as Anticancer Agents. Chemical Reviews, v.114, p. 815– 862, 2014.
SILVA, P. P. et al. Two new ternary complexes of copper(II) with tetracycline or doxycycline and 1,10-phenanthroline and their potential as antitumoral: Cytotoxicity and DNA cleavage. InorganicChemistry, v. 50, n. 14, p. 6414-6424, 2011.
SILVA, P. P. Sínteses, caracterizações e estudos da potencial atividade antitumoral de alguns complexos de cobre(II). 2009. 73 f. Dissertação (Mestrado em Química) – Universidade Federal de Minas Gerais, Belo Horizonte, 2009.
SILVEIRA, Vivian Chagas da. Investigação da atividade biológica de complexos de cobre (II) com ligantes inspirados em biomoléculas. 2008. 172f. Tese (Doutorado em Química) - Universidade de São Paulo, São Paulo, 2008.
STUPPIELLO, Bruna. Cobre é importante para a saúde da pele e cérebro. Minhavida, 2019. Disponível em: https://www.minhavida.com.br/alimentacao/tudosobre/17982-cobre. Acesso em: 26 ago. 2023.
TISATO, F.; MARZANO, C.; PORCHIA, M.; PELLEI, M.; SANTINI, C. Copper in diseases and treatments, and copper-based anticancer strategies. Medicinal Researche Reviews, v. 30, n.4, p. 708-749. 2010.
WEST, Douglas X. et al. Thiosemicarbazone complexes of copper (II): structural and biological studies. Coordination Chemistry Reviews, v. 123, n. 1-2, p. 49-71, 1993.
















