ÁREA
Química de Materiais
Autores
Souza, Y.G. (UESB) ; Nascimento, I.S. (UESB) ; Santos, J.B. (UESB) ; Rolim, C.S.S. (UESB) ; Pimentel, A.A. (UESB) ; Silva, D.L. (UESB) ; Santos, J.R.B. (UESB) ; Oliveira, C.G. (UESB) ; Oliveira, A.C.J. (UFG) ; Fontan, R.C.I. (UESB)
RESUMO
Os criogéis são materiais poliméricos obtidos em baixas temperaturas usadas para processos cromatográficos. Eles apresentam corpo único com poros interconectados e baixo custo de produção e vêm se tornando alvo de estudos para melhorar a eficiência de suas estruturas. Uma das formas de aplicação dos criogéis são em processos de purificação de biomoléculas, por meio do procedimento de enxertia, que consiste em modificar a sua superfície. Deste modo, esse trabalho teve como objetivo avaliar os parâmetros físicos S, ED, porosidade, capacidade de troca catiônica e FTIR para criogeis controle e ativado. Obteve-se resultados compatíveis com a literatura. Além disso, apresentou boa capacidade de adsorção.
Palavras Chaves
Troca catiônica; GABA; Criogéis
Introdução
Técnicas cromatográficas tem sido amplamente utilizada para processos de purificação por conseguir obter compostos complexos com alta pureza. Com o intuito de aumentar a qualidade e a pureza do produto final, matrizes cromatográficas poliméricas podem ser empregadas em vários setores das indústrias alimentar e farmacêuticas (NASCIMENTO et al. 2022; DE SOUZA et al. 2023). Dentre as matrizes poliméricas, os criogéis, materiais poliméricos obtidos em baixas temperaturas, vem sendo amplamente utilizado para tais funções (LOZINSKY et al., 2003; CARVALHO et al., 2014; GONÇALVES et al., 2016; VERÍSSIMO et al., 2017; MOL et al., 2017; NASCIMENTO et al 2019; HAMACEK et al. 2023). Os criogéis, são monólitos poliméricos utilizados para a purificação de biocompostos como otimizador de técnicas adsortivas, devido oferecer impacto no rendimento de tais processos. Estes são constituídos por géis poliméricos formados através de precursores monoméricos ou poliméricos preparados por polimerização de radicais livres em condições de congelamento. Quando descongelados, o gelo e os cristais dos solventes deixam espaços vazios entre as cadeias poliméricas formando poros com tamanhos que podem variar de 10 até 200 μm (PFAUNMILLER; PAULEMOND; DUPPER, 2013; MÓL et al., 2019). Os monólitos poliméricos se caracterizam por uma estrutura em corpo único, elástico como uma esponja, coloração opaca, com poros interconectados e grandes o suficiente para permitir a passagem até mesmo de células inteiras, o que leva a uma maior permeabilidade ao escoamento e a uma menor queda de pressão. São versáteis no seu uso, podendo ser produzidos na forma de colunas, discos ou membranas, e de baixo custo, se comparados a matrizes tradicionais utilizadas na cromatografia (GUIOCHON, 2007; PRIVAR et al., 2018; MÓL et al., 2019). Dentre os possíveis polímeros usados na síntese de criogéis, a poliacrilamida vem se mostrando um polímero apto para produção criogéis (GONÇALVES et al, 2017; NASCIMENTO et al 2019; NASCIMENTO et al, 2022; DE SOUZA et al, 2023). Esse material é obtido da polimerização da acrilamida (Aam) com o agente formador de reticulação N,N’-metileno-bis-acrilamida (BAam), com ou sem outros monômeros (como éter alil glicidílico, AGE). Os criogéis possuem, além das características descritas acima, baixa resistência ao fluxo, permitindo o uso de mais soluções viscosas. Devido a isso, os custos de operações podem ser reduzidos, eliminando etapas de preparação, como pré-concentração, sem afetar a eficiência da purificação (GONÇALVES et al 2017; NASCIMENTO et al 2022. DE SOUZA et al 2023). Outra forma de aumentar a eficiência das matrizes poliméricas, é a modificação de sua superfície. Conhecida como grafting from, a técnica de funcionalização de criogéis acontece com a enxertia de grupos obtidos via ligação química entre grupos reativos presentes na superfície do gel e nos grupos terminais reativos do polímero pré-formado, é também, uma poderosa alternativa para controlar a densidade e a espessura dos poros do criogel (SAVINA et al., 2005; NORDBORG et al., 2011). O ácido gama aminobutírico (GABA) apresenta características favoráveis para a utilização na técnica de funcionalização. Em sua estrutura molecular (C4H9NO2) há dois grupos de interesse, amina em uma extremidade da cadeia e um grupo carboxílico em outra (WATANABE et al, 2002). Assim, esse trabalho tem como objetivo avaliar o comportamento da estrutura de um criogel funcionalizado com GABA para a uso como trocador catiônico.
Material e métodos
Síntese dos criogéis Os criogéis foram sintetizados a partir da metodologia modificada de Nascimento et al. (2022). Uma solução de 7 % (m/v) de monômeros foi preparada contendo 3,3 g de Acrilamida (AAm), 1,2 g de N,N-metileno-bis-acrilamida (BAAm) e 2,5 g de Alil-glicidil-éter (AGE) dissolvidos em 100 mL deágua deionizada e colocada em banho ultrassônico por 5 min. Posteriormente, a solução foi resfriada em um banho de gelo e adicionada 140 µL de persulfato de amônio (APS) 0,5 g∙mL-1 e 91 µL de N, N, N ', N'– tetramethylethylenediamine (TEMED). A solução foi vertida em seringas plásticas de 10 mL, seladas e colocadas em banho ultratermostático (Quimis) por 24 h à -12 °C. Após o tempo decorrido, os criogéis foram colocados em uma geladeira para descongelamento durante 4 horas, logo após secos em estufa a 60 °C. Após secos, os mesmos foram lavados com água deionizada para a remoção de reagentes não polimerizados e então novamente secos. Funcionalização de criogéis por troca catiônica Para a produção de criogéis com caráter catiônico foi realizada a funcionalização segundo a metodologia modificada de Nascimento et al. (2022). Sob agitação rotativa à 25 rpm, criogéis desidratados com aproximadamente 1 cm de diâmetro e 4,5 cm de altura foram colocados em contato com 20 mL de álcool metílico por 2 horas e lavados duas vezes com 20 mL de água destilada por 30 min. Adicionou-se 20 mL de tampão fosfato de sódio (PBS) 0,05 mol∙L-1 pH 6 por 1 hora e posteriormente, 20 mL de solução de ácido gama aminobutírico 10 mg∙mL-1 em PBS foram colocados em contato com os criogeis durante 14 horas à temperatura ambiente (25±2 °C). Após o tempo decorrido, adicionou-se 20 mL de PBS por 1 hora e depois imergido em 20 mL de solução de borohidreto de sódio 0,1 mol∙L em PBS por 1 hora com os frascos abertos. Por fim, os criogéis foram lavados com água destilada (duas vezes) por 30 minutos e secos em estufa a 60 °C. Caraterização dos criogéis Para a caracterização dos criogéis produzidos foram realizadas as análises de capacidade de inchamento (S) segundo Savina et al. (2005), grau de expansão (ED) e capacidade iônica total (ꓥ) segundo Fontan et al. (2018) e porosidade segundo Nascimento et al. (2022). Os resultados obtidos foram comparados entre si aplicando-se o teste t de Student a 5% de probabilidade utilizando o software SAS® OnDemend for Academics. Para avaliar os grupos funcionais dos criogéis produzidos, foi realizada a espectroscopia no infravermelho com transformada de Fourier (FTIR). Para isso, amostras de criogéis controle e ativados foram cortadas com uma lâmina de aço inox em pedaços cilíndricos com cerca de 1,5 mm de aresta e lidas diretamente através da técnica de reflectância total atenuada (ATR) na região infravermelha de 4000-600 cm-1, utilizando-se o modo transmitância, em um espectrofotômetro modelo FTIR Cary 630, da Agilent Technologies (Santa Clara – USA). Os dados foram obtidos utilizando-se o software Microlab e o Resolution Pro.
Resultado e discussão
Síntese dos Criogéis
As matrizes poliméricas sintetizadas apresentaram forma cilíndrica, uniforme,
porosa, de cor branca opaca com no máximo 5 cm de altura e 1 cm de diâmetro.
Quando secos, os criogéis apresentaram estrutura rígida, porém, quando
hidratados, mostraram uma estrutura com a capacidade de serem suavemente
comprimidos mantendo a integridade da estrutura, além de apresentar estabilidade
nos processos de hidratação e secagem, sendo características essenciais para os
criogéis de poliacrilamida para que possam ser armazenados e posteriormente
utilizados nos processos de purificação. Tais características foram descritas
também por outros autores como De Souza et al. (2023), Nascimento et al. (2022)
e Fontan et al. (2018).
Caracterização dos Criogéis
Os dados obtidos da caracterização dos criogéis são apresentados na tabela 1.
A partir dos resultados percebe-se que não houve diferença significativas para
as análises de S, ED e porosidade para os criogéis controle e ativados. Obteve-
se cerca de 42% de macroporos, sendo característica desejada para purificação de
macromoléculas. A fração de micro e mesoporos correspondente a 52% revela que, a
coluna produzida poderá também ser bem utilizada para purificação de moléculas
menores. Outros autores como Fontan et al, (2018), Nascimento et al, (2019) e
Nascimento et al, (2022) que trabalharam com criogéis de poliacrilamida
encontraram valores próximos a estes. Embora não mostrarem mudanças na
estrutura, a capacidade de troca iônica (ꓥ) revela a possibilidade de adsorção
por troca catiônica em até aproximadamente 280 mg∙g-1, característica desejável
para matrizes com esta finalidade.
Outra análise também realizada foi a espectroscopia no infravermelho com
transformada de Fourier (FTIR) e os espectros obtidos para criogéis controle e
funcionalizado são apresentados na figura 1.
A partir dos espectros obtidos, é possível identificar bandas similares entre os
criogéis controle e funcionalizado. Tais resultados já eram previstos uma vez
que a estrutura do GABA contém grupos semelhantes à da estrutura de
poliacrilamida. A banda de vibração da região de aproximadamente 1650 cm-1 é
característica do agrupamento amida (C=O), molécula existente nas estruturas de
AAm e BAAm usadas para o processo de síntese. Esta banda é caraterística para
criogéis e outros materiais que utilizam poliacrilamida e são descritas por
vários outros autores. (NASCIMENTO et al. 2019; NASCIMENTO et al. 2022; DE SOUZA
et al. 2023; HELLEBOIS et al. 2023).
Outras vibrações formadas por hidroxilas (-OH) pode ser percebida nos
comprimentos de ondas de 3189,27 – 3303,44 cm-1 referentes a presença de água e
uma banda 1112,12 cm-1 correspondente ao alongamento do grupo C-O referente ao
grupo epóxi (SAHINER; DEMIRCI et al. 2016). A banda na região de 1450,89 cm-1
indica flexão assimétrica do grupo C-H e alongamento assimétricos de C-H
alifáticos foi percebido no comprimento 2927,52 cm-1 (SAHINER; DEMIRCI 2016; DE
SOUZA et al. 2023).
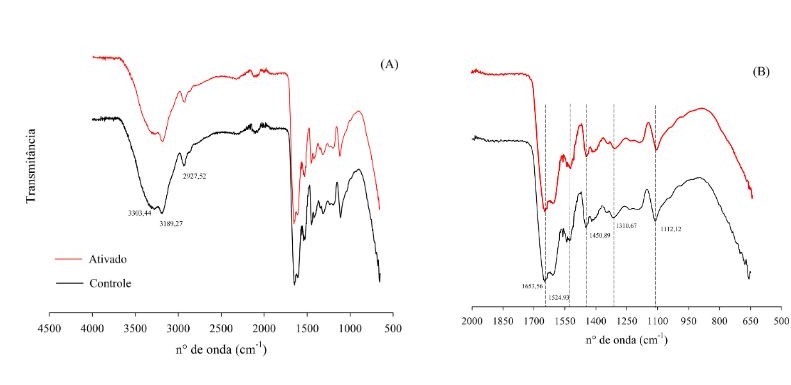
Figura 1. Espectros de FTIR dos criogéis \r\nsintetizados. (a) Todo o espectro. (b) Faixa de 500 \r\na 200 cm-1 do espectro de FTIR.
Conclusões
Produziu-se um suporte supermacroporoso com a finalidade de exercer troca catiônica com características necessárias para ser utilizado como matriz cromatográfica. Sendo assim, compreende-se que o criogel embora não ter alterações em alguns dos parâmetros físicos, ele apresentou capacidade de troca iônica, tendo a capacidade de adsorver cerca de 300 mg/g de adsorvato. Essa integridade da estrutura após o processo de enxertia é interessante, principalmente por manter a porcentagem em poros, podendo assim ser utilizado em processos de purificação.
Agradecimentos
Os autores agradecem ao Laboratório de Engenharia de Processos (LEP) da Universidade Estadual do Sudoeste da Bahia, à FAPESB e CAPES por tornarem esse trabalho possível.
Referências
CARVALHO, B. M. A.; CARVALHO, L. M.; SILVA J. R, W. F.; MINIM, L. A.; SOARES, A. M.; CARVALHO, G. G. P.; DA SILVA, S. L. Direct capture of lactoferrin from cheese whey on supermacroporous column of polyacrylamide cryogel with copper ions. Food chemistry, v. 154, p. 308-314, 2014.
DE SOUZA, Y. G.; NASCIMENTO, R. G.; MUNIZ, I. C. B.; BONOMO, R. C. F.; FONTAN, R. C. I. Thermodynamic study of lysozyme adsorption on cation-exchange monolithic adsorbent. Brazilian Journal of Chemical Engineering, p. 1-14, 2023.
FONTAN, R. D. C. I.; BONOMO, R. C. F.; GONÇALVES, G. R. F.; MINIM, V. P. R.; MINIM, L. A. Alternatives for characterizing macroporous polyacrylamide monolithic ion exchanger columns. Polymer Engineering & Science, v. 58, n. 10, p. 1717-1725, 2018.
GONÇALVES, G. R. F.; GANDOLFI, O. R. R.; SANTOS, C. M. S.; BONOMO, R. C. F.; VELOSO, C. M.; FONTAN, R. D. C. I. Development of supermacroporous monolithic adsorbents for purifying lectins by affinity with sugars. Journal of Chromatography B, v. 1033, p. 406-412, 2016.
GUIOCHON, G. Monolithic columns in high-performance liquid chromatography. Journal of Chromatography A, v. 1168, n. 1-2, p. 101-168, 2007.
HAMACEK, H. S. D. R.; BRESOLIN, I. T. L.; FIORAVANTE, I. F.; BUENO, S. M. A. Synthesis and characterization of chitosan-polyacrylamide cryogels for the purification of human IgG by IMAC. Process Biochemistry, v. 131, p. 199-209, 2023.
HELLEBOIS, T.; CANUEL, R., ADDIEGO; F., AUDINOT, J. N.; GAIANI, C.; SHAPLOV, A. S.; SOUKOULIS, C. Milk protein-based cryogel monoliths as novel encapsulants of probiotic bacteria. Part I: Microstructural, physicochemical, and mechanical characterisation. Food Hydrocolloids, v. 140, p. 108641, 2023.
LOZINSKY, V. I.; GALAEV, I. Y.; PLIEVA, F. M.; SAVINA, I. N.; JUNGVID, H.; MATTIASSON, B. Polymeric cryogels as promising materials of biotechnological interest. TRENDS in Biotechnology, v. 21, n. 10, p. 445-451, 2003.
MÓL, P. C. G.; VERÍSSIMO, L. A. A.; ELLER, M. R.; MINIM, V. P. R.; MINIM, L. A. Development of an affinity cryogel for one step purification of lysozyme from chicken egg white. Journal of Chromatography B, v. 1044, p. 17-23, 2017.
NASCIMENTO, I. S.; SILVA, D. L.; PEREIRA, T. B.; GONCALVES, G. R. F.; VERÍSSIMO, L. A. A.; VELOSO, C. M.; FONTAN, R. C. I. Capture of lectins from jackfruit (Artocarpus integrifolia) seeds in a single step using a supermacroporous ion exchange cryogel. Revista Mexicana de Ingeniería Química, v. 18, n. 1, p. 313-324, 2019.
NASCIMENTO, R. G.; PORFÍRIO, M. C. P.; NASCIMENTO, P. A.; ALVES, A. N.; SANTOS, L. S.; VELOSO, C. M.; FONTAN, R. D. C. I. A novel hydrophobic matrix grafted with aniline for protein capture and thermodynamic study of BSA adsorption. Journal of Polymers and the Environment, 30(8), 3230-3238 2022.
NORDBORG, A.; HILDER, E. F.; HADDAD, P. R. Monolithic phases for ion chromatography. Annual Review of Analytical Chemistry, v. 4, p. 197-226, 2011.
PFAUNMILLER, E. L; PAULEMOND, M. L.; DUPPER, Courtney M. Affinity monolith chromatography: a review of principles and recent analytical applications. Analytical and Bioanalytical Chemistry, v. 405, n. 7, p. 2133–2145, 2013.
PRIVAR, Y.; MALAKHOVA, I.; PESTOV, A.; FEDORETS, A.; AZAROVA, Y.; SCHWARZ, S.; BRATSKAYA, S. Polyethyleneimine cryogels for metal ions sorption. Chemical Engineering Journal, v. 334, p. 1392-1398, 2018.
SAHINER, N.; DEMIRCI, S. Conducting semi-interpenetrating polymeric composites via the preparation of poly (aniline), poly (thiophene), and poly (pyrrole) polymers within superporous poly (acrylic acid) cryogels. Reactive and Functional Polymers, v. 105, p. 60-65, 2016.
SAVINA, I.; MATTIASSON, B.; GALAEV, I. Y. Graft polymerization of acrylic acid onto macroporous polyacrylamide gel (cryogel) initiated by potassium diperiodatocuprate. Polymer, v.46, 9596-9603, 2005.
VERÍSSIMO, L. A. A.; PAGANOTO, F. S.; MOL, P. C. G.; ILHEU FONTAN, R. D. C.; MINIM, V. P. R.; MINIM, L. A. Preparation of an affinity cryogel column for lysozyme purification. Separation Science and Technology, v. 52, n. 12, p. 1973-1982, 2017.
WATANABE, M.; MAEMURA, K.; KANBARA, K.; TAMAYAMA, T.; HAYASAKI, H. GABA and GABA receptors in the central nervous system and other organs. International review of cytology, v. 213, p. 1-47, 2002.
















