ÁREA
Química de Materiais
Autores
Santos, J.B. (UESB) ; Santos, M.P.F. (UESC) ; Porfírio, M.C.P. (UESB) ; Nascimento, I.S. (UESB) ; Souza, Y.G. (UESB) ; Pimentel, A.A. (UESB) ; Fontan, R.C.I. (UESB)
RESUMO
A utilização de enzimas livres em indústrias tem se mostrado oneroso devido aos processos de recuperação necessários, assim pesquisadores tem desenvolvido suportes para imobilização de enzimas afim de possibilitar seu reuso. Dessa maneira, o estudo objetivou a imobilização da lisozima em um suporte criogênico magnético. O criogel foi elaborado por criogeleficação e co-precipitação de Fe2+ e Fe3+. Foram realizados os ensaios de imobilização e atividade enzimática. O biocatalizador apresentou capacidade de imobilização de 106 % maior que o suporte controle, e atividade total igual a enzima livre, sendo reutilizada por 6 ciclos. Assim o novo suporte produzido se mostrou promissor para imobilização de enzimas e assim sua aplicação em processos industriais.
Palavras Chaves
Criogel; Biocatalizador; Reuso
Introdução
A imobilização enzimática é uma alternativa para solucionar dificuldades da utilização de enzimas livres, como o alto custo e baixa estabilidade em determinadas condições, sendo um fator limitante para a sua utilização em larga escala. Para contornar estes problemas a sua utilização na forma imobilizada traz algumas vantagens, como a melhoria na atividade catalítica, estabilidade frente a fatores operacionais e sua reutilização, uma vez que enzimas livres necessitam de etapas de recuperação, tornando o processo oneroso. Logo, tem se desenvolvido materiais a fim de trazer versatilidade aos métodos utilizados (KULKARNI, 2016; SHIEKH et al., 2021). O principal interesse em imobilizar enzimas é a obtenção de biocatalisadores com atividade e estabilidade que não sejam afetadas durante o processo. Além disso, não deverá ocorrer alterações estruturais na enzima, como modificações no sítio ativo, evitando a perda de atividade durante seu uso, que é o principal obstáculo para sua utilização comercial (BEZERRA et al., 2015). Vários parâmetros devem ser considerados para que a imobilização ocorra de maneira desejável, como a seleção do método, o suporte, a eficiência da enzima, os custos do procedimento, a toxicidade dos reagentes e as propriedades finais do biocatalisador (ALNOCH et al., 2020). A enzima pode ser imobilizada nos suportes por diferentes métodos, que podem ser físicos ou químicos (NONGONIERMA et al., 2016). O método de imobilização física por adsorção ocorre por meio de interações fracas, como as forças de Van der Waals, interações iônicas, ou interações hidrofóbicas (GONÇALVES et al., 2017; SANTOS et al., 2022). Já na técnica de imobilização química, ocorre pela formação de ligações covalentes entre enzima ligada ao suporte inerte, que geralmente são estabelecidas entre grupamento amina, sulfidrila e grupos hidroxilas de anéis fenólicos das enzimas (SANTOS et al., 2019). Outra técnica empregada para imobilização enzimática é a magnetização, nesse caso alguns óxidos como o Fe3O4 (magnetita) e D-Fe2O3 (hematita) são os responsáveis pela interação com as enzimas (LAOCHAIet al., 2016; BOBER, 2020). As partículas magnéticas são candidatas populares, uma vez que apresentam biocompatibilidade em processos biotecnológicos além de desempenhar maiores eficiência que alguns métodos tradicionais. Outra vantagem de suportes magnéticos é a sua maior facilidade de separação do meio reacional, utilizando campos magnéticos (BILAL et al., 2018). Já foi observado que a incorporação de partículas magnéticas em suportes melhora a adsorção, porosidade, propriedades térmicas e mecânicas, e até apresentam propriedades antimicrobianas (ATTA et al., 2018). As características do material sólido empregado como suporte também influenciam a eficiência do processo. Assim, é necessário utilizar suportes com diâmetro de poros maiores, elevada área superficial, boa estabilidade química, mecânica, térmica, hidrofilicidade e insolubilidade (İSPIRLI-DOĞAÇ et al., 2017). Assim, os criogéis poliméricos estão surgindo como matrizes indispensáveis para processos de imobilização enzimática, sendo obtidos pela técnica de criogeleificação (HUSEYNLI et al., 2022). São utilizados de diversos polímeros para elaboração desses suportes, o criogel de poliacrilamida (pAam) possui a capacidade de imobilizar componentes à sua estrutura (GONÇALVES et al., 2017). As modificações realizadas, também chamadas de funcionalização tem por objetivo trazer características específicas ao suporte para que se obtenha uma maior eficiência de imobilização (ANDAÇ et al., 2016; ACET et al., , 2018). Assim, o entendimento estrutural do suporte e da enzima se torna essencial para uma melhor eficiência no processo (ABRÃO, 2014; ANASTAS et al., 2021; BAYRAMOGLU et al., 2022). A lisozima ou N-acetilmurâmico (EC 3.2.1.17) é uma enzima globular com 14 mil Dalton e ponto isoelétrico igual a 11, seu caráter básico é oriundo de 6 resíduos de lisina e 9 resíduos de arginina, possuindo 129 aminoácidos reticulados em quatro pontes dissulfeto (VERÍSSIMO et al., 2017). Sua propriedade antimicrobiana é oriunda da sua especificidade na hidrolise de ligações glicosídicas β (1-4), tendo maior efetividade entre N-acetil-D-glicosamina e N-acetil-murâmico de oligossacarídeos presente na parede celular de bactérias (MÓL et al., 2017). Com isso, se tornou uma enzima de grande interesse na área farmacêutica, no auxílio no diagnóstico de doenças entre outros, e na indústria de alimentos como agente conservante (ÁVILA et al., 2014). Diante do exposto, o presente estudo objetivou o desenvolvimento de um novo suporte magnético para imobilização de lisozima e assim possibilitar o seu reuso.
Material e métodos
Os criogéis foram elaborados seguindo a metodologia descrita por KUMAR et al. (2006), 7 % de monômeros de acrilamida, bis-acrilamida, alil-glicidil-eter, persulfato de amônio e N,N,N’,N’- tetrametilenodiamino. A solução foi vertida em seringas plásticas de 10 mL, seladas e levadas a um banho ultratermostático (QUIMIS, Diadema, BR) a -12 °C por 24 h. Após isso, as seringas foram abertas e levadas para estufa BOD (SP500 LABOR, Cótia, BR) a 4 °C por 4 h. Posteriormente, os criogéis foram secos em estufa (Tecnal, TE - 393/1, Piracicaba, BR) a 60±1 °C. Os adsorventes foram modificados de acordo metodologia de MOHAN et al. (2011) e LAOCHAI et al. (2016), foi preparado uma solução com 0,067 mol de Cloreto de ferro (Fe3+) e 0,033 mol de Sulfato de ferro (Fe2+ ). A solução foi mantida sob agitação a 80 °C por 30 min em atmosfera inerte (Nitrogênio). A solução previamente preparada foi deixada em contato com os criogéis por 4 h. Posteriormente, uma solução de hidróxido de amônio 28 % foi mantida em contato com os suportes por 4 h. Os materiais foram lavados sucessivamente, secos e armazenados protegidos da luz. A imobilização foi realizada com aproximadamente 50 mg de criogel e 5 mL de solução enzimática de lisozima (EC. 235-747-3, 70000 U.mg-1, CAS: 12650-88-3) com uma concentração inicial de 1 mg.mL-1 em tampão fosfato de sódio (TFS) 0,05 mol.L-1 em pH 8. Os tubos foram mantidos em estufa BOD a temperatura de 25 °C, sob agitação constante de 20 rpm em agitação orbital por 12 h. Após as 12 h, os sobrenadantes foram retirados, para a quantificação de proteínas não adsorvidas por leitura da absorbância em espectrofotômetro (UV-Vis Quimis, São Paulo, BR) a 595 nm, utilizando o método de BRADFORD (1976), sendo construída uma curva de calibração de 0,1 a 1 mg.mL-1 de lisozima pura. Em seguida foram realizadas sucessivas lavagens nos suportes para remoção de enzimas não imobilizadas. Para isto, adicionou-se 5 mL de TFS aos suportes e deixadas sob agitação a 20 rpm por 10 min a 25 ºC, tendo novamente o sobrenadante retirado e quantificado. As lavagens foram feitas até que os valores da concentração de proteínas da solução sobrenadante fossem nulos. A atividade enzimática da enzima livre e dos biocatalizadores foi realizada seguindo a metodologia descrita por SHUGAR (1952). Foi utilizada uma suspensão 0,15 % m.v-1 de Micrococcus lysodeikticus preparada em Solução Fosfato de Potássio (50 mmol.L-1) em pH 6,24. A atividade (U) é definida como a quantidade de enzima capaz de produzir um decréscimo de 0,001 na densidade ótica por minuto. Os biocatalizadores foram submetidos a repetidos ensaios enzimáticos para verificação do seu reuso. Os experimentos realizados foram feitos em triplicata e os dados submetidos a análise de variância pelo Teste F e Teste de Tukey (p < 0,01), por meio dos programas SAS Studio University Edition Origin 2018.
Resultado e discussão
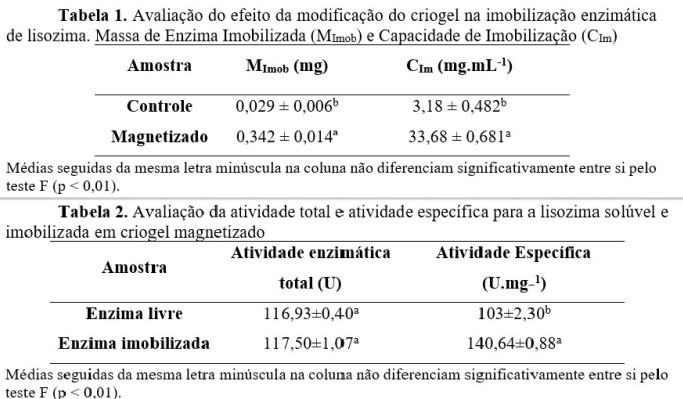
Os resultados acerca da modificação realizada no suporte de criogel para a
imobilização da lisozima são apresentas na Tabela 1. Analisando os resultados
encontrados, a capacidade de imobilização foi de 33,68 mg.g-1
superior a alguns trabalhos encontrados na literatura, como BAYRAMOGLU et al.
(2022) que utilizando um adsorvente magnético atingiu 30,8
mg.g-1. Com isso é possível observar que após a modificação, o novo
suporte apresentou um aumento de 106 % na sua capacidade de imobilização em
comparação com criogel controle. O aumento pode estar diretamente relacionado ao
processo de magnetização, uma vez que a utilização de partículas metálicas em
suportes confere um maior poder de imobilização e uma menor probabilidade de
perdas por precipitação (KHOSHNEVISAN et al., 2019; SANTOS et al.,
2022). Logo, a interação das enzimas com o suporte se deu através dos óxidos de
ferro formados. Nesse caso, a formação da magnetita
(Fe3O4) no interior do material apresenta interações
fortes com alguns aminoácidos presentes na estrutura da lisozima (LAOCHAI et
al., 2016). Segundo SARANYA et al. (2015) e SUN et al. (2011)
a ligação da lisozima à magnetita ocorre por meio da coordenação entre íons
metálicos com cadeia lateral doadora de elétrons de resíduos como histidina e
cisteína. A lisozima só possui um resíduo de histidina que deve ser o sítio de
ligação de afinidade dominante na imobilização da lisozima como Fe3+
imobilizado ao suporte. Contudo este mesmo íon, possui forte afinidade por
oxigênio presente em grupos funcionais, como fenólico e carboxílico, dessa
forma, resíduos de ácidos aspártico, tirosina e ácido glutâmico também fornecem
afinidades locais para imobilização da lisozima. Os resultados para a atividade
enzimática total e específica da lisozima, tanto na sua forma livre em solução,
quanto no biocatalizador, podem ser observados na Tabela 2. Também foi realizado
o branco do suporte controle e magnético ambos sem a enzima, para verificação da
atividade hidrolítica. Os mesmos não apresentaram capacidade de hidrolisar o
substrato, mostrando que o suportes não interferem nos valores da atividade das
enzimas imobilizadas. Observa-se que a enzima imobilizada no suporte magnético
apresentou alto valor de atividade enzimática total sendo igual a atividade da
enzima livre, mesmo possuindo uma menor massa de enzima, indicado que a
imobilização levou a uma melhora em sua atividade. De maneira geral enzimas
imobilizadas tendem a apresentar uma redução na sua atividade uma vez que muitas
vezes se encontram confinadas no interior dos suportes o que dificulta o seu
acesso ao substrato que deve ser transferido (por convecção e/ou por difusão) do
seio da solução até os sítios catalíticos (SANTOS et al., 2019). Porém
como foi observado a enzima imobilizada no suporte magnetizado teve uma alta
atividade que está relacionada aos íons metálicos inseridos na superfície da
matriz. De acordo com KHOSHNEVISAN et al. (2019), a imobilização
enzimática em materiais modificados com metais potencializa a atividade das
enzimas ali imobilizadas, bem como a sua estabilidade, sem provocar alterações
estruturais na enzima. Este aumento da atividade pode estar relacionado as
partículas metálicas atuarem como cofatores enzimáticos e potencializarem a
atuação da enzima, se ligando aos aminoácidos carregados e polares, como
histidina, lisina, fenilalanina, cisteína e tirosina presentes nas enzimas (ROUF
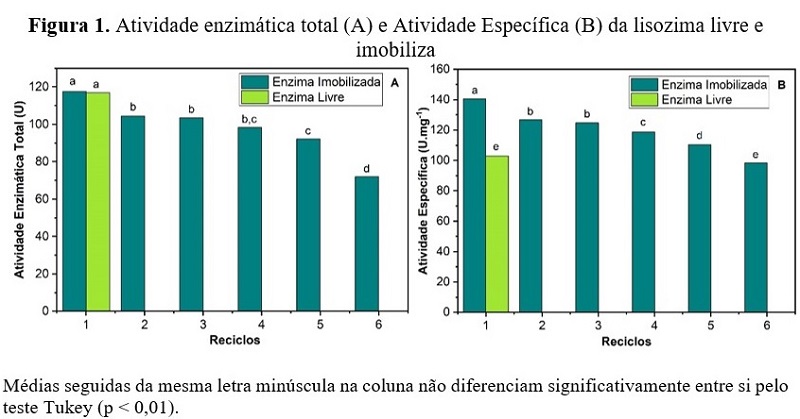
et al., 2020). A atividade enzimática para os ciclos de reutilização está
apresentada na Figura 1 e indicam que foi possível reutilizar a lisozima
imobilizada no suporte de criogel magnético. Analisando os ciclos de
reutilização foi possível observar que a enzima imobilizada na matriz magnética
manteve sua atividade por 6 ciclos de reutilização seguidas com uma atividade
total de 588,02 U. Além disso, pode ser observado que apenas o primeiro ciclo da
enzima imobilizada se iguala a enzima livre, de maneira que os ciclos de
utilização posteriores compensem os custos da imobilização. A lisozima
imobilizada apresentou uma eficiência de aproximadamente 100 % no primeiro ciclo
e 61,23 % no último ciclo, apresentando uma redução na atividade entre o
primeiro e o último ciclo de 38,76 %. O presente estudo apresenta melhor
eficiência na atividade quando comparados a alguns trabalhos da literatura, XUE
et al. (2019) apresentou 51,9 % e CHEN et al. (2018) 60 %, ambos
com suportes magnéticos para imobilização da lisozima após 6 ciclos de
utilização. Esta baixa perda de atividade entre os ciclos indica que a lisozima
imobilizada no criogel magnético apresenta uma capacidade de ser reutilizada por
mais vezes com uma boa estabilidade entres as reutilizações. De acordo com SUN
et al. (2017) biocatalizadores auxiliam em uma maior estabilidade das
enzimas, impedindo que as mesmas sejam dessorvidas ou inativadas durantes os
ciclos de utilização.
Conclusões
Foi possível desenvolver um biocatalizador magnético com potencial de utilização como suporte na imobilização de enzimas, pois a inserção de grupos reativos potencializou sua capacidade de imobilização em relação ao controle. A magnetização foi capaz de alavancar a atividade da enzima imobilizada, igualando a atividade da enzima na forma livre, garantindo 6 ciclos de utilização seguidos com baixa perda na atividade enzimática. Estes resultados demonstraram que a modificação do suporte gerou um material promissor, destacando as vantagens da estratégia de imobilização do ponto de vista econômico. Assim, estudos mais aprofundados devem ser conduzidos com intuído de aperfeiçoar e otimizar a imobilização de lisozima em criogéis, além de utilizar este suporte na imobilização de outras tipos e classes de enzimas, tornando a utilização de biocatalizadores uma ferramenta útil para reduzir custos em processos industriais.
Agradecimentos
A FAPESB, pela concessão da bolsa, ao Laboratório de Engenharia de Processos, e a Universidade Estadual do Sudoeste da Bahia.
Referências
ABRÃO, A. Operações de troca iônica. Ed1. São Paulo, Ipen, 2014
ACET, O.; BARAN. T.; ERDONMEZ, D.; AKSOY, N.; ALACABEY, I.; MENTES, A.; ODABASI, M. O-carboxymethyl chitosan Schiff base complexes as affinity ligands for immobilized metal-ion affinity chromatography of lysozyme. Journal of Chromatography, v 1550, 24-27, 2018.
ALNOCH, R. C., ALVES DOS SANTOS, L., MARQUES DE ALMEIDA, J., KRIEGER, N., MATEO, C. Recent trends in biomaterials for immobilization of lipases for application in non-conventional media. Catalysts, v 10, nº 6, 697, 2020.
ANASTAS, P. T.; RODRIGUEZ, A.; WINTER, T. M.; CISH, P.; ZIMMERMAN, J. B. A review of immobilization techniques to improve the stability and bioactivity of lysozyme. Green Chemistry Letters and Reviews, v 14, nº 2, 302-338, 2021.
ANDAÇ, M,; GALAEV, I. Y,; DENZLI, A. Affinity based and molecularly imprinted cryogels: Applications in biomacromolecule purification. Journal of Chromatography B, v 1021, p 69-80, 2016.
ATTA, A. M.; AL-LOHEDAN, H. A.; TAWFEEK, A. M.; AHMED, A. A. In situ preparation of magnetic Fe3O4.Cu2O.Fe3O4/cryogel nanocomposite powder via a reduction – coprecipitation method as adsorbent for methylene blue water pollutant. Polym Int, v. 67, 925-935, 2018.
BAYRAMOGLU, G.; KILIC, M.; ARICA, M. Y. Selective isolation and sensitive detection of lysozyme using aptamer based magnetic adsorbent and a new quartz crystal microbalance system. Food Chemistry, v 328, 132353, 2022.
BEZERRA, C. S., LEMOS, C. M. G. F., SOUSA, M., GONÇALVES, L. R. B. Enzyme immobilization onto renewable polymeric matrixes: Past, present, and future trends. Journal of Applied Polymer Science, v 132 , nº 26, 4215, 2015.
BILAL, M.; ZHAO, Y.; RASHEED, T.; NQBAL, H. M. N. Magnetic nanoparticles as versatile carries for enzymes immobilization: a review. International Journal of Biological Macromolecules, v 120, 2530-2544, 2018.
BOBER, P.; MINISY, I. M.; ACHARYA, U.; PFLEGER, J.; BABAYAN, V.; KAZANTSEVA, N.; HODAN, J.; STEJSKAL, J. Conducting polymer composite aerogel with magnetic properties for organic dye removal. Synthetic Metals, v 260, 116266, 2020.
BRADFORD, M. M. A Rapid and sensitive method for the quantitation of microgram of protein utilizing the principle of protein-dye binding. Analitycal Biochemitry, v 27, 248-254, 1976.
CHEN, Q.; LIU, D.; WU, C.; YAO, K.; LI, K.; SHI, N.; WEN, F.; GATES, I. D. Co-immobilization of cellulase and lysozyme on amino-functionalized magnetic nanoparticles: An activity-tunable biocatalyst for extraction of lipids from microalgae. Bioresource Technology, v 263, 317-324, 2018.
GONÇALVES, G. R. F.; GANDOLFI, O. R. R.; SANTOS, L. S.; BONOMO, R. C. F.; VELOSO, C. M.; VERÍSSIMO, L. A. A.; FONTAN; R. C. I. Immobilization of sugars in super macroporous cryogels for the purification of lectins by affinity chromatography. Journal of Chromatography B, v 1068, 71-77, 2017.
HUSEYNLI, S.; ÇIMEN, D.; BERELI, N.; DENIZLI, A. Fab fragment immobilized immunoaffinity cryogel as a tool for human serum albumin purification: Characterization of Fab immobilized cryogel. Journal of Chromatography B, nº 1203, 123311, 2022.
İSPIRLI-DOĞAÇ, Y., DEVECI, İ., MERCIMEK, B., TEKE, M. A comparative study for lipase immobilization onto alginate based composite electrospun nanofibers with effective and enhanced stability. International Journal of Biological Macromolecules, v 96, 302–311, 2017.
J., XU, B., SHI, Y., YANG, L., MA, H. Activity and stability of trypsin immobilized ontochitosan magnetic nanoparticles. Advances in Materials Science and Engineering. 1457072, 2017.
KHOSHNEVISAN, K., POORAKBAR, E., BAHARIFAR, H., BARKHI, M. Recent Advances of Cellulase Immobilization onto Magnetic Nanoparticles: An Update Review. Magnetochemistry, v 5, nº 2, 36, 2019.
KULKARNI, S., J. Enzyme Immobilization: Research and Studies. International Journal of Research & Review 32 v 3, 2016.
KUMAR, A.; BANSAL, V.; ANDERSSON, J.; ROYCHOUDHURY, P. K.; MATTIASSON, B. Supermacroporous cryogel matrix for integrated protein isolation immobilized metal affinity chromatographic purification of urokinase from cell broth of a human kidney cell line. Journal of Chromatography A, v 1103, 35-42, 2006.
LAOCHAI, T.; MOOLTONGCHU, M.; TEEPOO, S. Desing and construction of magnetic nanoparticles incoporated with a chitosan and poly (vinyl) alcohol cryogel and its application for a immobilization of horseadish peroxidase. Energy Procedia, v 89, 248-254, 2016.
MOHAN, D.; SARSWAT, A.; SINGH, V. K.; ALEXANDRE-FRANCO, M.; PITTMAN JR, C. U. Development of magnetic activated carbon from almond shells for trinitrophenol removal from water. Chemical Engineering Journal, v 172, 1111-1125, 2011.
MÓL, P. C. G.; VERÍSSIMO, L. A. A.; ELLER, M. R.; MINIM, V. P. R.; MINIM, L. A.; Development of an affinity cryogel for one-step purification of lysozyme from chicken egg white. Journal of Chromatography B, v 1044, p 17-23, 2017.
NONGONIERMA, A. B.; O’KEEFFE, M. B.; FITZGERALD, R. J. Milk protein hydrolysates and bioactive peptides. Advanced dairy chemistry, v 4, 417–482, 2016.
ROUF, S., GREISH, Y. E., AL-ZUHAIR, S. Immobilization of formate dehydrogenase in metal organic frameworks for enhanced conversion of carbon dioxide to formate. Chemosphere, v 267, 128921, 2020.
SANTOS, M. P. F.; BRITO, M. J. P.; JUNIOR, E. C.S.; BONOMO, R. C.F.; VELOSO, C. M. Pepsin immobilization on biochar by adsorption and covalent binding, and its application for hydrolysis of bovine casein, J Chem Technol Biotechnol, v 94, 1982–1990, 2019.
SANTOS, M. P. F.; PORFÍRIO, M. C. P.; SOUZA JR, E. C.; BONOMO, R. C. F.; VELOSO, C. M. Pepsin immobilization: Influence of carbon support functionalization. International Journal of Biological Macromolecules, v 203, 67-79, 2022.
SARANYA, P., RANJITHA, S., SEKARAN, G. Immobilization of thermotolerant intracellular enzymes on functionalized nanoporous activated carbon and application to degradation of an endocrine disruptor: kinetics, isotherm and thermodynamics studies. The Royal Society of Chemistry. 5: 66239–66259, 2015.
SHIEKH, P. A.; ANDRABI, S. M.; SINGH, A.; MAJUMDER, A.; KUMAR, A. Designing cryogel through cryoctructuring of polymeric matrices for biomedical applications. European Polymer Journal, n° 144, 110234, 2021.
SHUGAR, D. BBA - Biochim. Biophys. Acta, 8, 302, 1952.
SUN, J., XU, B., SHI, Y., YANG, L., MA, H. Activity and stability of trypsin immobilized ontochitosan magnetic nanoparticles. Advances in Materials Science and Engineering. 1457072, 2017.
SUN, J.; RAO, S.; SU, Y.; XU, R.; YANG, Y. Magnetic Carboxymethyl chitosan nanoparticles with immobilized metal ions for lysozyme adsorption. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v 389, 97-103.
VERÍSSIMO, L. A. A.; PAGANOTO, F. S.; MOL, P. C. G.; FONTAN, R. C. I.; MINIM, V. P. R.; MINIM, L. A. Preparation of an affinity cryogel column for lysozyme purification. Separation Science and Technology, v 52, n 12, 1973-1982, 2017.
XUE, F.; CHEN, Q.; LI, Y.; LIU, E.; LI, D. Immobilized lysozyme onto 1,2,3,4-butanetetracarboxylic (BTCA)-modified magnetic cellulose microsphere for improving bio-catalytic stability and activities. Enzyme and Microbial Technology, v 131, 109425, 2018.
















