ÁREA
Química de Materiais
Autores
Gomes, A.V.R. (UFPB) ; Gomes, R.M. (UFPB) ; Leite, R.H.L. (UFERSA) ; Menezes, F.L.G. (UFERSA) ; Santos, F.K.G. (UFERSA) ; Aroucha, E.M.M. (UFERSA)
RESUMO
Este trabalho teve por finalidade avaliar a influência da variação da cera de carnaúba, bagaço de cana-de-açúcar e tween 80 na densidade de biocompósitos de amido de milho produzidos pelo método de moldagem (casting). Os valores médios das densidades dos biocompósitos obtidos variaram entre 0,638 g·cm-3 e 0,931 g·cm-3 com, respectivamente, uma maior e menor concentração de bagaço de cana-de-açúcar em sua composição. A adição e o aumento da concentração do bagaço de cana-de- açúcar nos biocompósitos reduzem significativamente a densidade aparente dos materiais, enquanto que o aumento na concentração de cera de carnaúba, assim como de tween 80 proporciona um aumento na densidade aparente dos biocompósitos.
Palavras Chaves
Bagaço de cana-de-açúcar; cera de carnaúba; tween 80
Introdução
Os polímeros derivados do petróleo são os mais utilizados na indústria de embalagens para diversas aplicações como filmes, bolsas, recipientes, bandejas e outros componentes, em especial na indústria de embalagens para alimentos (CARISSIMI; FLÔRES; RECH, 2018; MENEZES et al., 2021; PINCELI et al., 2021; STARK; MATUANA, 2021). Entretanto, há uma preocupação crescente da sociedade com as questões ambientais e desenvolvimento sustentável, que força os pesquisadores e a indústria a desenvolverem novos materiais, dentro de um conceito de química verde, que refere-se a um ambiente sustentável que utiliza materiais e métodos biocompatíveis, biodegradáveis, renováveis, econômicos e simples (MALLAKPOUR; SIROUS; HUSSAIN, 2021; STARK; MATUANA, 2021). Dentre esses materiais ambientalmente sustentáveis, se sobressaem os biocompósitos, que são materiais constituídos por uma matriz biopolimérica reforçada com fibras vegetais. Esses materiais podem ser eliminados sem prejudicar o meio ambiente e surgem como alternativa aos compósitos de matrizes poliméricas sintéticas que são perigosos, biorecalcitrantes e possuem efeitos agressivos à saúde humana (JAWAID; SAPUAN; ALOTHMAN, 2017; PINCELI et al., 2021). A adição das fibras vegetais às matrizes biopoliméricas tem como principal objetivo o aumento na resistência à tração (ENGEL; AMBROSI; TESSARO, 2019; GOMES et al., 2019; MALEKZADEH; TATARI; FIROUZABADI, 2023), visto que os biopolímeros, em especial à base de amido, apresentam uma baixa resistência mecânica. Enquanto que a densidade dos biopolímeros a base de amido é elevada, com valores como 1,210 g·cm-3 (PELISSARI et al., 2017), 1,432 g·cm-3 (IBRAHIM et al., 2014) e 1,730 g·cm-3 (EDHIREJ et al., 2017). Com a incorporação de fibras vegetais ocorre uma redução na densidade de compósitos de matriz biopolimérica, devido à maior densidade desta em relação às fibras, bem como à formação de poros em grandes concentrações de reforço (PELISSARI et al., 2017; GOMES, et al., 2019; MAHMUD; BELAL; GAFUR, 2023). Com relação à aplicação prática de embalagens como bandejas, a densidade é uma das propriedades físicas mais importantes, sendo desejável uma baixa densidade, visto que reduz os custos de produção na fabricação (FERREIRA; MOLINA; PELISSARI, 2020). Portanto, o propósito deste trabalho é avaliar a influência da variação da composição na densidade de biocompósitos de amido de milho, bagaço de cana-de-açúcar e cera de carnaúba produzidos pelo método de moldagem (casting).
Material e métodos
Para a produção dos biocompósitos foram utilizados amido de milho, cera de carnaúba tipo I, bagaço de cana-de-açúcar obtido de resíduos agrícolas, glicerol e tween 80. As variáveis independentes utilizadas foram os percentuais de cera de carnaúba (CC), bagaço de cana-de-açúcar (BC), e tween 80 (T80) e as formulações dos biocompósitos podem ser observadas na Tabela 1. Após ser lavado em água corrente e cortado em pedaços menores, o bagaço da cana-de-açúcar foi levado para secagem em uma estufa com renovação de ar (MODELO TE-394/1 da TECNAL) a 80°C durante 120 h. Subsequentemente, o material foi moído em um moinho de facas tipo Willey SL – 31 da SOLAB e o pó obtido foi peneirado em um agitador de peneiras LUCA-04/01 da Lucadema. A maior quantidade de pó obtido e que foi utilizado para produção dos biocompósitos foi entre 20 e 60 Mesh. O método utilizado para produção dos biocompósitos foi o de moldagem (casting) com 35% de massa seca. Para pesagem dos materiais foi utilizada uma balança analítica de precisão digital (AY220 da Marte) com resolução de 0,0001g. O amido de milho, glicerol (20%) e água destilada foram misturados sob agitação constante por um agitador magnético com aquecimento LUCA-0851 da Lucadema por aproximadamente 30 minutos, a 90°C em um banho térmico, até a completa gelatinização do amido. Em outro agitador, a cera de carnaúba e o tween 80 foram misturados sob agitação constante, a uma temperatura de 90°C em um banho térmico, até formar uma emulsão, na qual foi adicionada o amido gelatinizado em pequenas quantidades até homogeneizar. O pó do bagaço de cana-de-açúcar com granulometria entre 250-841 µm foi incorporado a esta mistura sob agitação constante por meio de um agitador planetário PHP500 TURBO da Philco. Em seguida, as misturas foram prensadas em moldes com 235 mm x 135 mm e, após desmoldadas, foram encaminhadas para secagem em uma estufa com renovação de ar (MODELO TE- 394/1 da TECNAL) a 50°C durante 72 h. Após a secagem, foram obtidos os corpos de prova de 20 mm x 20 mm, que foram condicionados até obtenção de massa constante antes da caracterização em um recipiente hermeticamente fechado a 20°C e umidade relativa (UR) de 75,5±0,2%, mantida utilizando uma solução saturada de NaCl, preparada conforme a norma ASTM E104-20a. As espessuras dos corpos de prova foram medidas com um micrômetro analógico da EDA com resolução de 0,01 mm. Os corpos de prova foram pesados em uma balança analítica de precisão digital (AY220 da Marte) com resolução de 0,0001g e foi calculada a densidade aparente (g·cm-3), segundo a norma ASTM D792, por meio da razão entre massa e volume do corpo de prova. Foram realizadas cinco repetições das medidas nos biocompósitos e calculadas a média. Para comparar as densidades das diferentes composições dos biocompósitos foi realizada uma ANOVA e o teste de Fisher para verificar se as diferenças eram estatisticamente significativas com p < 0,05, utilizando o software Statistica® 12.5 (StatSoft, Inc., USA).
Resultado e discussão
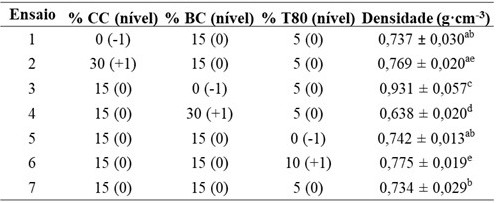
Na Tabela 1 podem ser observados os valores da densidade aparente dos
biocompósitos.
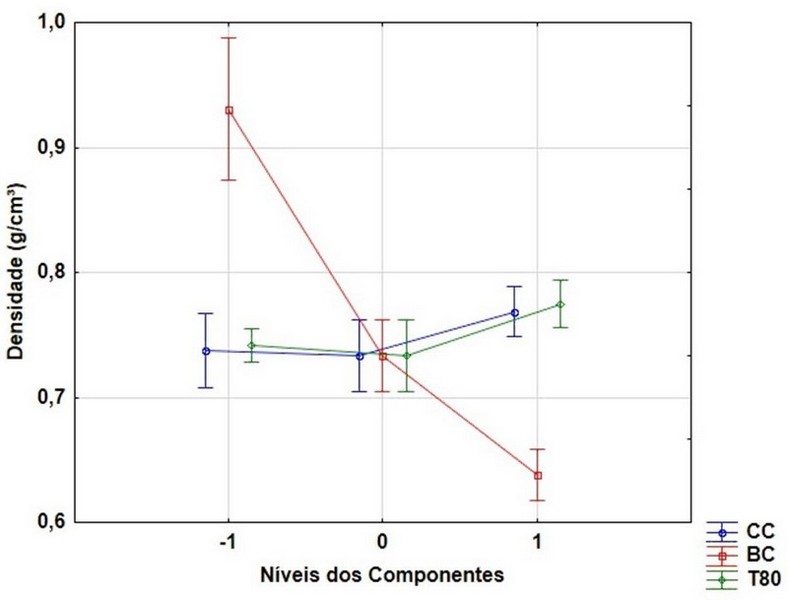
A variação da densidade em função da composição (em níveis) de cada um dos
componentes dos biocompósitos pode ser observada na Figura 1.
Observa-se que com a adição da cera de carnaúba não há uma variação
significativa na densidade dos biocompósitos, que apresentam um valor médio de
0,737 g·cm-3 para o ensaio 1, que não tem cera de carnaúba em sua composição, e
de 0,734 g·cm-3 no caso do ensaio 7, que possui 15% de cera de carnaúba em sua
composição. Contudo um aumento na concentração da cera de carnaúba promove um
aumento significativo da densidade dos biocompósitos, como pode ser visto na
Figura 1, bem como na diferença significativa entre as densidades do ensaio 7 e
2, que possuem respectivamente 15% e 30% de cera de carnaúba em suas formulações
e o ensaio 2 apresenta uma densidade média de 0,769 g·cm-3. A densidade da cera
de carnaúba é de 0,990 g·cm-3 (GAO; FRITSCHING, 2010), enquanto que a densidade
dos biopolímeros geralmente são valores maiores como 1,210 g·cm-3 (PELISSARI et
al., 2017), 1,432 g·cm-3 (IBRAHIM et al., 2014) e 1,730 g·cm-3 (EDHIREJ et al.,
2017). Desse modo, o aumento da densidade do biocompósito com o aumento da
concentração da cera de carnaúba não é devido à densidade deste componente,
visto que é menor que a da matriz biopolimérica. Portanto, esse comportamento
pode ser explicado pela compactação dos biocompósitos e redução dos poros e
vazios com a adição e aumento da cera de carnaúba à matriz de amido de milho, o
que possivelmente se deve à ação do tween 80 como substância anfifílica, capaz
de se ligar a substâncias polares e apolares, as quais nos biocompósitos são,
respectivamente, a matriz de amido de milho e a cera de carnaúba (SANTOS et al.,
2017; CARISSIMI; FLÔRES; RECH, 2018).
Com relação ao bagaço de cana-de-açúcar, pode-se observar na Figura 1
que tanto a adição quanto o aumento da concentração deste componente nos
biocompósitos proporciona uma redução significativa na densidade, como visto nos
valores médios da Tabela 1 dos ensaios 3 (0,931 g·cm-3), 7 (0,734 g·cm-3) e 4
(0,638 g·cm-3), com respectivamente 0%, 15% e 30% de bagaço de cana-de-açúcar na
composição destes biocompósitos. O bagaço de cana-de-açúcar apresenta uma
densidade entre 18,72 g·cm-3 e 54,2 g·cm-3 (MAHMUD; ANANNYA, 2021), portanto
bastante inferior à densidade da matriz de amido de milho, o que explica a
redução na densidade dos biocompósitos. Esse mesmo comportamento foi observado
em outros trabalhos em que fibras vegetais foram adicionadas às matrizes
biopoliméricas (PELISSARI et al., 2017; ENGEL; AMBROSI; TESSARO, 2019; MAHMUD;
BELAL; GAFUR, 2023).
Com relação ao tween 80, pode-se observar na Figura 1 que a adição deste
componente não produz uma variação significativa na densidade dos biocompósitos
dos ensaios 5 (0,742 g·cm-3) e 7 (0,734 g·cm-3), com respectivamente 0% e 5% de
tween 80. Enquanto que o aumento na concentração proporciona um aumento
significativo na densidade, como observado no ensaio 6, que possui 10% de tween
80 em sua composição, com um valor de densidade média de 0,775 g·cm-3. A
densidade do tween 80 é de 1,064 g·cm-3 (SAENTON; ILLANGASEKARE, 2013).
Portanto, o aumento na densidade com o aumento na concentração desse componente
não se deve à sua densidade, visto que é inferior à densidade da matriz de amido
de milho. Esse comportamento pode ser devido à melhor compactação dos
biocompósitos com a presença do tween 80, que, por se tratar de uma substância
anfifílica, promove uma melhor interação entre a cera de carnaúba e a matriz de
amido de milho (SANTOS et al., 2017; CARISSIMI; FLÔRES; RECH, 2018), reduzindo a
formação de aglomerados de cera e vazios, proporcionando um aumento na densidade
dos biocompósitos.
Os valores médios das densidades dos biocompósitos obtidos variaram entre 0,638
g·cm-3 do ensaio 4 com uma maior concentração de bagaço de cana-de-açúcar, e
0,931 g·cm-3 do ensaio 3, que não apresenta bagaço de cana-de-açúcar em sua
composição. Portanto, a incorporação de fibras vegetais geralmente promove uma
redução na densidade de compósitos de matriz biopolimérica, devido à maior
densidade desta em relação às fibras, bem como à formação de poros em grandes
concentrações de reforço (PELISSARI et al., 2017; GOMES, et al., 2019; MAHMUD;
BELAL; GAFUR, 2023). Trabalhos de biocompósitos com matrizes biopoliméricas
reforçados com fibras vegetais apresentaram valores de densidade entre 1,15
g·cm-3 e 1,17 g·cm-3 (PELISSARI et al., 2017), 0,18 g·cm-3 (ENGEL; AMBROSI;
TESSARO, 2019), 0,12 g·cm-3 e 0,21 g·cm-3 (FERREIRA; MOLINA; PELISSARI, 2020) e
0,61 g·cm-3 (MAHMUD; BELAL; GAFUR, 2023).
Densidade aparente dos biocompósitos (resultados \r\nestão apresentados como média ± intervalo de \r\nconfiança para um valor p < 0,05).
Variação da densidade dos biocompósitos em função da \r\ncomposição (em níveis) da cera de carnaúba (CC), \r\nbagaço de cana-de-açúcar (BC) e tween 80 (T80).
Conclusões
Com base nos resultados obtidos, a adição bem como o aumento da concentração do bagaço de cana-de-açúcar nos biocompósitos reduzem significativamente a densidade aparente dos materiais, como esperado da adição de fibras vegetais em matrizes biopoliméricas. Por outro lado, o aumento na concentração de cera de carnaúba, assim como de tween 80 proporciona um aumento na densidade aparente dos biocompósitos, devido à uma melhor compactação dos biocompósitos na presença desses componentes.
Agradecimentos
Os autores agradecem ao CNPQ, à UFERSA e à UFPB pelo apoio financeiro.
Referências
ASTM – American Society for Testing Materials. ASTM D792 – 13: Standard Test Methods for Density and Specific Gravity (Relative Density) of Plastics by Displacement. In: Annual Book of ASTM, 2013.
ASTM – American Society for Testing Materials. ASTM E104 – 20: Standard Practice for Maintaining Constant Relative Humidity by Means of Aqueous Solutions. In: Annual Book of ASTM, 2020.
CARISSIMI, M.; FLÔRES, S. H.; RECH, R. Effect of microalgae addition on active biodegradable starch film. Algal Research, v. 32, p. 201-209, 2018.
EDHIREJ, A.; SAPUAN, S. M.; JAWAID, M.; ZAHARI, N. I. Cassava/sugar palm fiber reinforced cassava starch hybridcomposites: Physical, thermal and structural properties. International Journal of Biological Macromolecules, v. 101, p. 75-83, 2017.
ENGEL, J. B.; AMBROSI, A.; TESSARO, I. C. Development of biodegradable starch-based foams incorporated with grape stalks for food packaging. Carbohydrate Polymers, v. 225, p. 1-10, 2019.
FERREIRA, D. C. M.; MOLINA, G.; PELISSARI, F. M. Biodegradable trays based on cassava starch blended with agroindustrial residues. Composites Part B, v. 183, p. 1-10, 2020.
GAO, S.; FRITSCHING, U. Study of binary in-flight melt droplet collisions. Materialwissenschaft und Werkstofftechnik, v. 41, p. 547-553, 2010.
GOMES, A. V. R.; GONÇALVES, F. C. P.; SILVA JÚNIOR, M. Q.; LEITE, R. H. L.; SANTOS, F. K. G.; AROUCHA, E. M. M. Effect of Carnauba Wax and Coconut Fiber Contents on Tensile Properties of Corn Starch-Based Biocomposites. Materials Research, v. 22, p. 1-7, 2019.
IBRAHIM, H.; FARAG, M.; MEGAHED, H.; MEHANNY, S. Characteristics of starch based biodegradable composites reinforced with date palm and flax fibers. Carbohydrate Polymers, v. 101, p. 11-19, 2014.
JAWAID, M.; SAPUAN, S. M.; ALOTHMAN, O. Y. (EDS.). Green Biocomposites: Manufacturing and Properties. Cham, Switzerland: Springer International Publishing, 2017.
MAHMUD, M. A.; ANANNYA, F. R. Sugarcane bagasse - A source of cellulosic fiber for diverse applications. Heliyon, v. 7, p. 1-14, 2021.
MAHMUD, M. A.; BELAL, S. A.; GAFUR, M. A. Development of a biocomposite material using sugarcane bagasse and modified starch for packaging purposes. Journal of Materials Research and Technology, v. 24, p. 1856-1874, 2023.
MALLAKPOUR, S.; SIROUS, F.; HUSSAIN, C. M. A journey to the world of fascinating ZnO nanocomposites made of chitosan, starch, cellulose, and other biopolymers: Progress in recente achievements in eco-friendly food packaging, biomedical, and water remediation Technologies. International Journal of Biological Macromolecules, v. 170, p. 701-716, 2021.
MALEKZADEH, E.; TATARI, A.; FIROUZABADI, M. D. Preparation, characteristics, and soil-biodegradable analysis of corn starch/nanofibrillated cellulose (CS/NFC) and corn starch/nanofibrillated lignocellulose (CS/NFLC) films. Carbohydrate Polymers, v. 309, p. 1-12, 2023.
MENEZES, F. L. G.; LEITE, R. H. L.; SANTOS, F. K. G.; ARIA, A. I.; AROUCHA, E. M. M. TiO2-enhanced chitosan/cassava starch biofilms for sustainable food packaging. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 630, p. 1 10, 2021.
PELISSARI, F. M.; MAHECHA, M. M. A.; SOBRAL, P. J. D. A.; MENEGALLI, F. C. Nanocomposites based on banana starch reinforced with cellulose nanofibers isolated from banana peels. Journal of Colloid and Interface Science, v. 505, p. 154-167, 2017.
PINCELI, I. P.; CASTILHOS JÚNIOR, A. M.; MATIAS, M. S.; RUTKOWSKI, E. W. Post-consumer plastic packaging waste flow analysis for Brazil: The challenges moving towards a circular economy. Waste Management, v. 126, p. 781-790, 2021.
SAENTON, S.; ILLANGASEKARE, T. H. Effects of incomplete remediation of NAPL-contaminated aquifers: experimental and numerical modeling investigations. Applied Water Science, v. 3, p. 401-414, 2013.
SANTOS, F. K. G.; OLIVEIRA SILVA, K. N.; XAVIER, T. D. N.; LEITE, R. H. L.; AROUCHA, E. M. M. Effect of the Addition of Carnauba Wax on Physicochemical Properties of Chitosan Films. Materials Research, v. 20, p. 479-484, 2017.
STARK, N. M.; MATUANA, L. M. Trends in sustainable biobased packaging materials: a mini review. Materials Today Sustainability, v. 15, p. 1-9, 2021.
















