ÁREA
Química de Materiais
Autores
Fíngolo Duarte, T. (UFRJ) ; dos Santos Vita, F. (UFRJ) ; D\'elia, E. (UFRJ)
RESUMO
A corrosão é um processo espontâneo que ocorre em vários setores da sociedade causando gastos substanciais. Nesse contexto, surgem os revestimentos anticorrosivos como medida protetiva. Neste trabalho, foi avaliado o óxido de grafeno (OG) e os pontos quânticos de carbono (PQC) como filmes protetores. No caso do OG, para j =10 mA.cm-2, obteve-se maior arco capacitivo, módulo de impedância (|Z|= 8363 Ω.cm-²) e ângulo de fase máximo (-Φmáx = 71°). Baseando-se nesse estudo, três concentrações de PQC foram estudadas, sendo elas 0,03 g/L, 0,04 g/L e 0,05 g/L. A concentração de 0,05 g/L apresentou maior arco capacitivo, módulo de impedância (|Z|= 13.351 Ω.cm-²) e ângulo de fase máximo (- Φmáx = 74°). Assim, pode-se concluir que ambos os materiais possuem potencial anticorrosivo.
Palavras Chaves
Revestimento; Óxido de Grafeno; Pontos Quânticos
Introdução
A corrosão pode ser definida como a deterioração de um material, metálico ou não, por ação química ou eletroquímica e pode estar associada a esforços mecânicos (GENTIL, 1996). Esse fenômeno ocasiona vários desgastes no material, como modificações químicas e estruturais, tornando o material inviável para uso. Segundo The World Corrosion Organization (WCO), a corrosão é um fenômeno presente em vários setores da sociedade, como infraestrutura e produção de tecnologias. De acordo com o levantamento recente da organização, no âmbito mundial, gasta-se 3 trilhões de dólares por ano para mitigar processos corrosivos. Dessa forma, é importante investir em novas tecnologias capazes de aumentar a vida útil de peças metálicas. Como mecanismo de proteção há proteção catódica e anódica, inibidores e revestimentos anticorrosivos (FRAUCHES-SANTOS et al., 2014). Neste trabalho, o mecanismo adotado foi o de revestimentos, onde foi explorado o uso do óxido de grafeno (OG) e pontos quânticos de carbono (PQC) como potenciais revestimentos protetores e ambientalmente amigáveis. O grafeno é um alótropo do carbono com estrutura bidimensional e ligações sp2 entre os átomos de carbono. Esse material possui grande aplicabilidade tecnológica por possuir alta condutividade elétrica e térmica, resistência mecânica e propriedades ópticas. O OG é um material derivado desse alótropo com estrutura semelhante, mas que possuí funcionalizações de superfície, como grupos epóxi, hidróxidos e ácidos carboxílicos, tornando esse derivado mais hidrofílico que o grafeno (FERREIRA OLIVEIRA et al., 2019). O óxido de grafeno reduzido (OGr) é obtido através da redução dos grupos funcionais do OG, que pode ocorrer por processos térmicos e químicos. Esses derivados têm sido utilizados como materiais alternativos ao grafeno. Os pontos quânticos de carbono (PCQ) são materiais amorfos ou semicristalinos, quase esféricos e com as três dimensões em escala nanométrica, possuindo diâmetros de até 10 nm. Devido ao seu tamanho nanométrico, esse material é um semicondutor portador de cargas que estão em confinamento quântico (elétrons e buracos) (UMAR et al., 2023). Essa característica é responsável pela luminescência apresentada por esses materiais. Sabe-se que a absorção e emissão dos PQC ocorre no visível e regiões próximas e está diretamente ligada ao tamanho da partícula. De forma qualitativa, quanto menor a partícula mais expostos estão os elétrons e buracos à estrutura cristalina, assim, níveis discretos de energia surgem nas bandas de valência e condução e a energia do bandgap, isto é, a banda proibida fica maior (MACHADO; MERLINI, 2019). Devido a essas propriedades luminescentes, baixa toxicidade e alta biocompatibilidade, os PQC são materiais promissores para os próximos anos, podendo ser aplicados em várias áreas como química, petroquímica, biomédica e ambiental.
Material e métodos
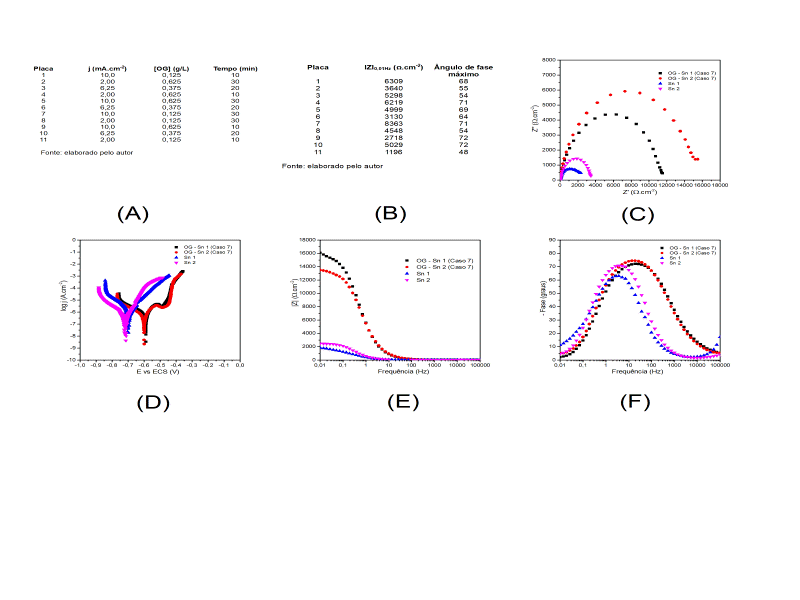
Inicialmente foi realizado um planejamento experimental baseado no modelo estatístico de triagem Plackett-Burman (Figura 1-(A)). Através desse planejamento foram estudados três valores de densidade de corrente que foram 2 mA cm-2, 6,25 mA cm-2, 10 mA cm-2 e de tempo de deposição de 10, 20 e 30 minutos. Ao todo foram realizados 11 casos diferentes alternando essas condições, para avaliar a condição com melhor desempenho. O OG foi produzido a partir do óxido de grafite. O óxido de grafite foi obtido pelo método Hummers (1958), onde 1 g de grafite em pó foi misturado a 0,5 g de NaNO3 em banho de gelo para controle da temperatura. Sequencialmente, 25 mL de H2SO4 concentrado foram adicionados sob agitação magnética. Aos poucos, foram adicionados à solução 10 g de KMnO4. Após a homogeneização, o sistema foi aquecido a 35 °C por 3 horas. Decorrido esse tempo, 50 mL de água deionizada foram adicionados à mistura, a qual foi mantida sob aquecimento por mais 15 minutos. Por fim, foram adicionados 166 mL de água destilada e 10 mL de H2O2 30 volumes. Para a purificação do óxido de grafite, 60 mL de água destilada com 8 mL de HCl concentrado foram adicionados ao sistema. Posteriormente, aguardou-se uma semana até a sedimentação do óxido de grafite. Após isso, o sólido remanescente foi isolado em um vidro de relógio e seco em estufa a 50 °C. Para fazer o OG, 1 g do óxido de grafite foi adicionado a 140 mL de água deionizada, essa solução foi mantida em banho de ultrassom por 20 h para a esfoliação química e obtenção do OG. O compósito de OG-Sn foi obtido a partir da mistura do OG ao banho de estanho. O banho de estanho foi obtido através da mistura de 20 g/L de Sulfato de estanho (II), 20 g/L de Acetato de sódio, 140 g/L de Gluconato de sódio e 0,5 g/L de Lauril sulfato de sódio. Três diferentes concentrações de OG-Sn foram estudadas, a saber: 0,625 g/L, 0,375 g,L e 0,125 g/L. A densidade de corrente do melhor resultado foi aplicada ao estudo do PQC. O PQC foi sintetizado a partir do ácido cítrico, em que 10 g desse material foram aquecidos a 200 °C por 2 horas em sistema aberto. Após isso foi adicionada água deionizada e o sistema foi posto em ultrassom para dissolução. Em seguida foi feito o pós-tratamento: filtração, diálise, centrifugação para obtenção do sobrenadante e secagem em estufa a 50 °C. Os compósitos PQC-Sn foram obtidos seguindo a mesma metodologia do compósito OG-Sn. As três concentrações de PQC estudadas foram: 0,03 g/L, 0,04 g,L e 0,05 g/L. Placas de aço 1020 de área aproximada de 4,2 cm2 foram utilizadas como corpo de prova e as eletrodeposições foram realizadas em modo galvanostático. Todas as deposições foram analisadas por técnicas eletroquímicas, sendo elas: medidas de potencial de circuito aberto, curvas de polarização potenciodinâmica e medidas de impedância eletroquímica.
Resultado e discussão
A Tabela 2 (Figura 1 – (B)) mostra os resultados do módulo de impedância e
ângulo de fase máximo obtidos no estudo do planejamento experimental Plackett-
Burman dos revestimentos Sn-OG. Como pode ser observado o caso 7 obteve o maior
módulo de impedância (|Z|= 8363 Ω.cm-²) e o maior ângulo de fase máximo (-Φmáx =
71°). Esses resultados demonstram que dentre todos os revestimentos compósitos
de OG-Sn, esse é o que mais se aproxima de um capacitor ideal (-Φmáx = 90°)
(VITA, 2023).
A Figura 1 ((C), (E) e (F)) apresenta os diagramas de impedância eletroquímica
(Nyquist e Bode) e as curvas de polarização (Figura 1 – (D)) do revestimento
compósito de OG-Sn obtido pelas condições do caso 7 do planejamento e do
revestimento de Sn. A adição de OG ao revestimento aumentou significativamente o
diâmetro do arco capacitivo, o módulo de impedância, bem como o ângulo de fase
máximo. As curvas de polarização do revestimento compósito de OG-Sn deslocaram
bastante para valores mais positivos e mostraram uma queda nas densidades de
corrente anódica, demonstrando mais uma vez que a adição de OG melhorou a
qualidade do revestimento frente a processos de oxidação. Esses resultados
corroboram com a condição de melhor desempenho encontrada por GUPTA;
SRIVASTAVA, 2018 .
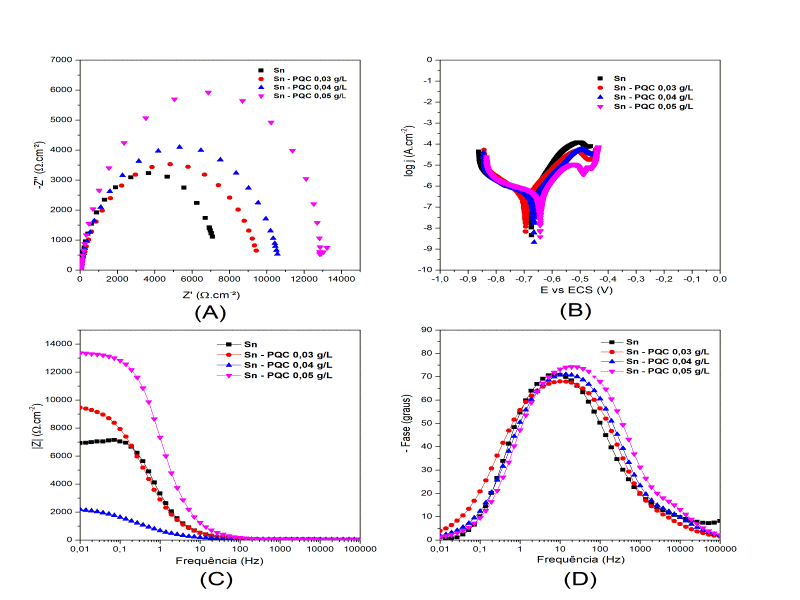
A Figura 2 apresenta os resultados eletroquímicos do compósito Sn-PQC. Vale
ressaltar que a densidade de corrente usada na obtenção dos revestimentos em
todos os ensaios eletroquímicos foi igual a 10 mA.cm-2. Como pode ser observado,
o Diagrama de Nyquist (Figura 2 – (A)) mostra um aumento no arco capacitivo
conforme é adicionado PQC, indicando que a adição desse nanomaterial melhorou a
resistência à transferência de carga em relação ao revestimento de Sn puro. O
módulo da impedância (Figura 2 – (C)) é maior para os compósitos Sn – PQC 0,03
g/L e Sn – PQC 0,05 g/L em comparação ao Sn puro, já para o caso Sn-PQC 0,04 g/L
observa-se um módulo menor que do Sn. Destaca-se ainda que o compósito Sn-PQC
0,05 g/L apresentou o maior módulo de impedância e maior ângulo de fase máximo,
sendo eles respectivamente: 13.351 Ω.cm², -Φmáx =74,3° (Figura 2 – (C) e (D)).
Comparando o módulo da impedância e o ângulo de fase do Sn-PQC 0,05 g/L com o
resultado do caso 7 do Sn-OG, pode-se observar um desempenho equivalente,
evidenciando o potencial protetivo desse novo material. O perfil das curvas de
polarização (Figura 2 – (B)) encontrado para esse compósito se assemelha ao
encontrado para o caso 7 (Sn-OG), indicando que em ambos os casos os
revestimentos apresentam potencial protetivo melhor que o revestimento metálico
puro de Sn.
Conclusões
Em ambos os casos se observou a existência de uma condição ideal, sendo o caso 7 para Sn–OG, e para o Sn–PQC a concentração de 0,05 g/L de PQC. O OG é um material que vem sendo estudado há muito tempo e é sabido sua vasta aplicabilidade. No entanto, ponto quântico de carbono é um novo material com as propriedades ainda pouco exploradas, principalmente em corrosão. Como demonstrado nesse trabalho, o PQC pode ser um material alternativo ao OG, com propriedades promissoras para ser aplicado em várias áreas. Assim, mediante os resultados obtidos foi possível atestar o potencial anticorrosivo dos PQC, demonstrando que sua adição pode melhorar de forma eficaz revestimentos já consolidados na indústria.
Agradecimentos
Instituto de Química (IQ-UFRJ), CNPq, FINEP, PRH 20.1, ANP;
Referências
FERREIRA OLIVEIRA, ANA ELISA et al. Synthesis, studies and structural characterization of thermal and hydrazine reduction of graphene oxide by raman spectroscopy and infrared spectroscopy. Revista Virtual de Quimica v. 11, n. 3, p. 866–877 , 2019.
VITA, F.D.S.Novos revestimentos anticorrosivos com base em compósitos Sn-ÓXIDO DE GRAFENO. Trabalho de conclusão de curso. Universidade Federal do Rio de Janeiro - UFRJ, 2013.
FRAUCHES-SANTOS, CRISTIANE et al. The corrosion and the anticorrosion agents. Revista Virtual de Quimica v. 6, n. 2, p. 293–309 , 2014.
GENTIL, VICENTE (Escola de Química - UFRJ). CORROSÃO. 3° Edição ed. [S.l.]: LTC - Livros Técnicos e Científicos Editora S.A., 1996. 373 p. .
GEORGE F. HAYS. Now is the Time. World Corrosion Organization (WCO),2009.
GUPTA, ABHAY; SRIVASTAVA, CHANDAN. Optimum amount of graphene oxide for enhanced corrosion resistance by tin-graphene oxide composite coatings. Thin Solid Films v. 661, p. 98–107 , 2018. Disponível em: <https://doi.org/10.1016/j.tsf.2018.07.016>.
HUMMERS Jr, W. S., & OFFEMAN, R. E. (1958). Preparation of graphitic oxide.Journal of the American Chemical Society, 80(6), 1339-1339.
MACHADO, THAIS ROSANA CUGNIER.; MERLINI, CLAUDIA. Síntese e caracterização de pontos quânticos de carbono e produção de nanocompósitos poliméricos fotoluminescentes. p. 65 , 2019.
SCHMITT, G. et.al. Global Needs for Knowledge Dissemination, Research, and Development in Materials Deterioration and Corrosion Control. The World Corrosion Organization (WCO),2009.
















