ÁREA
Química de Alimentos
Autores
Honfoga, J.N.B. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; do Nascimento, I.S. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Bonomo, R.C.F. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA)
RESUMO
A enzima L-asparaginase é usada em alimentos para mitigar o nível de acrilamida, considerada cancerígena. A busca constante de novas fontes microbianas e substratos alternativos para a sua produção, levou este estudo a testar sua produção por fermentação em estado sólido usando o fungo Aspergillus niger e resíduos de pitaya como substrato. Para isso, foi realizada uma cinética fermentativa, onde a fermentação foi realizada a uma temperatura de 25°C com uma umidade de 70% e 1,5% de indutor L-asparagina. O extrato bruto obtido foi analisado quanto à atividade enzimática da L-asparaginase e o teor de proteina total. Os tempos 36h e 48h obtiveram maiores valores de atividades. Os teores de proteinas foram crescentes. Concluiu-se que o substrato usado é promissor na produção da enzima
Palavras Chaves
resíduos de pitaya; fungos filamentosos; L-asparaginase
Introdução
A L-asparaginase é uma enzima que atua como uma amidohidrolase, catalisando a hidrólise da L-asparagina para gerar amônia e ácido L-aspártico (MAQSOOD et al., 2020). Em consequência disso, esta enzima tem sido objeto de estudos abrangentes devido à sua variada gama de aplicações, sobretudo em contextos terapêuticos, onde é empregada como agente quimioterápico no tratamento da leucemia linfoblástica aguda (NIU et al., 2021), e na indústria de alimentos por ser usada para mitigar a formação de acrilamida em alimentos que apresentam açúcar redutor e L- asparagina em suas composições (YIM; KIM, 2019) A acrilamida é uma substância química considerada pela (IARC) como um possível agente cancerígeno para os seres humanos(IARC, 1994). Ela é formada em alimentos amiláceoas a partir da reação do grupo amino do L-asparagina com o grupo carbonila dos açúcares redutores, presentes nesses alimentos, na ocorrência da reação de Maillard em temperatura acima de 120°C (Meghavarnam & Janakiraman, 2018). Tendo em vista o seu potencial carcinogênico, a União Europeia (EU) implementou normas legais em 2018 com o objetivo de limitar a quantidade residual de acrilamida em produtos alimentares, inclusive no caso dos salgadinhos de batata (750 μg/kg), batatas fritas (500 μg/kg), café torrado (400 μg/kg), e biscoitos (350 μg/kg) (FSA, 2018). Dessa forma, torna-se relevante a aplicação da L-asparaginase como agente tecnológico nos alimentos em questão para remover a L-asparagina, um dos principais precursores da acrilamida (Meghavarnam & Janakiraman, 2018, YIM; KIM, 2019). Dentre as fontes microbianas para a produção da L-asparaginase, a fonte bacteriana é a mais explorada, sendo as principais bactérias Escherichia coli e Erwinia carotovora, onde a enzima é utilizada como droga injetável principalmente em crianças com leucemia linfoblástica aguda (BATOOL, et al., 2016; IZADPANAH, et al., 2018). No entanto, as enzimas produzidas por essa fonte podem causar reações alérgicas. Assim, a busca por outras fontes microbianas produtoras de L-asparaginase, como micro-organismos eucariontes, torna-se necessária para obter enzimas com menos efeitos adversos (PATRO & GUPTA, 2012). Os fungos filamentosos são tidos como uma fonte segura para produzir a L- asparaginase devido à sua natureza como microrganismos eucariontes, que compartilham semelhanças com as células humanas. Portanto, as L-asparaginases de origem fúngica são amplamente reconhecidas como seguras pela JECFA (Joint FAO/WHO Expert Committee on Food Additives, 2007) e são usados em alimentos como aditivos, principalmente na mitigação de nível de acrilamida (XU, ORUNA-CONCHA, & ELMORE, 2016). A produção da L-asparaginase por microrganismos, como fungos, pode ser realizada através da fermentação submersa ou da fermentação em estado sólido. A fermentação submersa é uma técnica amplamente consolidada que resulta em altos rendimentos, no entanto, produz consideráveis volumes de águas residuais e envolve custos elevados de produção. Por outro lado, a fermentação em estado sólido utiliza resíduos agroindustriais de baixo custo como substrato, apresentando potenciais vantagens ambientais, como diminuição de resíduos e seus impactos (IZADPANAH, et al., 2018; THOMAS et al., 2013). Devido a isso, a fermentação em estado sólido vem sendo bastante explorada para produzir essa enzima com emprego considerável de fungos filamentos de gêneros Aspergillus, Cladosporium, Eupenicillium, Fusarium, Penicillium (VIEIRA et al. 2020). Neste contexto, o Aspergillus niger é um dos fungos mais estudados do gênero Aspergillus para produzir a L-asparaginase usando fontes alternativas como resíduos agroindustriais através da fermentação em estado sólido. A produção de L-asparaginase foi otimizada em fermentação em estado sólido a partir de Aspergillus niger usando bagaço de óleo de gergelim preto como substrato (UPPULURI et al. 2013). Dias et al. (2015) usaram a mistura de farelo de trigo, farelo de soja e caroço de algodão para produzir L-asparaginase a partir de Aspergillus niger por fermentação em estado sólido. Cunha et al. (2018) produziram L-asparaginase a partir de Aspergillus niger usando como substrato uma mistura de farelo de trigo, farinha de arroz e farinha de casca de maracujá. A busca pelas novas fontes alternativas revelou o potencial de plantas da família Cactaceae em produzir L-asparaginase. Rabelo (2021) produziu L- asparaginase a partir de Aspergillus caespitosus por fermentação em estado sólido usando fibra de ora-pro-nóbis e soro de leite. Da mesma forma, o pé de pitaya é uma Cactaceae e não há na literatura o registro do uso do seu resíduo como substrato para a produção de L-asparaginase. Diante deste cenário, este trabalho objetivou-se estudar a produção da L- asparaginase por fermentação em estado sólido a partir de Aspergillus niger usando como substrato resíduos de pitaya para uma possível aplicação em alimentos.
Material e métodos
Foi utilizado, no presente trabalho, o fungo Aspergillus niger, selecionado anteriormente como linhagem produtora de L-asparaginase pertencente a Coleção de Cultura de Micro-organismos do laboratório de microbiologia do CEDETEC/UESB campus Itapetinga - Bahia, onde foram realizados os estudos fermentativos. A cepa foi cultivada em dois Erlenmeyers de 500 mL contendo o meio composto por Potato Dextrose Ágar (PDA) e Ágar previamente autoclavados. Após deixar o meio solidificar, foi realizadas estrias do fungo na sua superfície com auxilio de uma alça de platina e o conjunto foi incubado a 25°C durante 7 dias. Passado o tempo de incubação, foi adicionada 30 mL de água destilada autoclavada nos Erlenmeyers e com auxílio de pérolas de cristal realizou-se a raspagem do fungo crescido na superfície do meio com agitação manual em movimento circular e foi obtido a solução de esporos. A solução obtida foi acondicionada em frasco de vidro e conservada na geladeira. A quantidade de esporos por mL da solução foi padronizada com o uso de uma câmara de Neubauer, sendo a concentração final inoculada de 59 x 107 esporos/mL. Toda a manipulação de microrganismo foi realizada na cabine de fluxo ultravioleta. Os galhos de pitaya foram obtidos de uma horta na cidade de Itapetinga - Bahia. Foi realizada a retirada dos espinhos e das hastes internas, aproveitando apenas a casca verde (imagem 1). As partes aproveitadas foram cortadas em pedaços de 5 cm e foram secas em estufas a 60°C até observar que a matéria esteja totalmente seca. Após a secagem, foi realizada a moagem usando uma malha granulométrica de diâmetro 2 mm e a matéria moída foi acondicionada em plástico. Também foi determinada a matéria seca do resíduo afim de saber o volume do agente umidificante da fermentação. Foi realizada uma cinética fermentativa nos tempos 24h, 36h, 48h, 60h, 72h, 84h, 96h e 108h para verificar o melhor tempo de produção. As fermentações foram realizadas em frascos de Erlenmeyer de 125 mL, utilizando 5 g do resíduo de pitaya como substrato, 10,940 mL (correspondente a 70% de umidade da fermentação) de uma solução de L-asparagina (1,5%) como agente umidificante e indutor, e 80 µL da solução de esporo, que foram incubados a 25°C. Os extratos brutos obtidos foram centrifugados e foram analisados quanto à atividade enzimática de L-asparaginase pelo método de imada et al. (1973) com algumas modificações e quanto ao teor de proteina pelo método de Bradford (1976). Os ensaios foram realizados em triplicata. Os resultados obtidos do ensaio da atividade enzimática da L-asparaginase foram submetidos à análise de variância (ANOVA) e as médias foram comparadas pelo teste Tukey a 5% de significância. O pacote estatístico SAS University Edition (SAS Institute Inc., Cary, NC, EUA) foi usado nas análises estatísticas.
Resultado e discussão
A produção da enzima L-asparaginase usando resíduo de pitaya como substrato por
fermentação em estado sólido a partir do fungo Aspergillus niger foi conduzida
por uma cinética fermentativa onde foi variado apenas o tempo afim de averiguar
o potencial do resíduo de produzir essa enzima. Para tal, foram realizadas as
dosagens da atividade enzimática volumétrica e de proteínas totais.
A figura 1 apresenta as atividades enzimáticas da L-asparaginase produzida nos
tempos testados durante a cinética fermentativa através da fermentação em estado
solido. Pode ser observado através dessa figura que o tempo ótimo de produção da
L-asparaginase por fermentação em estado sólido por Aspergillus niger a 25°C
usando como substrato o resíduo de pitaya foi 36 horas, apresentando uma
atividade enzimática volumétrica de 0,376 UI/mL. Já no tempo de 48 horas, pode-
se notar uma pequena diferença no valor da atividade enzimática apresentado
(0,344 UI/mL). Abaixo e acima dessa faixa de tempos, a atividade enzimática é
consideravelmente reduzida.
O tempo é um dos fatores que exercem grande influência sobre o crescimento dos
microrganismos associado a outros fatores como temperatura, pH e nutrientes do
meio em que se encontram. Nesse sentido, cada microrganismo ou espécie de
microrganismo precisa estar em suas condições favoráveis onde acontecem o seu
metabolismo e reações enzimáticas aumentando seu crescimento e, consequentemente
a produção de metabólitos de interesse (MADIGAN et al. 2009). Dessa forma, o
presente trabalho baseou-se na literatura, onde foi observado em trabalhos que o
fungo Aspergillus niger tem potencial em produzir L-asparaginase a 25°C,
temperatura que foi empregada neste estudo. Cunha et al., 2018 obteve no seu
estudo maiores produções de L-asparaginase por fermentação em estado sólido a
partir do fungo Aspergillus niger a 30°C em 48h (2380,11U/gds) e 25°C em 24h
(3023,98 U/gds) usando como substrato farinha de casca de maracujá. Os
resultados do trabalho desses autores assemelham-se aos obtidos no presente
estudo onde as maiores produções foram obtidas nos tempos 36h e 48h (0,376 e
0,344 UI/mL respectivamente); vale ressaltar que neste trabalho, foi observado
um valor considerável da atividade de L-asparaginase em 24h. A tabela 1 que
apresenta o teste de comparação das medias das atividades enzimáticas pelo teste
Tukey revela estatisticamente que não existe diferença significativa entre as
atividades obtidas nos tempos 36h e 48h ao nível de significância 5%, o que
confirma a corroboração do presente trabalho com o de Cunha et al., (2018).
Logo, estudos de produção otimizada de L-asparaginase podem ser desenvolvidos
nessa faixa de tempos por fermentação em estado sólido usando Aspergillus niger
e resíduos de pitaya como substrato.
Contrário ao trabalho de Cunha et al. (2018) e do presente trabalho, estudos
relacionados à produção da L-asparaginase por fermentação em estado sólido
usando Aspergillus niger e resíduos agroindustriais alternativos alcançaram
maior produção em tempos maiores. Dias et al. (2015) produziu L-asparaginase por
fermentação em estado sólido a partir de Aspergillus niger a 30°C usando uma
mistura ternária de Farelo de trigo, farelo de soja e farelo de algodão e obteve
maior produção de L-asparaginase em 96h. Essa produção de forma tardia pode
estar relacionada à questão da adaptabilidade do fungo no meio onde foi
inoculado, ou seja, o microrganismo precisa criar-se condições favoráveis para
se ambientar ao substrato usado durante a fermentação pelo fato que o meio não
seja igual ao seu habitat natural. Esse processo pode demandar mais tempo para
que o fungo atinja seu crescimento exponencial necessário para produzir os
metabólitos de interesse. Apoiando essa afirmativa, Asgher et al. (2016) e Amin
et al. (2017) alegam que a elevação na produção de metabólitos desejáveis está
intimamente relacionada à habilidade do microrganismo em se ajustar às condições
de crescimento em que é introduzido, assim como às suas características
genéticas. Dessa forma, poderia assim dizer que o resíduo de pitaya usado neste
trabalho como substrato proporcionou habitat similar ao de Aspergillus niger
juntos com outros fatores como umidade (70%), o indutor (L-asparagina) e a
temperatura (25°C), o que favoreceu seu crescimento rápido necessário para a
maior produção de L-asparaginase em curto tempo.
A pitaya é uma fruta da família Cactaceae e originária da América Central
e do Sul (Jalgaonkar et al., 2020). Ela é extensivamente cultivada em regiões
tropicais ou subtropicais e pode ser categorizada com base na aparência da polpa
(vermelha ou branca) e da casca (Jiang et al., 2021; Kylanel et al., 2020). A
Pitaya apresenta alto teor de umidade, com maior teor de carboidratos e
proteínas. O valor médio da sua fibra bruta é de 11,35%, e rica em minerais como
cálcio, potássio, ferro e manganês (Cordeiro et al., 2015). Devido a suas
características físico-químicas e por pertencer à família cactaceae, ela se
apresenta como candidato a ser usado como resíduo agroindustrial alternativo
para a produção de enzimas por fermentação em estado sólido como por exemplo a
L-asparaginase produzida no presente trabalho. Rabelo (2021) produziu L-
asparaginase por fermentação em estado sólido a partir de Aspergillus
caespitosus usando fibra de ora-pro-nóbis, que é da mesma família que a pitaya,
substrato usado neste trabalho, a 30°C e obteve maior produção no tempo 120h.
Isso mostra o potencial dos resíduos advindos das partes das plantes da família
cactaceae em produzir L-asparaginase e/ou outras enzimas.
A figura 2 apresenta as concentrações de proteínas totais dosadas pelo método de
Bradford (1976).
Pode-se observar que as concentrações de proteínas nos tempos 36h, 48 e 24h, que
apresentaram maiores atividades enzimáticas de L-asparaginase respectivamente,
são baixas. Isso pode ser entendido de tal forma que nesses tempos quase não
houve ou houve a produção de outro tipo de enzimas em quantidade minimizada. Já,
a partir de 60h a quantidade de proteína é crescente atingindo a concentração
maior no tempo 108h. Uma das explicações desse fato pode ser que nos primeiros
dias, as condições favoreceram a adaptação do fungo e o permitiram consumir a L-
asparagina usada como indutor e produziu apenas ou em maior quantidade a L-
asparaginase. E conforme o indutor foi reduzindo no meio, iniciou o metabolismo
de outros nutrientes que permitiram a produção de outras proteínas e/ou enzimas
em grandes quantidades. Dias (2016) produziu L-asparaginase por fermentação em
estado sólido usando Aspergillus niger e obteve a maior produção após 72h a
30°C. Em seguida, testou a atividade de proteases nos tempos maiores que 72h que
apresentaram diminuição na atividade de L-asparaginase. Neste teste, obteve a
maior atividade de proteases e concluiu que a diminuição da atividade de L-
asparaginase foi decorrente da presença de proteases.
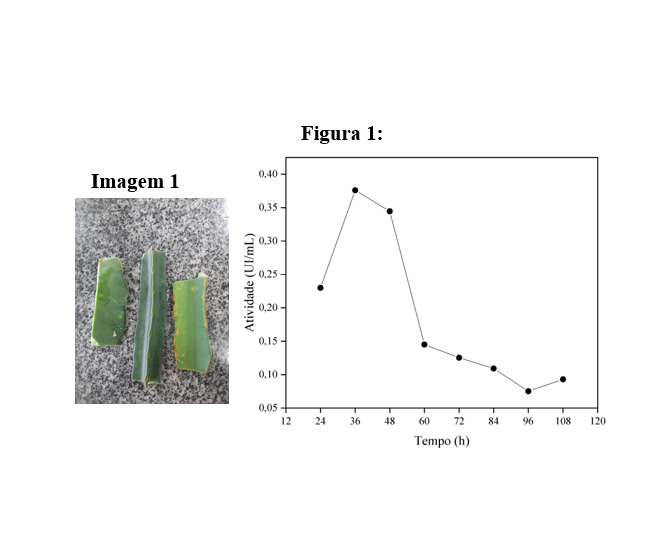
Imagem 1: Galho de pitaya usado como substrato\r\nFigura 1: Atividade enzimática da L-asparaginase \r\nresultante da cinética fermentativa
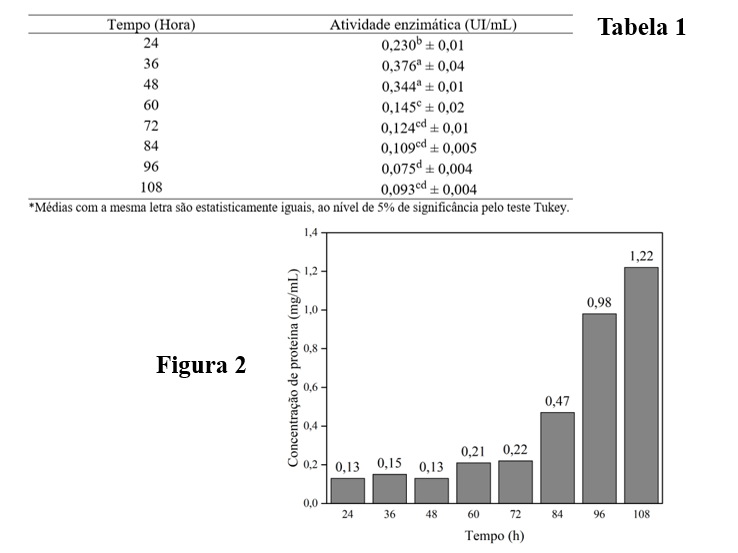
Tabela 1: Teste comparação das médias das \r\natividades enzimáticas pelo teste Tukey\r\nFigura 2: Resultados de proteínas totais pelo \r\nmétodo de Bradford
Conclusões
Pode-se concluir através deste estudo que os resíduos de pitaya utilizado no processo de fermentação em estado sólido demonstraram ser alternativas promissoras para a produção extracelular da enzima L-asparaginase por Aspergillus niger. Os tempos (36h e 48h) se mostraram os melhores tempos para produzir L-asparaginase por fermentação em estado sólido usando Aspergillus niger e resíduos de pitaya como substrato, por apresentarem as maiores atividades enzimáticas sem existência de diferença significativa entre elas (p>0,05). O fato de obter a atividade enzimática de l-asparaginase baixa e concentração de proteína elevada, conclui que os resíduos de pitaya tem capacidade de produzir outras proteínas e/ou enzimas por fermentação em estado sólido. Este estudo abre novas perspectivas para a produção de L-asparaginase por fermentação em estado sólido usando como substrato resíduos de pitaya. Estudos futuros devem avaliar a variação de outros fatores da fermentação afim de caracterizar uma produção otimizada da L-asparaginase usando esse mesmo substrato e modelar a otimização por modelos matemáticos. Pode-se realizar também os testes de estabilidade da enzima, purificação e aplicação em alimentos.
Agradecimentos
Ao CAPES por proporcionar bolsa de estudo de Mestrado; A UESB por proporcionar infraestrutura de pesquisa Ao Programa de pós-graduação em Engenharia e Ciências de Alimentos
Referências
AMIN, F. et al. Purification, Kinetic, and Thermodynamic Characteristics of an
Exopolygalacturonase from Penicillium notatum with Industrial Perspective. AppliedBiochemistry Biotechnology, v. 183, p. 426–443, 2017.
ASGHER, M. et al. Optimization of Lignocellulolytic Enzyme Production by Pleurotus eryngii WC 888 utilizing Agro-Industrial Residues and Bio-ethanol Production. RomanianBiotechnological Letters, v. 21, n. 1, p. 11133-11143, 2016.
BATOOL, T., MAKKY, E., JALAL, M., & YUSOFF, M. A comprehensive review on L-asparaginase and its applications. Applied Biochemistry and Biotechnology, vol. n. 178, pp. 900–923, 2016.
CUNHA, M. C., SILVA, L. C., SATO, H. H., CASTRO, R. J. S. Using response surfasse methodology to improve the L-asparaginase production by Aspergillus niger under solid-state fermentation. Biocatalysis and Agricultural Biotechnology, vol. 16, pp. 31–36, 2018.
DIAS, F. F. G., CASTRO, R. J. S., OHARA, A., NISHIDE, T. G., BAGAGLI, M. P., SATO, H. H. Simplex centroid mixture design to improve L-asparaginase production in solid-state fermentation using agroindustrial wastes. Biocatalysis and Agricultural Biotechnology, vol. 4, pp. 528–534, 2015.
DIAS, F. F. G. Produção, caracterização bioquímica e aplicação de L-asparaginase fúngica. Tese de Doutorado do Programa de Pós-Graduação em ciências de Alimentos da Faculdade de Engenharia de Alimentos da Universidade Estadual de Campinas, São Paulo, 2016.
EU, Food Standards Agency: Enforcement of regulations for acrylamide in food from April 18, 2018. https://www.food.gov.uk/sites/default/files/media/document/LA%20%20Information%20note%20on%20acrylamide%20April%202018.pdf, Acessed date: 27/08/2023.
IARC, (Acrylamide), Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans, Vol.60, 389-483, 1994.
IZADPANAH, F., HOMAEI, A., FERNANDES, P., JAVADPOUR, S. Marine microbial L-asparaginase: Biochemistry, molecular approaches and applications in tumor therapy and in food industry. Microbiological Research, vol. 208, pp. 99–112, 2018.
JALGAONKAR, K., MAHAWAR, M.K., BIBWE, B., KANNAUJIA, P. Postharvest Profile, Processing and Waste Utilization of Dragon Fruit (Hylocereus Spp.): A Review. pp. 733–759, 2020.
JECFA. Compendium of food additive specifications. Monograph N°. 4. Rome: FAO, 2007.
JIANG, H., ZHANG, W., LI, X., SHU, C., JIANG, W., CAO, J. Nutrition, phytochemical profile, bioactivities and applications in food industry of pitaya (Hylocereus spp.) peels: a comprehensive review. Trends Food Sci. Technol. Vol. 116, 199–217, 2021.
MADIGAN, M. T. et al. Brock Biology of microorganisms. 12ed. 2009.
MAQSOOD, B., BASIT, A., KHURSHID, M., BASHIR, Q. Characterization of a thermostable, allosteric L-asparaginase from Anoxybacillus flavithermus. International Journal of Biological Macromolecules, v. 152, p. 584-592, 2020.
MEGHAVARNAM, A. K.; JANAKIRAMAN, S. Evaluation of acrylamide reduction potential of L-asparaginase from Fusarium culmorum (A SP-87) in starchy products. LWT- Food Science and Technology, v. 89, p. 32-37, 2018.
NIU, JIAFENG et al. Non-classical secretion of a type I L-asparaginase in Bacillus subtilis. International Journal of Biological Macromolecules., v. 180, p. 677-683, 2021.
RABELO, N. G. Produção e purificação de l-asparaginase por Aspergillus caespitosus CCDCA 11593. Dissertação do Programa de Pós-Graduação em
Microbiologia Agrícola de Lavras. Minas Gerais, 2021.
THOMAS, L., LARROCHE, C., PANDEY, A. Current developments in solid-state fermentation. Biochem Eng J. vol. 81, p. 146–161, 2013. doi: 10.1016/j.bej.2013.10.013.
UPPULURI, K. B., DASARI, R. K. V. R., SAJJA, V., JACOB, A. S., & REDDY, D. S. R. Optimization of L-asparaginase production by isolated Aspergillus niger C4 from sesame (black) oil cake under SSF using Box-Behnken design in column bioreactor. International Journal of Chemical Reactor Engineering, vol. 11, p. 103–109, 2013.
VIEIRA, W.F., CORREA, G. T., CAMPOS, E. S., SETTE, L. D., PESSOA Jr, A., CARDOSO, V. L., FILHO, U. C. A novel multiple reactor system for the long-term production of L-asparaginase by Penicillium sp. LAMAI 505, Process Biochemistry, V. 90, pp. 23–31, 2020.
YIM, S.; KIM, M. Purification and characterization of thermostable L-asparaginase from Bacillus amyloliquefaciens MKSE in Korean soybean paste. LWT, v. 109, p. 415 421, jul. 2019.
















